Bactérie lactique
Les bactéries lactiques sont des bactéries à Gram positif, anaérobies partiellement tolérantes à l'oxygène, ne produisant pas en général de spores, se présentant sous formes de coques ou de bâtonnets et capables de fermenter les sucres en acide lactique[1]. On les caractérise[2] aussi par le faible contenu de leur ADN en paires de bases G-C guanine-cytosine (< 50 %) sauf pour les bifidobactéries qui ont un taux supérieur à 50 % de GC. Elles ont pour habitat de nombreux milieux naturels et accompagnent l'activité humaine en tant que bactéries de la flore commensale des muqueuses et de la flore alimentaire.
Suivant la classification taxonomique courante[3], elles appartiennent au phylum Firmicutes, la classe Bacilli et à l'ordre Lactobacillales, comportant les familles suivantes : Aerococcaceae, Carnobacteriaceae, Enterococcaceae, Lactobacillaceae, Leuconostocaceae et Streptococcaceae. Les Bifidobacteriaceae (en) de l'ordre des Bifidobacteriales (en) sont aussi classées parmi les bactéries lactiques.
Habitat
Les bactéries lactiques sont présentes dans de nombreux milieux naturels, allant du sol, des plantes en décomposition, aux animaux. Chez ces derniers, on les trouve dans les cavités buccales et vaginales, les fèces et le lait. Le tractus gastro-intestinal des mammifères est colonisé par des bactéries lactiques comme Bifidobacterium, Lactobacillus, Leuconostoc, et Weissella (en).
Utilisations
Elles ont été utilisées par l'homme depuis le néolithique pour fabriquer des aliments fermentés. Leur production d'acide lactique permet d'acidifier le substrat et par là d'inhiber la prolifération de germes pathogènes ou d'agents indésirables provoquant des modifications organoleptiques. La fermentation améliore la conservation et modifie la saveur des aliments. On trouve des bactéries lactiques dans les produits laitiers (yaourts, fromages), les légumes fermentés (olives, cornichons, choucroute), les boissons alcooliques fermentées (vin, bière, cidre), la charcuterie (jambon, saucissons) et le pain au levain.
| Principaux produits issus de la fermentation des bactéries lactiques (d'après Spinnler[4]) | |||
| Famille | Genre | Substrat | Exemples |
|---|---|---|---|
| Lactobacillaceae | Lactobacillus | lait | laits fermentés, yaourts, kéfirs, la plupart des fromages |
| viande | saucissons secs, jambons secs | ||
| poissons | nuoc mam | ||
| végétaux | choucroute, olives, "yaourts" au lait de soja | ||
| céréales | pain au levain, bières, huangjiu | ||
| Pediococcus | végétaux | choucroute, ensilage | |
| viande | saucisses semi-séchées, saucissons secs | ||
| poissons | nuoc mam | ||
| céréales | pain au levain, riz fermenté | ||
| Streptoccaceae | Lactococcus | lait | fromages blancs, à pâte molle ou pressée non cuite, kéfirs |
| Streptococcus | lait | yaourts, laits fermentés, fromages à pâte pressée cuite | |
| Enterococcaceae | Tetragenococcus | végétaux | sauce de soja, miso |
| poissons | saumure d'anchois, sauce de poisson, nuoc mam | ||
| Leuconostocaceae | Leuconostoc | végétaux | choucroute, olives, vin, cidre |
| lait | fromages, kéfirs | ||
| Oenococcus | végétaux | vin | |
| Bifidobacteriaceae | Bifidobacterium | lait | laits fermentés |
Les bactéries lactiques sont aéro-anaérobies ou micro-aérophiles. En présence d'oxygène, la plupart sont incapables de respirer[N 1].
Ce sont aussi des bactéries exigeantes d'un point de vue nutritionnel car elles sont incapables de synthétiser un certain nombre d'acides aminés[5] (on dit qu'elles sont auxotrophes pour ces composés). La bactérie lactique modèle, Lactococcus lactis est auxotrophe pour 7 à 12 acides aminés selon les souches. L'incapacité à synthétiser ces acides aminés nécessaires à leur croissance, oblige les bactéries lactiques à trouver ces molécules dans leur milieu via un processus de nutrition azoté.
Leur culture demande des milieux riches en sucres, acides aminés, acides gras, sels et vitamines et pauvres en oxygène. Elles sont généralement cultivées dans la gélose MRS (de Man, Rogosa, Sharpe). Elles sont aptes à survivre dans des milieux très acides.
Fermentation des glucides
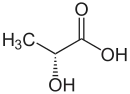
Les bactéries lactiques étant incapables d'obtenir leur énergie par la respiration, elles recourent à la fermentation des glucides en acide lactique.
Pour être métabolisés, les sucres du milieu extérieur doivent d'abord franchir la membrane cellulaire. Il existe deux systèmes de transport actif des sucres[6] :
- un système qui couple le transport et la phosphorylation du glucide (phosphorylation en cascade) nommé le « système phosphotransferase phosphoénolpyruvate dépendant » PTS. L'entrée d'un sucre est couplée à celle d'un proton. Le sucre est ensuite phosphorylé dans la cellule par des kinases.
- un système qui fait pénétrer les glucides sous forme libre dit système « perméase énergie dépendant ». C'est un système de translocation de groupe qui phosphoryle le substrat tout en lui faisant traverser la membrane.
Suivant les espèces, les sucres sont ensuite catabolisés suivant une des trois voies différentes : la voie homofermentaire, la voie hétérofermentaire et la voie bifide[6].
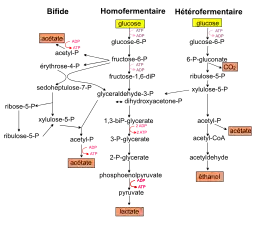
- La voie homofermentaire utilise la glycolyse dans sa totalité, du glucose au pyruvate puis lactate. En condition optimale de croissance, cette voie produit deux molécules de lactate et deux molécules d'ATP par molécule de glucose consommée. Pour être qualifiée d'homolactique, cette voie doit convertir au moins 90 % du glucose consommé en lactate. Mais dans des conditions de croissance non optimales (milieu appauvri, sur certains sucres, avec des souches mutées…), les bactéries lactiques homofermentaires peuvent présenter un métabolisme mixte, caractérisé par la production d'acide lactique, d'acide acétique, d'éthanol et d'acide formique et/ou de CO2. La voie homofermentaire est généralement associée aux bactéries des genres Streptococcus, Lactococcus, Pediococcus, Lactobacillus.
- La voie hétérofermentaire produit outre l'acide lactique, des quantités significatives de CO2 et d'éthanol ou d'acétate. La dégradation d'une molécule de glucose conduit à la formation d'une molécule de lactate, une molécule d'éthanol (CH3CH2OH), d'un CO2 et d'un ATP. Une enzyme spécifique de cette voie (la D-xylulose-5-phosphate phosphocétolase) catalyse la dissociation du xylulose-5-phosphate en acétyl-P et glycéraldéhyde-3-phosphate. L'acétyl-P est converti ensuite soit en éthanol soit en acétate selon les besoins en ATP ou NAD+. Le glycéraldéhyde-3-phosphate rejoint la glycolyse pour être converti en lactate. En général, les sucres à 5 atomes de carbones (ou pentoses) ne peuvent être métabolisés que par cette voie. Certaines bactéries Leuconostoc et Lactobacillus empruntent cette voie hétérofermentaire.
- La voie fermentaire bifide (ou voie de la fructose-6-P phosphocétolase FPC) est la voie empruntée par les bactéries du genre Bifidobacterium. Pour une molécule d'hexose consommée, cette voie produit 1,5 molécule d'acétate et 2,5 molécules d'ATP.
Les hexoses autres que le glucose (mannose, galactose, fructose) rejoignent en général les voies précédentes après différentes étapes d'isomérisations et de phosphorylation en glucose-6-P et fructose-6-P. Le lactose entre dans la cellule par le système PTS, puis est phosphorylé en lactose-6-phosphate et hydrolysé à l'intérieur de la cellule en glucose et galactose-6-phosphate. Il rejoint finalement la glycolyse au niveau des trioses-phosphate. Les pentoses consommés (ribose, arabinose, xylose) sont convertis en xylulose-5-phosphate par des réactions de phosphorylation et d'isomérisation ou d'épimérisation.
Métabolisme du citrate
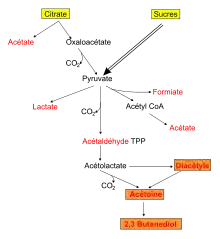
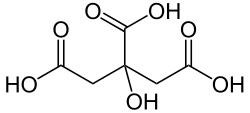
Les bactéries lactiques sont à la base de la fabrication de fromages, de yaourts et de laits fermentés. Dans l'industrie laitière, l'acide citrique présent dans le lait est considéré comme le principal précurseur de la formation des composés aromatiques appréciés comme l'acétate, l'acétoïne (odeur de beurre) et le diacétyle (odeur de fromage). Par contre, lorsque le diacétyle est produit à haute concentration dans la fermentation du vin, de la bière ou des saucissons (par Lactobacillus plantarum et Oenococcus oeni), il est à l'origine d'altérations organoleptiques[8].
En condition d'aérobiose, le métabolisme de l'acide citrique s'effectue via le cycle de Krebs, mais en condition d'anaérobiose, une voie métabolique spécifique alternative est nécessaire. Seul un petit nombre de bactéries lactiques sont capables de fermenter le citrate. Elles possèdent une citrate perméase assurant le transport de celui-ci du milieu extérieur à l'intérieur de la cellule et une citrate lyase capable de le convertir en oxaloacétate et acétate.
Les ferments mésophiles dont la température optimale de croissance est proche de 30 °C, sont utilisés dans l'élaboration des produits laitiers frais (fromages frais, beurre, crèmes fraîches). Ils sont composés de bactéries acidifiantes comme Lactococcus et de bactéries aromatisantes comme Leuconostoc et Lactococcus lactis subsp. lactis biovar. diacetylactis[7]. La voie de fermentation est homofermentaire chez Lactococcus et hétérofermentaire chez Leuconostoc avec formation équimolaire de lactate, éthanol et de CO2.
Chez Leuconostoc, des deux métabolismes concurrents de dégradation du citrate et du glucose, la voie de l'acétolactate du premier est favorisée et le flux du pyruvate se dirige vers la synthèse des composés aromatiques (composés en C4 : acétoïne, diacétyle, 2,3-butanediol). La production de CO2 provenant de l'utilisation du citrate, est à l'origine de la formation des cavités dans le caillé, qui seront ensuite peuplées par le Penicillium, donnant l'aspect veiné des fromages à pâte persillée. Le diacétyle est le composé aromatique principal recherché par les produits frais tels que beurre, fromage frais et crème fraîche. L'acétaldéhyde permet de donner une note de fraîcheur aux produits laitiers, particulièrement appréciée dans les yaourts.
La production d'exopolysaccharides
Les bactéries synthétisent plusieurs types de polysaccharides :
- certains localisés à l'intérieur de la cellule, dans le cytoplasme, joue le rôle de source d'énergie
- d'autres se trouvent dans la paroi, tels que les peptidoglycanes et les acides téichoïques
- enfin certains sont excrétés à l'extérieur de la cellule. Ils sont nommés exopolysaccharides[9] (EPS). Ils peuvent rester attachés à la membrane bactérienne (pour les EPS capsulaires formant une pellicule entourant la paroi bactérienne.) ou être relâchés dans le milieu (pour les EPS libres). Ils sont impliqués dans la protection de la cellule bactérienne contre les conditions physiques, chimiques et biologiques défavorables de leur environnement.
Les EPS produits par les bactéries lactiques sont utilisés dans l'industrie laitière pour augmenter la viscosité du lait et la fermeté des produits fermentés et réduire la séparation de l'eau et du gel (synérèse). Ils évitent l'utilisation d'additifs alimentaires, tout en ayant des propriétés équivalentes d'agents stabilisants et épaississant sur la texture des produits laitiers. Les yaourts produits à grande échelle ne sont pas fermentés dans leur pot, mais sont agités et transportés avant leur soutirage. Pour garder leur texture, il faut augmenter leur viscosité soit avec des agents polysaccharides d'autres origines (carraghénanes, alginates, xanthanes) soit en utilisant les EPS des bactéries lactiques. Une autre utilisation étudiée, est l'emploi des bactéries lactiques épaississantes productrices d'EPS pour la production de fromage allégé (mozzarella, cheddar) permettant d'améliorer la rétention de l'humidité.
Les EPS des bactéries lactiques n'ont pas de flaveur et si leurs propriétés épaississantes sont intéressantes pour les produits laitiers, elles peuvent aussi entraîner la détérioration de la qualité des boissons comme la bière ou le vin ou rendre impropre à la consommation les viandes emballées sous vide (par des EPS produits par des Leuconostoc).
Plusieurs études[9] ont montré les propriétés potentiellement bénéfiques pour la santé des EPS : abaissement du cholestérol, propriétés anti-ulcère, anti-tumorale et immunomodulante. Le dextrane sulfate est employé comme anticoagulant et anti-inflammatoire. Les EPS ont été classés parmi les fibres alimentaires parce qu'elles peuvent favoriser la croissance des bactéries probiotiques dans le tractus gastro-intestinal.
Plusieurs EPS ont un potentiel intéressant d'applications industrielles. Les dextranes (EPS constitué de résidus de glucose liés en α-1,6) sont utiles en assainissement biologique de l'environnement, pour la récupération assistée de pétrole ou pour l'épuration des eaux usées.
Le dextrane est synthétisé en bioréacteur par Leuconostoc mesenteroides dans une solution de saccharose. La production industrielle d'EPS nécessite des stratégies pour réduire la concentration des lactates dans la culture qui inhibent la croissance bactérienne. Des procédés de fermentation à écoulement discontinu (fed-batch) ont été utilisés à cette fin.
La production de bactériocines
Les bactériocines sont des peptides antimicrobiens de faible poids moléculaire, sécrétés par les bactéries. Ils possèdent une activité inhibitrice contre les bactéries taxonomiquement proches et contre certains pathogènes majeurs tels que Bacillus cereus (responsable d'intoxication alimentaire), Clostridium botulinum (produisant la toxine botulique) et Listeria monocytogenes[9]. Les bactéries productrices sont protégées de l'action de leurs propres bactériocines. Toutes les bactériocines produites par des bactéries lactiques décrites jusqu’à présent ont une activité dirigée contre les bactéries Gram-positives (Dordu et al, 2009)[10].
De nombreuses bactériocines sont produites par les bactéries lactiques des genres Lactobacillus, Lactococcus, Pediococcus, Carnobacterium, Leuconostoc, Enterococcus et Streptococcus. Elles sont particulièrement intéressantes pour l'industrie agro-alimentaire en raison de leur innocuité reconnue pour l'homme. Grâce à leur mode d'action différent des antibiotiques conventionnels, elles intéressent aussi l'industrie pharmaceutique car elles pourraient devenir une alternative à antibiothérapie actuelle face à la résistance des bactéries pathogènes.
Les bactériocines sont réparties en trois classes (Cleveland et als, 2001)[11] :
- Les bactériocines de classe I ou lantibiotiques (lanthionine containing antibiotic). Ils possèdent une masse moléculaire comprise entre 1,8 et 4,1 kDa, contiennent des acides aminés obtenus par modifications post-traductionnelles et sont produits par des Lactococcus, Lactobacillus, Streptococcus. Cette classe est subdivisée dans les sous-groupes de la nisine, lacticine 481, mersacidine, cinnamycine, lactocine S et le groupe à deux composants. La nisine agit contre les bactéries à Gram positif (Listeria, Clostridium, Staphylococcus, Mycobacterium). Elle est obtenue à partir de cultures de Lactococcus lactis sur des substrats naturels comme le lait ou du dextrose. Dans les industries de transformation des fromages, viandes et boissons, elle est utilisée pour prolonger la durée de vie de ces produits (additif alimentaire E234). La lacticine 481 sécrétée par L. lactis subsp. lactis CNRZ 481, est une bactériocine active contre la plupart des bactéries lactiques et contre Clostridium tyrobutyricum[12].
- Les bactériocines de classe II sont de faible masse moléculaire (moins de 10 KDa), thermostables et ne subissent pas de modifications post-traductionnelles. La lactococcine A sécrétée par Lactococcus lactis IL1403 a été la mieux étudiée. Les bactériocines de la classe IIa sont actives contre les bactéries des genres Listeria, Enterococcus, Lactobacillus, et Clostridium[9]. Actuellement, 27 de ces bactériocines ont été décrites. Elles agissent en perméabilisant les membranes cibles, ce qui provoque un déséquilibre de la balance ionique et une fuite des phosphates inoarganiques. La cellule cible fragilisée, finit par mourir.
- Les bactériocines de classe III ont une masse moléculaire supérieure à 10 kDa et sont thermosensibles. Ont été décrites : l'helvéticine produite par Lactobacillus helveticus utilisée dans la production d'emmental, la zoocine A produite par Streptococcus zooepidermicus etc.
Les bactériocines sont produites industriellement en fermenteurs sur un substrat alimentaire. L'ajout des nutriments lors de fermentation à écoulement discontinu (en fed-batch) permet souvent d'augmenter la production comparativement à une culture en batch. La procédure de purification des bactériocines est longue et couteuse. Elles sont généralement proposées sous forme semi-purifiée et sèche[10].
Annexes
Notes
- Les bactéries lactiques ne peuvent synthétiser les cytochromes et donc sont incapables de phosphorylations oxydatives.
Références
- (en) Arthur C. Ouwehand, Atte von Wright, Sampo Lahtinen et Seppo Salminen, Lactic Acid Bacteria : Microbiological and Functional Aspects, Fourth Edition, CRC Press, , 4e éd., 798 p. (ISBN 978-1-4398-3677-4 et 1-4398-3677-9, présentation en ligne)
- W. H. N. Holzapfel et B. J. Wood, The Genera of Lactic Acid Bacteria, Springer-Verlag New York Inc., (ISBN 978-1-4613-7666-8 et 1-4613-7666-1)
- « Lactobacillales », sur www.uniprot.org (consulté le )
- Henry-Eric SPINNLER, Technologies de Transformation des produits agroalimentaires, Ed. Techniques Ingénieur
- Djamel DRIDER et Hervé PREVOST, Bactéries lactiques, Physiologie, Métabolisme, Génomique et Applications industrielles, Economica, , 593 p., chap. II (« Métabolisme des bactéries lactiques, les acides aminés, Véronique MONNET »)
- Djamel DRIDER et Hervé PREVOST, Bactéries lactiques, Physiologie, Métabolisme, Génomique et Applications industrielles, Economica, , 593 p., chap. II (« Métabolisme des bactéries lactiques, Devenir du carbone, Pascal LOUBIERE, Muriel COCAIGN-BOUSQUET »)
- Djamel DRIDER et Hervé PREVOST, Bactéries lactiques, Physiologie, Métabolisme, Génomique et Applications industrielles, Economica, , 593 p., chap. II (« Métabolisme des bactéries lactiques, Le Citrate, S. BEKAL, Y. BELGUESMIA, D. DRIDER, H. PREVOST »)
- Edited by Baltasar Mayo, Paloma Lopez et Gaspar Perez-Martinez, Molecular Aspects of Lactic Acid Bacteria for Traditional and New Applications 2008, Research Signpost, (ISBN 978-81-308-0250-3 et 81-308-0250-3)
- Djamel DRIDER et Hervé PREVOST, Bactéries lactiques, Physiologie, Métabolisme, Génomique et Applications industrielles, Economica, , 593 p., chap. II (« Métabolisme des bactéries lactiques, Les bactériocines : de la synthèse aux application, Ségolène CALVEZ, Y. BELGUSMIA, G. KERGOURLAY, H. PREVOST, D. DRIDER »)
- Carine Dortu, Philippe Thonart, « Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la bioconservation des produits alimentaires », Biotechnol. Agron. Soc. Environ., vol. 13, no 1, , p. 143-154 (lire en ligne)
- Jennifer Cleveland, Thomas J. Montville, Ingolf F. Nes, Michael L. Chikindas, « Bacteriocins: safe, natural antimicrobials for food preservation », International Journal of Food Microbiology, vol. 71, , p. 1-20 (lire en ligne)
- [txt] Jean-Christophe Piard, Georges Novel, « La lacticine 481, une nouvelle bactériocine de type lantibiotique produite par Lactococcus lactis: caractérisation biochimique et génétique = Lacticin 481, a new lantibiotic-type bacteriocin produced by Lactococcus lactis: biochemical and genetic characterization » (consulté le )
Bibliographie
- Orla-Jensen M.L.D (1924). La classification des bactéries lactiques. Le lait, 4(36), 468-474
- Desmazeaud M (1996). Les bactéries lactiques dans l’alimentation humaine: utilisation et innocuité. Cahiers agricultures, 5(5), 331-343.
- Portail de la microbiologie