Géométrie moléculaire linéaire
En chimie, une géométrie moléculaire linéaire décrit un arrangement dans l'espace correspondant à un atome central lié à deux autres atomes, ou ligands, formant un angle de liaison de 180°. Les molécules organiques linéaires, comme l'acétylène HC≡CH, sont souvent décrites comme résultant d'une hybridation sp de leurs atomes de carbone.
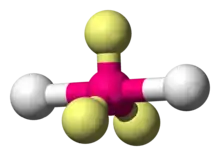
Molécules diatomiques
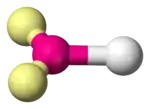
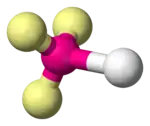
Les molécules diatomiques sont linéaires par définition. Elles sont formées d'un atome central, noté A, lié à un ligand, noté X, avec de zéro à trois doublets non liants, notés E, sur l'atome central ; ces configurations sont notées respectivement AX, AXE, AXE2 et AXE3, et correspondent par exemple aux molécules de fluorure d'hydrogène HF, de cyanure CN–, d'oxygène O2 et de chlorure d'hydrogène HCl, respectivement.
 |  |  | ||
| Notation VSEPR | AX1E0 (AX1) | AX1E1 | AX1E2 | AX1E3 |
| Exemple | H2 | CN− | O2 | HCl |
| Symétrie moléculaire | C∞v | C∞v | C∞v | C∞v |
| Nombre stérique | 1 | 2 | 3 | 4 |
| Coordinence | 1 | 1 | 1 | 1 |
| Doublets non liants | 0 | 1 | 2 | 3 |
| µ (polarité) | 0 | ≠ 0 | ≠ 0 | ≠ 0 |
Molécules triatomiques
 | ||
| Notation VSEPR | AX2E0 | AX2E3 |
| Exemple(s) | BeF2 | KrF2, XeF2 |
| Symétrie moléculaire | D∞h | D∞v |
| Nombre stérique | 2 | 5 |
| Coordinence | 2 | 2 |
| Doublets non liants | 0 | 3 |
| µ (polarité) | 0 | 0 |
| Angle de liaison | 180° | 180° |
Selon la théorie VSEPR, une molécule triatomique peut être linéaire si elle comprend zéro ou trois doublets non liants, configurations notées respectivement AX2 et AX2E3 et qui correspondent par exemple au fluorure de béryllium[1] BeF2 et au difluorure de krypton KrF2, respectivement. Le dioxyde de carbone CO2, le sulfure de carbonyle COS, le cyanure d'hydrogène HCN, les anions azoture N3– et thiocyanate SCN–, et le cation nitronium[2] NO2+ sont des espèces chimiques linéaires sans doublet non liant, correspondant à la configuration AX2. Le difluorure de xénon[3] XeF2 et l'anion triiodure I3– sont quant à eux des exemples d'espèces chimiques linéaires avec trois doublets non liants, correspondant à la configuration AX2E3 : dans cette dernière, les cinq doublets de l'atome central présentent une géométrie bipyramidale trigonale dans laquelle les doublets non liants occupent les trois positions équatoriales et les deux ligands occupent les deux positions axiales.
Dans leur phase gazeuse, le fluorure de béryllium BeF2, le chlorure de béryllium BeCl2 et le dioxyde de silicium SiO2 sont des molécules linéaires. En ce qui concerne les composés organométalliques, on peut citer le diméthylmercure (CH3)2Hg et le diméthylzinc (CH3)2Zn.
Lorsque ces molécules présentent un centre d'inversion, leur groupe de symétrie est D∞h, et C∞v dans le cas inverse. Les molécules linéaires avec une symétrie d'inversion, tels que le disulfure de carbone CS2, sont apolaires et par conséquent leur moment dipolaire est nul.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Linear molecular geometry » (voir la liste des auteurs).
- (en) C. E. Housecroft et A. G. Sharpe, Inorganic Chemistry, 2e édition, Prentice Hall, 2004, p. 43. (ISBN 978-0130399137)
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the Elements, 2e édition, Butterworth-Heinemann, Oxford, 1997. (ISBN 0-7506-3365-4)
- (en) C. E. Housecroft et A. G. Sharpe, Inorganic Chemistry, 2e édition, Prentice Hall, 2004, p. 47. (ISBN 978-0130399137)