Géométrie moléculaire bipyramidale trigonale
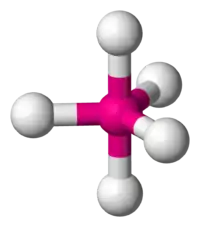
En chimie, une géométrie moléculaire bipyramidale trigonale est la géométrie des molécules où un atome central, noté A, est lié à cinq atomes, groupes d'atomes ou ligands, notés X, aux sommets d'une bipyramide triangulaire, ou « diamant triangulaire ». Cette configuration est notée AX5E0 selon la théorie VSEPR.
| Géométrie moléculaire bipyramidale trigonale | |
| |
| Notation VSEPR | AX5E0 (AX5) |
|---|---|
| Exemple(s) | PF5 |
| Symétrie moléculaire | D3h |
| Nombre stérique | 5 |
| Coordinence | 5 |
| Doublet non liant | 0 |
| μ (Polarité) | 0 |
| Angle de liaison | 90°, 120°, 180° |
C'est l'un des rares cas où les angles de liaison ne sont pas identiques (voir aussi bipyramide pentagonale), ce qui s'explique simplement par le fait qu'il n'existe pas d'arrangement géométrique qui peut résulter en cinq angles égaux dans les trois dimensions.
Comportement
Les isomères avec une géométrie bipyramidale trigonale sont capables de s'interconvertir par un procédé connu sous le nom de pseudorotation de Berry. La pseudorotation est similaire conceptuellement au mouvement d'un diastéréoisomère conformationnel, même si aucune révolution entière n'est complétée. Dans ce procédé de pseudorotation, deux ligands équatoriaux (les deux qui ont une longueur de liaison plus petite que les trois autres) se « décalent » vers l'axe de la molécule, alors que simultanément les ligands axiaux se décalent vers l'équateur, créant un mouvement cyclique constant. La pseudorotation est particulièrement notable dans les molécules simples, telles que PF5.
Exemples

Le pentafluorure de phosphore (PF5) est une molécule à géométrie bipyramidale trigonale. L'atome de phosphore partage un plan avec trois des atomes de fluor qui ont un angle de 120° entre eux (positions équatoriales), les deux atomes de fluor restants étant au-dessus et en dessous du plan (positions apiques ou axiales). L'ion triiodure est aussi basé sur une bipyramide trigonale, mais avec les positions équatoriales occupées par des doublets non liants. Dans les composés du phosphore avec des substituants différents, on observe un phénomène connu sous le nom d'apicophilicité.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trigonal bipyramidal molecular geometry » (voir la liste des auteurs).