Diagramme d'orbitales moléculaires
Un diagramme des niveaux d’énergie des orbitales moléculaires, ou diagramme d'orbitales moléculaires, est un outil qualitatif fondé sur la théorie des orbitales moléculaires et en particulier sur la méthode de combinaison linéaire des orbitales atomiques[1]. D'après ces théories, lorsque des atomes se lient pour former une molécule, un certain nombre d'orbitales atomiques se combinent pour former le même nombre d'orbitales moléculaires. Un diagramme d'orbitales moléculaires représente les niveaux d'énergie de ces orbitales moléculaires.
Cet outil est particulièrement approprié à la description des molécules diatomiques. Il peut permettre par exemple d'expliquer pourquoi des molécules existent dans la nature et d'autres non, la force relative de liaisons chimiques ainsi que l'origine de certaines propriétés physiques comme le moment dipolaire et le diamagnétisme ou le paramagnétisme de molécules. Dans cet article, OM est utilisé pour Orbitale Moléculaire et OA pour Orbitale Atomique.
Conventions
Représentation
L'axe énergétique est vertical, orienté vers le haut. Les niveaux d'énergies des OM sont représentés par de courtes lignes horizontales au centre du diagramme, flanqués de part et d'autre par les niveaux d'énergie des OA combinées. Des lignes, souvent en pointillés, connectent les niveaux d'énergies des OM avec les niveaux d'énergie des OA à partir desquelles elles sont formées. Les orbitales peuvent être représentées schématiquement à côté de leur niveau énergétique.
Recouvrement des orbitales atomiques

Lorsque deux orbitales atomiques, centrées sur deux noyaux atomiques différents, interagissent pour former deux orbitales moléculaires, le recouvrement des OA dans la région située entre les deux noyaux peut se faire de deux façons différentes selon le signe des fonctions d'onde associée aux OA. Le signe d'une fonction d'onde peut être représenté graphiquement soit par un signe plus ou moins, soit en noircissant un lobe de l'orbitale. Le signe d'une fonction d'onde n'a aucune signification physique en lui-même, il intervient juste lors de la combinaison de plusieurs orbitales.
Si les fonctions d'onde associées aux deux orbitales atomiques sont de même signes dans la région internucléaire, où elles se recouvrent, on dit que le recouvrement entre orbitales est constructif. Un tel recouvrement augmente la probabilité de trouver un électron dans cette région de l'espace. Les orbitales moléculaires formées à partir d'un recouvrement constructif, si elles sont occupées par des électrons, aident à lier deux atomes. Elles sont donc appelées orbitales liantes[2]. Une OM liante est caractérisée par une énergie plus faible que les énergies des OA dont elle est constituée.
Au contraire, si les fonctions d'onde associées aux deux orbitales atomiques sont de signes opposés dans la région internucléaire, on dit que le recouvrement entre orbitales est destructif. Un tel recouvrement diminue la probabilité de trouver un électron dans cette région de l'espace. Les OM formées à partir d'un recouvrement destructif sont appelées orbitales antiliantes et contribuent, si elles sont occupées par des électrons, à une déstabilisation de la liaison chimique. Une OM antiliante est caractérisée par une énergie plus forte que les énergies des OA dont elle est constituée et possède un plan nodal perpendiculaire à l'axe internucléaire. Les orbitales antiliantes sont repérées par des astérisques (*) dans le diagramme d'OM.
Si le recouvrement entre deux orbitales atomiques est nul, soit parce qu'elles ne se recouvrent pas, soit parce qu'un recouvrement constructif dans une région compense exactement un recouvrement destructif dans une autre région, alors l'OM est appelée orbitale non-liante. Une OM non-liante a la même énergie que celle des OA qui la constitue.
Symétries σ, π et δ
On note σ une orbitale moléculaire possédant une symétrie cylindrique autour de l'axe internucléaire.
On note π une orbitale moléculaire qui possède un seul plan nodal contenant l'axe internucléaire.
On note δ une orbitale moléculaire qui possède deux plans nodaux différents contenant l'axe internucléaire.
Symétrie centrale
Une notation supplémentaire est utilisée pour les OM des molécules diatomiques homonucléaires (formée à partir de deux atomes du même élément chimique). Si l’orbitale est symétrique par rapport au centre de masse des deux noyaux (le signe de l'orbitale moléculaire est inchangé par cette opération de symétrie), l'OM est qualifiée de gerade (paire en allemand) et on lui ajoute un indice "g". Si l'orbitale est antisymétrique par rapport au centre de masse des deux noyaux (le signe de l’OM est transformé en son opposé par cette opération de symétrie), l'OM est qualifiée de ungerade (impaire en allemand) et on lui ajoute un indice "u".
Règles de remplissage en électrons
Le remplissage des orbitales moléculaires du diagramme s'effectue selon les trois règles suivantes :
- La règle de Klechkowski : on remplit en premier les orbitales de plus basses énergie avant de remplir les orbitales d'énergies supérieures
- Le principe d'exclusion de Pauli : une orbitale moléculaire ne peut contenir au maximum que deux électrons, ceux-ci possédant des spins opposés
- La règle de Hund : lors du remplissage de plusieurs OM de même énergie, on met d'abord un électron dans chaque orbitale, avec le même spin pour chacun, avant de mettre deux électrons de spins opposés dans la même orbitale.
Indice de liaison
L'indice (ou l'ordre) d'une liaison chimique est défini par :
L'indice de liaison correspond au nombre de liaisons entre les atomes (un indice de liaison de 2 correspond par exemple à une double liaison). Pour qu'une liaison soit stable, il faut que l'indice de liaison soit strictement positif. Si l'indice de liaison est négatif ou nul, la liaison chimique est instable et tend à se rompre.
Construction d'un diagramme
Règles de construction
On peut montrer que lorsque deux OA d'énergie identique interagissent, pour former deux OM, l'énergie de stabilisation de l'OM liante et l'énergie de déstabilisation de l'OM antiliante, par rapport à l'énergie des OA de départ, sont proportionnelles au recouvrement entre les deux OA. Lors de l'interaction entre deux OA d'énergies différentes, ces deux quantités sont proportionnelles au carré du recouvrement et inversement proportionnelle à la différence d'énergie entre les deux OA[3].
On peut en déduire deux grands principes pour la construction d'un diagramme d'OM[4] :
- 2 OA n'interagissent que si leur recouvrement est non nul
- 2 OA n'interagissent que si elles sont de même symétrie.
- 2 OA n'interagissent que si leurs énergies ne sont pas trop différentes (typiquement ΔE < 13 eV). Pour information, les énergies des OA de quelques éléments chimiques sont indiquées dans le Tableau 1.
| H | Li | B | C | N | O | F | |
|---|---|---|---|---|---|---|---|
| 1s | -13,606 | -67,424 | -209,40 | -308,18 | -425,28 | -562,42 | -717,92 |
| 2s | -5,3416 | -13,461 | -19,200 | -25,720 | -33,859 | -42,793 | |
| 2p | -8,4328 | -11,791 | -15,448 | -17,195 | -19,864 |
Cas du dihydrogène

La configuration électronique de l'atome d'hydrogène est : (1s)1. Chaque atome d'hydrogène apporte donc un électron, et on considère uniquement l'orbitale 1s de chacun de ces atomes lors de la construction du diagramme d'OM.
Lorsqu'on approche les deux atomes d'hydrogène, les deux orbitales atomiques peuvent interagir. En effet, leur recouvrement est non nul et elles ont la même énergie. Ces deux orbitales atomiques, de symétrie σ, vont donc donner naissance à deux orbitales moléculaires de type σ. La combinaison symétrique d'orbitales atomiques a un recouvrement de signe positif, cette OM est donc stabilisée par rapport aux OA de départ et est notée 1σg. La combinaison antisymétrique a un recouvrement de signe négatif, cette OM est donc déstabilisée par rapport aux OA et est notée 1σ*u. De plus, on peut noter que la déstabilisation du niveau antiliant est toujours supérieure à la stabilisation du niveau liant[3].
D'après les règles de remplissage, la configuration électronique du dihydrogène est alors : (1σg)2, et son indice de liaison vaut 1.
Cas du dihélium

La configuration électronique de l'atome d'hélium est : (1s)2. Les orbitales atomiques à considérer pour construire le diagramme d'OM sont les mêmes que dans le cas du dihydrogène. Le diagramme d'OM du dihélium est donc similaire à celui du dihydrogène, seul le remplissage électronique est modifié. Les deux OM, 1σg et 1σ*u, sont ici occupées par deux électrons et donc complètement remplies.
D'après le diagramme d'OM de cette molécule, l'indice de liaison du dihélium vaut 0, ce qui permet de fournir une raison, à partir de la théorie des OM, au fait que cette molécule n'existe pas dans la nature.
Éléments du bloc s et du bloc p
Les éléments du bloc s et du bloc p ont tous pour orbitales de valence des orbitales atomiques (ns) et (np). Tous les diagrammes d'OM de molécules diatomiques formées à partir de ces éléments sont donc similaires et peuvent être classés en deux grandes catégories selon la différence d'énergie entre les OA (ns) et (np) : les diagrammes simples et les diagrammes corrélés. En effet, les orbitales de cœur sont d'énergies beaucoup plus basses que les orbitales de valence et n'ont pas d'influence sur les propriétés chimiques des molécules. Elles sont d'ailleurs souvent omises dans les diagrammes d'OM[4].
Diagramme simple
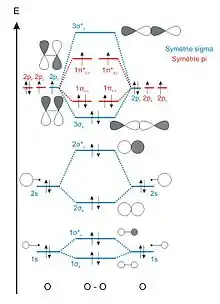
Les molécules possédant un diagramme d'OM simple sont celles constituées d'éléments dont la différence d'énergie entre les orbitales de valence (ns) et (np) est suffisamment importante pour pouvoir faire l'approximation que ces orbitales n'interagissent pas. La différence d'énergie entre les orbitales (ns) et (np) augmentant de gauche à droite dans une ligne de la classification périodique et diminuant de haut en bas dans une colonne, les trois seules molécules où cette approximation est justifiée sont le dioxygène (O2), le difluor (F2) et le dinéon (Ne2, n'existe pas dans la nature)[1].
Les diagrammes d'OM simples sont donc construits en faisant uniquement interagir des orbitales atomiques d'énergies identiques. Par exemple, lors de l'interaction de deux atomes d'oxygène, les électrons de valence sont: (2s)2(2p)4, on considérera les interactions : 2s-2s et 2p-2p.
- Les OA 2s ont la même symétrie que les OA 1s. L'interaction entre les deux OA 2s donne donc également deux OM de symétrie σ, une OM liante notée 2σg et une OM antiliante notée 2σ*u.
- Les orbitales atomiques 2p (2px, 2py et 2pz) possèdent un axe de révolution qui les identifie. Deux OA 2p orientées selon des axes différents sont orthogonales, leur recouvrement est strictement nul. On en déduit que seules les orbitales atomiques 2p orientées selon le même axe peuvent interagir. Il est conventionnel de définir l'axe z comme celui passant par les centres des deux atomes (axe internucléaire). Les OA 2pz sont donc de symétrie σ et les OA 2px et 2py de symétrie π. L'interaction entre les deux OA 2pz donne deux OM de symétrie σ, une OM liante notée 3σg et une OM antiliante notée 3σ*u. Les OA 2px interagiront pour former les OM 1πu,x et 1π*g,x et les OA 2py interagiront pour former les OM 1πu,y et 1π*g,y.
Le recouvrement entre OA de symétrie σ (recouvrement axial) est plus important que le recouvrement entre OA de symétrie π (recouvrement latéral, de part et d'autre de l'axe internucléaire). L'écart énergétique entre les orbitales 3σg et 3σ*u sera donc plus fort que celui entre les orbitales 1πu et 1π*g.
Dans l'exemple de la molécule de dioxygène, chaque atome d'oxygène apporte 8 électrons. Les 16 électrons du dioxygène sont placés dans les orbitales moléculaires en respectant les règles de remplissage énoncées précédemment : (1σg)2(1σ*u)2(2σg)2(2σ*u)2(3σg)2(1πu,x)2(1πu,y)2(1π*g,x)1(1π*g,y)1. Cette configuration électronique fait apparaitre des électrons célibataires dans les orbitales 1π*g,x et 1π*g,y et permet de justifier le paramagnétisme de la molécule de dioxygène observé expérimentalement.
Diagramme corrélé
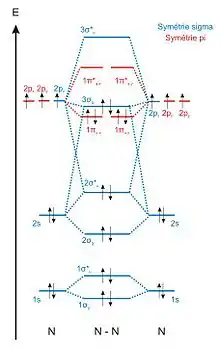
Les diagrammes corrélés sont utilisés pour décrire les niveaux d'énergie des OM des molécules diatomiques formées à partir de tous les autres éléments des blocs s et p[6].
Pour ces éléments, la différence d'énergie entre les orbitales de valence (ns) et (np) est plus faible, l'interaction entre ces orbitales n'est plus négligeable. Les orbitales atomiques (npx) et (npy) étant de symétrie π alors que l'orbitale atomique (ns) est de symétrie σ, le recouvrement entre ces orbitales sera nul et elles n'interagiront pas. Par rapport aux diagrammes simples, il faut donc considérer une seule interaction supplémentaire, celle entre les orbitales atomiques (ns) et (npz). Cette nouvelle interaction va modifier les énergies des quatre OM de symétrie σ, cependant les allures des orbitales restent identiques dans les deux diagrammes[4]. Le changement le plus notable qui apparaît dans les diagrammes corrélés correspond à la déstabilisation de l'OM σg formée par l’interaction des OA pz, qui entraîne une inversion des niveaux d'énergie des OM σg et πu.
Éléments du bloc d
Pour les molécules diatomiques formées à partir d'éléments chimiques du bloc d il faut rajouter aux interactions précédentes les interactions impliquant les orbitales atomiques d. L'OA dz2 est de symétrie σ, elle pourra interagir avec les orbitales σ formées à partir des OA s et pz. Les OA dxz et dyz sont de symétries π et pourront interagir avec les orbitales px et py. Enfin, les orbitales dxy et dx2-y2 interagiront pour former des orbitales de symétrie δ.
L'interaction entre orbitales d permet notamment d'expliquer la formation de liaisons d'ordre supérieur à 3, les liaisons quadruples, quintuples et sextuples.
Diagramme de molécules diatomiques hétéronucléaires

Une molécule diatomique composée de deux éléments chimiques différents ne possède plus de centre de symétrie. Par conséquent les indices "g" et "u" ne sont plus utilisés dans la notation de leurs orbitales moléculaires.
D'après la méthode de combinaison linéaire d'orbitales atomiques, l'expression mathématique d'une orbitale moléculaire d'une molécule diatomique composée de deux atomes A et B peut se mettre sous la forme :
où Ψ, φA et φB correspondent respectivement aux fonctions d'onde de la molécule diatomique, de l'atome A et de l'atome B. Les coefficients cA et cB correspondent aux contributions de φA et φB à Ψ.
Dans le cas d'une molécule diatomique homonucléaire, on a |cA| = |cB| pour toutes les OM. Les orbitales atomiques des deux atomes ont des énergies identiques et donc contribuent à parts égales aux différentes orbitales moléculaires. Ce cas limite correspond à une liaison purement covalente (l'autre cas limite, une liaison purement ionique correspondrait à avoir un coefficient nul et l'autre égal à 1).
Pour une molécule diatomique hétéronucléaire, les contributions des orbitales atomiques ne vont plus être identiques. L'orbitale atomique la plus basse en énergie aura une contribution plus importante à l'orbitale moléculaire liante et l'orbitale atomique la plus haute en énergie aura une contribution plus importante à l'orbitale moléculaire antiliante[1].
D'après le Tableau 1, la liaison chimique entre l'atome d'hydrogène et l'atome de fluor du fluorure d'hydrogène est due à l'interaction de l'orbitale atomique 1sH de l'hydrogène et 2pz,F du fluor pour donner une OM liante et une OM antiliante. L'OA 2pz,F a une énergie plus faible que l'OA 1sH. La contribution principale à l'orbitale liante vient donc de l'OA 2pz,F, ce qui signifie que la probabilité de présence des deux électrons de la liaison H-F est beaucoup plus grande autour de l'atome de fluor qu'autour de l'atome d'hydrogène. L'atome de fluor possède donc une charge partielle négative et l'hydrogène une charge partielle positive, d'où la valeur du moment dipolaire de la liaison H-F.
Les coefficients des OM liantes et antiliantes de la molécule HF sont données dans le tableau 2[1].
| cH | cF | |
|---|---|---|
| 2σl | 0,19 | 0,98 |
| 2σ* | 0,98 | -0,19 |
Diagramme de molécules polyatomiques

Les interactions entre orbitales atomiques se complexifient très rapidement lorsque le nombre d’atomes dans la molécule augmente. Néanmoins, plus la molécule possède de propriétés de symétrie et plus la construction du diagramme des niveaux d’énergie de ces OM sera simplifiée. La méthode de construction d’un diagramme d’OM, pour une molécule polyatomique, consiste à diviser la molécule en plusieurs fragments qui possèdent les mêmes éléments de symétrie que la molécule et dont les orbitales sont connues. On peut ainsi simplifier le problème à des interactions 2 à 2 d’orbitales de fragments. Cette méthode de construction est appelée méthode des orbitales de fragments, et fait appel à la théorie des groupes pour déterminer les propriétés de symétrie d’une molécule.
Liens Externes
- Animations des interactions entre orbitales atomiques donnant naissance aux orbitales moléculaires liantes et antiliantes dans le cas du dihydrogène et du diazote (site de l’Université de Sheffield) lien
Notes et références
- (en) Peter Atkins et Julio de Paula, Atkins' Physical Chemistry, Oxford, Oxford University Press, , 1149 p. (ISBN 0-19-879285-9), chap. 14 (« Molecular Structure »), p. 417-438
- (en) « bonding molecular orbital », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
- Yves Jean, Les orbitales moléculaires dans les complexes : cours et exercices corrigés, Editions Ecole Polytechnique, , 369 p. (ISBN 978-2-7302-1024-9, lire en ligne)
- Philippe Hiberty et Nguyên Trong Anh, Introduction à la chimie quantique, Palaiseau, Éditions École Polytechnique, , 311 p. (ISBN 978-2-7302-1485-8, lire en ligne), chap. 1 (« Introduction à la théorie des orbitales moléculaires »), p. 21-39
- D. B. Lawson et J. F. Harrison, « Some Observations on Molecular Orbital Theory », Journal of Chemical Education, vol. 82, no 8, , p. 1205 (DOI 10.1021/ed082p1205)
- Duward Felix Shriver et Peter William Atkins, Chimie inorganique, De Boeck Université, , 788 p. (ISBN 978-2-7445-0110-4, lire en ligne), chap. 12 (« Les halogènes et les gaz nobles »), p. 408-410
- Portail de la physique
- Portail de la chimie