Liaison ionique
Une liaison ionique (ou liaison électrovalente) est un type de liaison chimique qui peut être formé par une paire d'atomes possédant une grande différence d'électronégativité (par convention, supérieure à 1,7) typiquement entre un non-métal et un métal. Le métal donne un ou plusieurs électrons pour former un ion chargé positivement (cation). Le non-métal capte ces électrons pour former un ion chargé négativement (anion). Les deux ions formés possèdent fréquemment une configuration électronique de gaz rare (ils respectent la règle de l'octet ou la règle du duet). La liaison résulte de l'attraction entre le cation dérivant du métal et l'anion dérivant du non-métal.
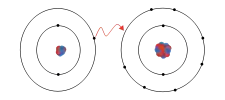
Par exemple, le sel de cuisine est du chlorure de sodium (NaCl). Quand le sodium (Na) réagit avec le chlore (gaz de dichlore, Cl2), les atomes de sodium perdent un électron et les atomes de chlore gagnent un électron (la molécule de dichlore est d'abord dissociée). Les ions se combinent dans un rapport 1 : 1 pour former le sel de cuisine.
Le fait d'enlever des électrons à des atomes est endothermique (les potentiels d'ionisation sont supérieurs à 0) : les cations produits sont toujours de plus haute énergie que l'atome de départ. L'addition d'électrons aux atomes pour former des anions est au contraire un processus exothermique mais la stabilisation peut être nulle, faible ou très importante (voir l'article affinité électronique). L'attraction électrostatique entre des ions de charge opposée, est, elle, toujours favorable. Le bilan de la formation d'une liaison ionique est donc favorable pour la combinaison d'un atome perdant facilement un ou des électron(s) (potentiel d'ionisation faible) avec un autre atome possédant une affinité électronique élevée. Autrement dit, la combinaison la plus favorable est celle d'un non-métal d'électronégativité élevée avec un métal d'électronégativité faible. Par extension, des ions polyatomiques (comme l'ammonium NH4+ ou le carbonate CO32−) peuvent se combiner avec des ions de charge opposée pour former des solides stables.
Contrairement à la liaison covalente, la liaison ionique n'est pas dirigée ni localisée. Dans un cristal ionique, les anions et les cations s'attirent mutuellement dans toutes les directions de l'espace. Il n'y a pas de paires d'atomes liés. Même si le chlorure de sodium s'écrit NaCl, cela ne signifie pas que des molécules de NaCl séparées les unes des autres existent.
La liaison ionique pure n'existe pas. Tous les composés présentent un degré de liaison covalente. Plus la différence d'électronégativité entre deux atomes est importante, plus la liaison est ionique. Les composés ioniques conduisent l'électricité à l'état fondu ou en solution. Ils possèdent généralement un point de fusion élevé et sont souvent solubles dans l'eau.
Liste d'ions courants
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
- Portail des sciences des matériaux