Dichlore
Le dichlore (Cl2) est un gaz jaune-vert dans les conditions normales de température et de pression (chloros signifie « vert » en grec). Il est 2,5 fois plus dense que l'air. Il a une odeur suffocante très désagréable et est extrêmement toxique car il se recombine avec l'humidité des muqueuses et des poumons pour former des acides qui attaquent les tissus.
| Dichlore | ||
| ||
 | ||
| Dichlore dans une ampoule. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | dichlore | |
| No CAS | ||
| No ECHA | 100.029.053 | |
| No CE | 231-959-5 | |
| No E | E925 | |
| Apparence | gaz jaune-verdâtre, d'odeur âcre[1] | |
| Propriétés chimiques | ||
| Formule | Cl2 [Isomères] |
|
| Masse molaire[2] | 70,906 ± 0,004 g/mol Cl 100 %, |
|
| Propriétés physiques | ||
| T° fusion | −101 °C[1] | |
| T° ébullition | −34,6 °C[1] | |
| Solubilité | 14,6 g·l-1 dans l'eau à 0 °C, 7,3 g·l-1 à 20 °C, 5,7 g·l-1 à 30 °C |
|
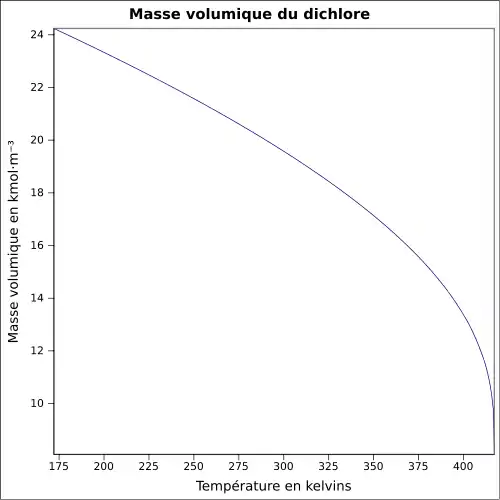
| Masse volumique | 2,48 (densité par rapport à l'air) à 20 °C, 6,864 atm : 1,4085 g·cm-3 (liq.) à −35 °C, 0,9949 atm : 1,5649 g·cm-3 (liq.) |
|
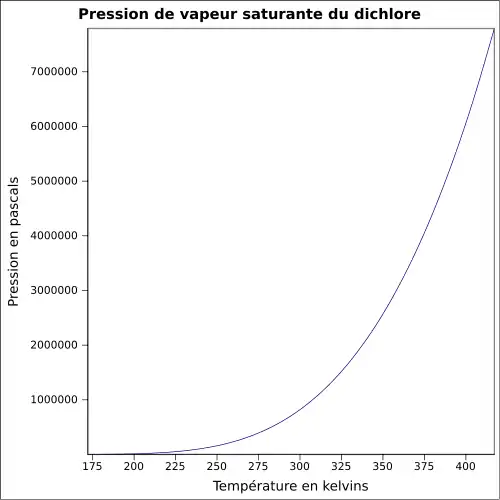
| Pression de vapeur saturante | 6,776 bar à 20 °C 8,8 bar à 30 °C 14,3 bar à 50 °C |
|
| Point critique | 143,81 °C 79,914 bar 0,57688 kg·l-1 |
|
| Point triple | −100,98 °C 0,01387 bar |
|
| Vitesse du son | 206 m·s-1 (0 °C, 1 atm)[4] | |
| Thermochimie | ||
| ΔvapH° | 20,41 kJ·mol-1 (1 atm, −34,04 °C) ; 17,65 kJ·mol-1 (1 atm, 25 °C)[5] |
|
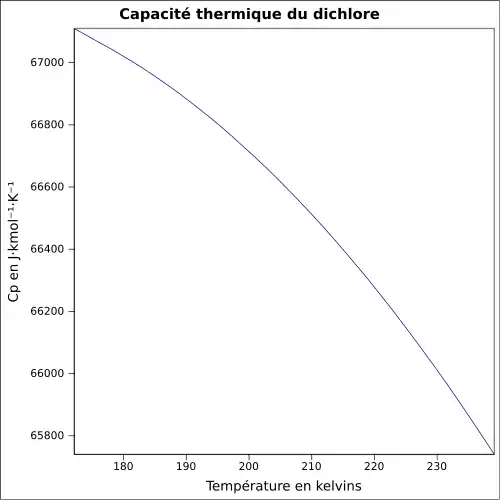
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 11,480 ± 0,005 eV (gaz)[6] | |
| Cristallographie | ||
| Symbole de Pearson | [7] | |
| Classe cristalline ou groupe d’espace | Cmca (no 64)[7] | |
| Strukturbericht | A14[7] | |
| Structure type | I2[7] | |
| Précautions | ||
| SGH[8] | ||
    Danger |
||
| SIMDUT[9] | ||
   A, D1A, E, |
||
| NFPA 704 | ||
| Transport | ||
| Inhalation | odeur suffocante | |
| Écotoxicologie | ||
| CL50 | 1 heure : rat 293 ppm souris 137 ppm |
|
| Seuil de l’odorat | bas : 0,02 ppm haut : 3,4 ppm[10] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Le dichlore a été découvert par Carl Wilhelm Scheele en 1774. Il a été utilisé lors de la Première Guerre mondiale en tant que gaz de combat, la bertholite.
Le dichlore est soluble dans l'eau formant l'eau de chlore, mais il n'est pas soluble dans l'eau salée.
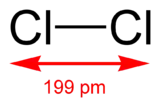
La molécule de dichlore est formée de deux atomes de chlore.
Production
Le dichlore peut être produit facilement en électrolysant une solution de chlorure de sodium (procédé chlore-alcali) :
- 2Na+ + 2Cl– + 2H2O → 2NaOH + Cl2 + H2
Scheele le synthétisa en faisant réagir du dioxyde de manganèse (MnO2) avec de l'acide chlorhydrique (HCl).
On peut également en fabriquer de petites quantités grâce à la réaction de l'acide chlorhydrique sur le permanganate de potassium.
De plus, quand on verse un acide dans de l'eau de Javel, on observe une libération de dichlore (mais en présence d'urée, présent dans l'urine, elle dégage de la trichloramine (NCl3) ; gaz très irritant)[11]. Le degré chlorométrique d'une solution de Javel est le volume de dichlore libéré par un litre de cette solution (acide en excès).
- Cl– + ClO– + 2H+ → Cl2 + H2O
Utilisation
Le dichlore est utilisé comme matière première pour produire de l'acide chlorhydrique par réaction entre le dichlore et le dihydrogène.
- Cl2 + H2 → 2HCl
Il est aussi utilisé pour produire du polychlorure de vinyle (PVC).
Il sert dans la fabrication des produits avec une liaison carbone-chlore comme le fluide frigorigène R12 dichlorodifluorométhane.[réf. nécessaire]
Il sert aussi à désinfecter l'eau potable en remplacement de l'eau de Javel.
Il a été utilisé comme gaz de combat (car irritant pour les voies respiratoires supérieures et toxique[12]) pendant la Première Guerre mondiale où il a fait cinq mille morts et quinze mille rescapés, et il a laissé aux victimes des séquelles à vie[13] dans les cas les plus graves.
Propriétés
Le dichlore a la propriété de décolorer la solution d'indigo[14] et plusieurs autres substances organiques. La couleur de plusieurs colorants organiques vient des différences entre les nombreux niveaux d’énergie de leurs liaisons conjuguées. Or le dichlore oxyde les doubles liaisons carbone-carbone qui constituent les systèmes de liaisons conjuguées.
Références
- CHLORE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « The Molecular Iodine (I2) Crystal Structure (A14) », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Chlore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Chlorine », sur hazmap.nlm.nih.gov (consulté le )
- « Dossier : L’Eau de Javel - Solution aqueuse d’hypochlorite de sodium » [PDF], Chambre syndicale nationale de l’eau de Javel, mai 2010, p. 8, § 7 : Sécurité pour l'homme, sur eaudejavel.fr
- « Expositions individuelles et collectives aux vapeurs de chlore », Centre Antipoisons belge
- « Les gaz : 22 avril 1915 à Ypres (Belgique) », sur La Grande Guerre
- Chimie, terminale S obligatoire, programme 2002, Nathan, coll. « Sirius », , 351 p. (ISBN 978-2-09-172496-6), p. 248