Orbitale antiliante
Une orbitale antiliante désigne un type de liaison chimique qui s'oppose à la stabilité de la molécule. Cela survient lorsque les phases d'électron et des orbitales atomiques à l'origine d'une orbitale moléculaire sont de signe opposé, c'est-à-dire que ces orbitales atomiques sont en opposition de phase : si des électrons occupent de telles orbitales antiliantes, ils se repoussent et tendent à dissocier la molécule.
L'effet d'une orbitale antiliante est plus sensible que celui d'une orbitale liante, la différence s'expliquant par la répulsion entre les noyaux atomiques.
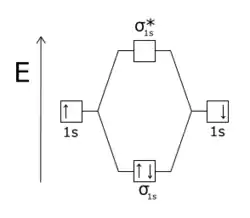 La molécule H2 est stable car l'orbitale antiliante σ* est vide : seule l'orbitale liante σ est occupée, donc une liaison covalente peut s'établir. |
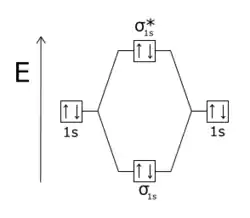 La molécule He2 n'est pas stable car les quatre électrons se répartissent sur une orbitale liante σ et une orbitale antiliante σ*, cette dernière neutralisant la liaison σ |
Bibliographie
- Atkins, P.W. Atkins Physical Chemistry, 2002 7e édition, Oxford. (ISBN 0-19-879285-9)
- Orchin, M. Jaffe, H.H. The Importance of Antibonding Orbitals, 1967 Houghton Mifflin, ISBN B0006BPT5O
- Le prix Nobel de chimie de 1981
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.