Dystrophie facio-scapulo-humérale
La dystrophie facio-scapulo-humérale (FSH) est une maladie neuromusculaire génétique, affectant principalement le visage (facio), les épaules (scapulo) et les bras (humérale). C'est une maladie rare. Elle fut décrite en 1884 par Louis Landouzy et Jules Dejerine.
| Spécialité | Neurologie |
|---|
| CIM-10 | G71.0 |
|---|---|
| CIM-9 | 359.1 |
| OMIM | 158900 158901 |
| DiseasesDB | 7247 |
| MedlinePlus | 000707 |
| eMedicine | 1176126 |
| eMedicine | neuro/133 |
| MeSH | D020391 |
| GeneReviews |
![]()
Autres dénominations
- myopathie facio-scapulo-humérale
- myopathie ou dystrophie FSH
- FSHD en anglais
- myopathie de Landouzy-Dejerine
Clinique
Prévalence
La prévalence varie de 1 à 9 / 1000 000 suivant les sources[1]. Une étude récente la chiffre à 12 / 100 000, ce qui en ferait la plus fréquente des maladies neuromusculaires[2]. Cela donnerait pour la France plus de 7000 personnes atteintes. Cette importance de la prévalence reste toutefois toute relative et reste en deçà du seuil de prévalence des maladies rares (moins de 1 / 2 000, soit 50 / 100 000[3]).
Symptômes (phénotype)
Les symptômes sont principalement une atrophie et une faiblesse musculaires. L'atteinte est asymétrique, ce qui est caractéristique de la FSH par rapport à d'autres affections neuromusculaires. L'âge d'apparition des symptômes se situe souvent à l'adolescence. Cependant, la maladie peut se déclarer à tout âge, de la première enfance jusqu'à 60 ans passés. Les symptômes peuvent être très légers, voire passer inaperçus, ou plus handicapants. Les symptômes évoluent de façon généralement lente, éventuellement sous forme de poussées et paliers. L'évolution peut parfois être liée à des variations hormonales (adolescence, grossesse, ménopause)[4]. Ils sont associés à un état inflammatoire et à un stress oxydant, mais également à une grande fatigue et des douleurs. Les signes de la maladie sont très variables d'une personne à l'autre, y compris entre des personnes d'une même famille. La maladie n'atteint pas les fonctions cognitives et ne diminue pas l'espérance de vie.
Les muscles atteints sont (l'apparition des atteintes se fait généralement du haut du corps vers le bas) :
- les muscles de la face (muscles orbiculaires des paupières et de la bouche), ce qui provoque un visage dissymétrique, figé (amimie), un sourire horizontal, une occlusion incomplète des paupières durant le sommeil, ce qui peut irriter la cornée, plus rarement un ectropion ou des problèmes de déglutition[5] ou de mastication à cause de la fermeture incomplète des lèvres.
- les muscles de la ceinture scapulaire (muscles fixateurs de l'omoplate) et des bras, provoquant parfois un décollement des omoplates et une difficulté à lever les bras.
- les muscles abdominaux et la ceinture pelvienne (hyperlordose et protrusion abdominale).
- les muscles des membres inférieurs, et en particulier le releveur du pied, ce qui provoque un steppage. Chez 15 à 20 % des patients, la difficulté à la marche conduit à l'utilisation d'un fauteuil roulant ou d'une aide technique à la marche[6].
D'autres atteintes, certaines non musculaires, sont plus rares :
- des problèmes respiratoires dus à l'hyperlordose, à une faiblesse des muscles de la cage thoracique, voire à une faiblesse du diaphragme. Les problèmes respiratoires apparaissent chez 5 à 10 % des patients[7],
- une surdité partielle dans les sons aigus[8],
- un défaut de vascularisation de la rétine[9],
- des problèmes d'arythmie cardiaque[10] rares, mais justifiant une surveillance cardiaque régulière systématique.
Forme infantile
Dans certains cas, très rares (4 %[11] à 10 %[12] des patients FSH suivant les sources), les symptômes apparaissent dès l'enfance (5 ou 10 ans) et la FSH est alors plus sévère et son évolution est plus rapide[11]. Les cas sont souvent des cas de novo[13], c'est-à-dire sans antécédent familial, et ils correspondent à de fortes délétion D4Z4 (1 à 3 répétitions, voir le paragraphe Génétique). Les problèmes d'audition ou de vascularisation de la rétine sont plus fréquents.
Diagnostic
Le diagnostic est basé sur un examen clinique, confirmé par une analyse génétique. L'utilisation d'un électromyogramme ou d'une biopsie musculaire est rarement nécessaire.
Transmission
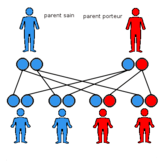
La FSH est une maladie génétique, donc à transmission familiale. La transmission est autosomique dominante[6], c'est-à-dire que si un des 2 parents est atteint, il y a 1 risque sur 2 pour que l'enfant soit atteint. Il existe cependant des cas sporadiques, ou de novo (sans antécédent familial) dans 10 à 30 % des cas[14].
Des techniques de diagnostic prénatal ou de diagnostic préimplantatoire existent, mais sont peu fiables ou difficiles d'accès. Pour les patients désirant concevoir un enfant, la consultation d'un médecin généticien et d'un psychologue est recommandée.
Prise en charge clinique
Plusieurs articles détaillent la prise en charge clinique des patients FSH[15],[16]. En France, ce sont les centres de référence neuromusculaires[17] qui prennent en charge cette pathologie.
Actuellement, en l'absence de traitement disponible (voir le chapitre Recherche) seules les thérapies physiques (type kinésithérapie, physiothérapie, kinésiologie au Canada...) sont préconisées comme traitement symptomatique. Plusieurs études ont montré le bénéfice, pour la forme physique et la qualité de vie, de la pratique régulière d'exercice physique[18].
Divers appareillages orthopédiques ou aides techniques peuvent améliorer la vie quotidienne : releveur de pied, chaussures orthopédique, utilisation de canne, fauteuil roulant ou scooteur électrique, etc. Pour les patients désirant réduire le décollement des omoplates ou faciliter la levée des bras, on peut pratiquer une fixation chirurgicale des omoplates[19].
L'utilisation de larmes artificielles ou d'un gel ophtalmique est conseillée en cas d’irritations oculaires répétées dues à la fermeture incomplète des paupières.
Génétique
Historique
Dès 1990, le défaut responsable de la FSH a été localisé par C.Wijmenga (université de Leyde, Pays-Bas) sur le chromosome 4[20] puis dans la zone 4q35. Mais la zone en question ne contenait apparemment pas de gène. Dans les années 2000, plusieurs hypothèses de dérépression transcriptionnelle des gènes voisins FRG1, ANT1 etc. ont été évoquées par Rosella Tupler[21] ou Sylvere van der Maarel. D'autres hypothèses encore ont été évoquées (FAT1[22]).
Puis Alexandra Belayew (université de Mons, Belgique) a montré, dès 1999, que la zone 4q35 contenait bien un gène : DUX4 (en)[23] (Double homeobox, 4) et que l'expression de ce gène, normalement inactif, entraîne une cascade de dérèglements génétiques. La communauté scientifique est maintenant à peu près unanimement d'accord sur le fait que DUX4 est bien le principal acteur dans la FSH.
Mécanisme génétique
Il y a deux formes différentes d'atteinte génétique :
- FSHD1 : pour 95 % des patients, la maladie est due à une réduction (délétion) de la zone D4Z4 au bout du chromosome 4 sur le bras long en 4q35. Chez les personnes non atteintes, il y a plus de 11 répétitions D4Z4 dans cette zone. Chez les patients FSH, il y a moins de 10 répétitions ; et plus le nombre de répétitions est faible, plus les symptômes sont sévères[6]. La technique de peignage moléculaire permet de faire le diagnostic de cette anomalie de façon fiable[24].

- FSHD2 : pour 5 % des patients, la maladie est due à une mutation du gène SMCHD1 sur le chromosome 18[25].
- Un faible pourcentage de patients présentant les symptômes de la FSH sont négatifs aux diagnostics génétiques FSHD1 et FSHD2. Ils pourraient présenter une anomalie sur le gène DNMT3B[26].
Les deux formes FSHD1 et FSHD2 n'ont pas la même cause génétique, mais elles ont le même mécanisme d'action. Elles provoquent toutes les deux des anomalies épigénétiques : une hypométhylation de l'ADN dans la zone D4Z4 et une relaxation de la chromatine qui permet l'expression (la dérepression) du gène DUX4. La protéine DUX4 produite, qui est un facteur de transcription, génère une cascade de dérégulations de plusieurs gènes (dont une sous-expression de FAT1), qui conduit à l'atrophie musculaire.

Ce mécanisme génétique est atypique car le plus souvent, une maladie génétique est provoquée par un défaut sur un gène qui cause l'absence ou l'anomalie de la protéine correspondante. Ici, le défaut génétique provoque l'expression d'un gène qui devrait être éteint, et la production d'une protéine qui devrait être absente.
Recherche
Tous les ans, l'AFM-Téléthon publie un livret Avancées de la Recherche dans la myopathie FSH[27].
Des bases de données de patients FSH, destinées à étudier l'histoire naturelle de la maladie et à faciliter le recrutement pour les essais cliniques, ont été mises en place dans plusieurs pays. En France, l'Observatoire national français des patients atteints de DMFSH a démarré en 2013[28].
De nombreuses études fondamentales sont menées pour élucider le mécanisme de la myopathie FSH : rôle de DUX4, phénomènes épigénétiques, cause de la diversité des phénotypes et de l'asymétrie de l'atrophie musculaire, etc.
Thérapie génique
Les chercheurs travaillent sur le moyen d'empêcher le gène DUX4 de s'exprimer :
- silençage par ARN interférant du gène DUX4[29]
- utilisation de oligonucléotides antisens pour inactiver l'ARN messager de DUX4[30]
- utilisation de CrispR-Cas9[31]
- etc.
La recherche est freinée du fait qu'il n'existe pas de modèle animal vraiment valide. Les études en cours se font sur des cultures de cellules in vitro.
Traitements symptomatiques et pharmacologiques
Divers essais cliniques de supplémentation ou de traitements pharmacologiques (salbutamol/albutérol[32], créatine, prednisone, diltiazem, acide folique et méthionine) ont été menés sans vraiment de résultat probant.
Un essai de thérapie cellulaire (autogreffe de myoblastes) n'a pas donné de résultat[33].
Des études ont montré que la FSH induit un stress oxydant dans les cellules musculaires et qu'une supplémentation en antioxydants pourrait avoir un effet bénéfique. Ces résultats sont à confirmer sur une plus grande cohorte de malades[34].
D'autres études se sont intéressées à la désinhibition de la myostatine ou à la TGF-β[35] qui régule la croissance musculaire.
D'autres encore pensent pouvoir réduire les effets de la maladie en agissant sur l'aspect inflammatoire induit par la FSH[36].
Aucune de ces études (dont certaines sont encore en cours) n'a donné de résultat probant.
Culture populaire
Dans la série uchronique américaine The Man in the High Castle (épisode 8), Thomas Smith est porteur de la myopathie de Landouzy-Dejerine. Conformément au programme eugéniste du Troisième Reich, il est menacé d'euthanasie au grand dam de son père, haut dignitaire nazi.
Notes et références
- « Dystrophie facio-scapulo-humérale (ORPHA269) », sur Orphanet
- Deenen & al., « Population-based incidence and prevalence of facioscapulohumeral dystrophy », Neurology, , p. 83(12):1056-9 (lire en ligne)
- « Définition maladie rare », sur Alliance maladies rares
- (en) « Pregnancy and birth outcomes in women with facioscapulohumeral muscular dystrophy » Neurology novembre 2006;67(10):1887-9.
- « Dysphagia in facioscapulohumeral muscular dystrophy » Neurology juin 2006 27;66(12):1926-8
- AFM-Téléthon, Zoom sur la myopathie FSH, (lire en ligne)
- Scully & al., « Restrictive lung involvement in facioscapulohumeral muscular dystrophy », Muscle & nerve, , p. 50(5):739-43 (lire en ligne)
- (en) « Cochlear function in facioscapulohumeral muscular dystrophy » Otol Neurotol. 2007 Jan;28(1):7-10
- T.N. Brignol, « Revue bibliographique sur l’intérêt de l’examen de la rétine dans deux maladie neuromusculaires génétiques (FSHD et DM1). Applications cliniques potentielles », Journal Français d’Ophtalmologie, , p. 38(10):e259-60.
- (en) « Facioscapulohumeral muscular dystrophy and occurrence of heart arrhythmia » Eur Neurol. 2006;56(1):1-5.
- Klinge & al., « Severe phenotype in infantile facioscapulohumeral muscular dystrophy », Neuromuscular disorders, , p. 16(9-10):553-8 (lire en ligne)
- Goselink & al., « Facioscapulohumeral dystrophy in children », BMC Neurology, , p. 16:138 (lire en ligne)
- Nicolik & al., « Clinical expression of facioscapulohumeral muscular dystrophy in carriers of 1-3 D4Z4 reduced alleles », BMJ open, (lire en ligne)
- Lemmers / Van der Maarel, « Facioscapulohumeral Muscular Dystrophy », GeneReviews, (lire en ligne)
- S.Attarian, « Recommendations for the management of FSH muscular dystrophy in 2011 », Revue neurologique,
- (en) R.Tawil, « Evidence-based guideline summary: Evaluation, diagnosis, and management of facioscapulohumeral muscular dystrophy », Neurology,
- « Présentation de la filière Filnemus », sur Filnemus
- L.Féasson, « Safety and efficacy of a 6-month home-based exercise program in patients with facioscapulohumeral muscular dystrophy », Medicine Baltimore, (lire en ligne)
- (en) AD.Cooney, « The outcome of scapulothoracic arthrodesis using cerclage wires, plates, and allograft for facioscapulohumeral dystrophy », Journal of Shoulder and Elbow Surgery, (lire en ligne)
- C.Wijmenga, « Location of FSH muscular dystrophy gene on chromosome 4 », Lancet, (lire en ligne)
- R.Tupler, « Molecular basis of facioscapulohumeral muscular dystrophy », Cellular and Molecular Life Sciences, (lire en ligne)
- (en) F.Helmbacher, « Deregulation of the protocadherin gene FAT1 alters muscle shapes: implications for the pathogenesis of FSH dystrophy », PloS Genetics, (lire en ligne)
- (en) A.Belayew, « Nucleotide sequence of the partially deleted D4Z4 locus in a patient with FSHD identifies a putative gene within each 3.3 kb element », Gene, (lire en ligne)
- J.Vasale, « Molecular combing compared to Southern blot for measuring D4Z4 contractions in FSHD », Neuromuscular disordres, (lire en ligne)
- (en) Lemmers & al., « Digenic inheritance of an SMCHD1 mutation and an FSHD-permissive D4Z4 allele causes facioscapulohumeral muscular dystrophy type 2 », Nature Genetics, (lire en ligne)
- (en) S. van der Maarel, « Mutations in DNMT3B Modify Epigenetic Repression of the D4Z4 Repeat and the Penetrance of FSH Dystrophy », American journal of human genetics, (lire en ligne)
- AFM-Téléthon, Savoir et Comprendre - Avancées de la Recherche dans la myopathie FSH (lire en ligne)
- « Observatoire National Français des patients atteints de DMFSH »
- (en), Belayew « The FSHD Atrophic Myotube Phenotype Is Caused by DUX4 Expression »
- (en) J.Dumonceaux, « Antisense targeting of 3' end elements involved in DUX4 mRNA processing is an efficient therapeutic strategy for FSH dystrophy: a new gene-silencing approach. », Human molecular genetics, (lire en ligne)
- (en) PL.Jones, « CRISPR/dCas9-mediated Transcriptional Inhibition Ameliorates the Epigenetic Dysregulation at D4Z4 and Represses DUX4-fl in FSH Muscular Dystrophy », Molecular therapy, (lire en ligne)
- (en) R.Tawil, « Randomized, double-blind, placebo-controlled trial of albuterol in FSH dystrophy », Neurology, (lire en ligne)
- C.Desnuelles, « The possible place of autologus cell therapy in FSH muscular dystrophy », Bulletin de l'Académie nationale de médecine, (lire en ligne)
- (en) D.Laoudj-Chenivesse, « Effects of vitamin C, vitamin E, zinc gluconate, and selenomethionine supplementation on muscle function and oxidative stress biomarkers in patients with FSH dystrophy: a double-blind randomized controlled clinical trial », Free radical biology & medicine, (lire en ligne)
- « essai clinique annoncé pour 2016 pour l'ACE-083 », sur Blog du Groupe d'Intérêt FSH de l'AFM,
- (en) « The Safety and Biological Activity of ATYR1940 in Patients With Limb Girdle or FSHD », sur ClinicalTrials
Liens externes
- AFM, Association française contre les myopathies / fiche maladie myopathie FSH
- AFM blog du groupe de malades FSH
- Site européen Orphanet fiche maladie myopathie FSH
- Association de patients Amis FSH
- Association de patients américaine FSH Society
- Portail de la médecine