Rétine
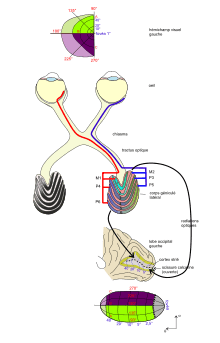
La rétine est l'organe sensible de la vision. D'origine diencéphalique, c'est une mince membrane pluri-stratifiée d'environ 0,5 mm d'épaisseur couvrant environ 75 % de la face interne du globe oculaire et intercalée entre l'humeur vitrée et l'épithélium pigmentaire sous-choroïdal. Sa partie sensible à la lumière se compose de photorécepteurs: environ 5 millions de cônes (vision diurne et colorée) et ~120 millions de bâtonnets (vision crépusculaire et nocturne en noir et blanc), qui captent les signaux lumineux (photons) et les transforment en signaux électro-chimiques. Elle se compose aussi de neurones qui à leur tour intègrent ces signaux chimiques (neurotransmetteurs) en signaux électriques à l'origine de potentiels d'action mais aussi de cellules gliales. Ces potentiels d'action générés par les cellules ganglionnaires seront acheminés par les nerfs optiques vers l'encéphale par les corps géniculés latéraux (relais thalamiques qui se projettent par les radiations optiques vers la scissure calcarine du lobe occipital, hypothalamus, colliculi supérieurs, noyaux du tractus optique accessoire). La rétine est vascularisée par l'artère et la veine dites centrales de la rétine.
Quelques zones particulières de la rétine
- la macula : région centrale de la rétine, située proche de l'axe optique.
- la fovéa : région centrale de la macula où se concentrent les cônes. Cette région forme une petite dépression au centre de la rétine, où l’acuité visuelle est à son maximum. Les champs récepteurs des cônes se trouvent au centre du champ visuel.
- la papille : région d'émergence du nerf optique et dépourvue de photorécepteurs.
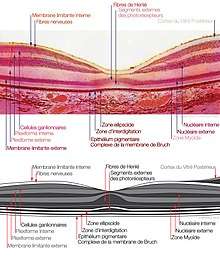 Histologie de la macula et nomenclature OCT
Histologie de la macula et nomenclature OCT
Morphologie de la rétine : de la lumière à l'impulsion
La physiologie de la rétine montre une grande diversité dans le règne animal qui s'explique par les différentes fonctions que cet organe doit accomplir. Mais on sait aussi depuis Cajal[1] qu'elle suit une organisation similaire[2]. Nous la décrirons ici pour les primates (humains et non-humains).
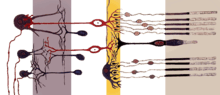
La rétine est constituée par un empilement de couches, dans le sens radial (de la surface de la rétine jusqu’au fond de l’œil) :
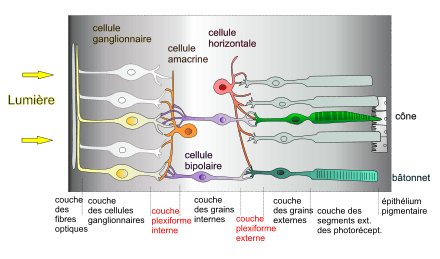
- la couche monostratifiée des cellules photoréceptrices glutaminergiques (les cônes au sein de la fovéa, ou les bâtonnets plus en périphérie), apposée sur l’épithélium pigmentaire sous la choroïde,
- la couche plexiforme externe formée des cellules horizontales de type H1 et H2,
- la couche nucléaire interne (ou couche des grains internes) formée des cellules bipolaires GABAergiques et glycinergiques, de plusieurs types :
- les cellules bipolaires périphériques, spécifiques des bâtonnets.
- les cellules bipolaires centrales, spécifiques des cônes, lesquelles comptent au moins les sous-classes suivantes : géantes, diffuses, midget et S-cône,
- la couche plexiforme interne formée des cellules amacrines,
- la couche des cellules ganglionnaires (plus d'une vingtaine de types) dont les axones (~1,25 million) se connectent de façon excentrée au niveau de la papille optique (comprenant moins de couches et dépourvue de cellules photosensibles) pour donner le nerf optique.
La rétine présente d’autre part, schématiquement, une double organisation architecturale : radiaire et tangentielle.
- Les photorécepteurs, les cellules bipolaires (mais aussi certaines cellules amacrines de la couche plexiforme interne) et les cellules ganglionnaires définissent un réseau radiaire,
- tandis que les cellules des couches plexiformes interne et externe forment des réseaux tangentiels.
Réseaux radiaires
En fonction de l'intensité lumineuse, trois réseaux partiellement différents seront recrutés pour assurer la transduction des photons de lumière au niveau des photorécepteurs, et l’émission de potentiels d’action par les cellules ganglionnaires.
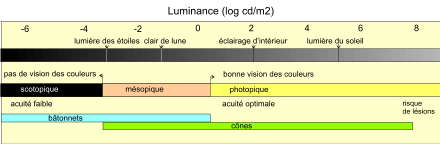
- Pour la vision diurne (ou photopique), essentiellement dans la fovéa centrale :
- Sont recrutés et connectés successivement par des synapses chimiques :
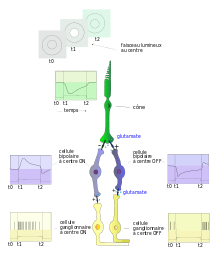
- cône → cellule bipolaire ON ou OFF → cellules ganglionnaires ON et OFF.
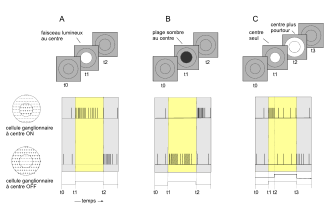
- À la présentation d'un faisceau lumineux au centre du champ récepteur (fig. 5, entre les temps t1 et 2), le cône s'hyperpolarise et libère du glutamate en moins grande quantité. Il en résulte une activation graduée de la cellule bipolaire à centre ON et une inactivation graduée de la cellule bipolaire à centre OFF (voir ci-dessous les définitions section « Champs récepteurs des cellules ganglionnaires »). Ces réponses opposées des bipolaires s'expliquent par le fait qu'elles expriment à leur surface des récepteurs différents du glutamate (GLU) : les bipolaires ON ont des récepteurs métabotropiques du GLU couplés à une protéine G (mGLUR6), les cellules bipolaires OFF expriment des récepteurs ionotropiques (AMPA, kaïnate). Les récepteurs mGLUR6 ferment les canaux Na+ et donc hyperpolarisent la cellule. Mais ici, la réduction du glutamate provoque à l'opposé une activation graduée.
- Les cellules bipolaires comme les cônes ont des réponses électriques graduées. Dans la rétine, seules les cellules ganglionnaires répondent par des potentiels d'action.
- Pour la vision nocturne (ou scotopique), essentiellement dans la zone périphérique[4] :
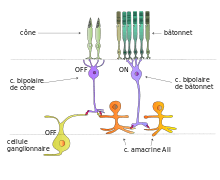
- Sont recrutés et connectés successivement par des synapses chimiques ou électriques : les bâtonnets, les cellules bipolaires ON, les cellules amacrines AII et les cellules bipolaires spécifiques des cônes puis les cellules ganglionnaires, ou directement les cellules ganglionnaires OFF spécifiques des cônes.
- En d’autres termes, les cônes centraux sont au repos, et les cellules bipolaires et ganglionnaires des cônes sont stimulées par les bâtonnets périphériques via les cellules amacrines.
- bâtonnet → (1) c. bipolaire de bâtonnets ON → (2) c. amacrine AII → (3) axone de c. bipolaire de cônes → (4) c. ganglionnaire ON/OFF
- La voie des bâtonnets comporte 4 connexions synaptiques avec 2 points de forte convergence : de 20 à 50 bâtonnets convergent sur chaque cellule bipolaire de bâtonnets (CBB) et de 20 à 25 CBB convergent vers chaque cellule amacrine AII. Au total, les signaux provenant d'au moins un millier de bâtonnets convergent sur une seule cellule ganglionnaire[5]. De surcroît, les bâtonnets peuvent répondre à la stimulation d'un seul photon alors qu'il en faut au moins une centaine pour obtenir une réponse d'un cône. Cette organisation accroît considérablement l'amplitude du signal et assure une bonne sensibilité en faible lumière.
- À la lumière, les bâtonnets tout comme les cônes, se repolarisent proportionnellement à l'intensité lumineuse. La transmission vers les cellules bipolaires se fait ensuite graduellement, sans seuil. Ce n'est qu'au sortir de la rétine, que les cellules ganglionnaires génèrent des potentiels d'action.
- Pour la vision crépusculaire (ou mésopique) :
- Ce type de vision met en jeu les bâtonnets périphériques qui, grâce à des jonctions communicantes horizontales, activent les cônes centraux, lesquels resteraient sinon silencieux en raison de la faible intensité lumineuse. Il en résulte un maintien de l’activité du réseau impliqué dans la vision diurne.
- À proprement parler, ce type de réseau est plutôt tangentiel et non radiaire, et est en partie responsable de la perte de résolution angulaire (mais aussi de la perte de distinction des différences de couleurs) lors de l’observation des zones sombres de l’image, même en vision diurne.
| Système Rétino-tectal (relais : colliculus supérieur sans projection sur le cortex) |
Système Géniculo-strié (relais : corps genouillé latéral avec projection sur le cortex visuel primaire (cortex strié et V1)) |
| Rétine Périphérique | Rétine Centrale |
|---|---|
| Présence de bâtonnets | Présence de cônes |
| Relations convergentes | Relations unitaires |
| Cellules ganglionnaires de type M (Magnocellulaire : de grande taille, grand champ récepteur, adaptation phasique) | Cellules ganglionnaires de type P (Parvocellulaire : de petite taille, petit champ récepteur, adaptation tonique). |
| Forte sensibilité | Faible sensibilité |
| Faible pouvoir de discrimination | Forte acuité |
| Traite les informations relatives au mouvement | Traite les informations relatives à la forme et couleur |
| Rôle : détection de l’information | Rôle : reconnaissance de l’information |
Réseaux tangentiels
- Dans la couche plexiforme externe et la couche nucléaire interne :
- Les cellules horizontales GABAergiques, en contact avec les cônes et les bâtonnets, se connectent localement les unes avec les autres grâces à des jonctions communicantes, et participent à la génération de l’antagonisme centre/périphérie.
- Dans la couche plexiforme interne :
- Il existe de très nombreuses classes de cellules amacrines, comme les cellules amacrines AI, AII ou starbust, qui contribuent à des réseaux complexes avec les cellules bipolaires et ganglionnaires, mais aussi des cellules dopaminergiques ou des cellules interplexiformes lesquelles régulent l’activité des cellules horizontales, par exemple.
De la transduction au potentiel d'action : schéma général
Les photorécepteurs
Il existe deux types de photorécepteurs qui transforment (ou transduisent), le signal lumineux (photons) en signaux électriques (potentiels récepteurs) puis chimique (via le neurotransmetteur, glutamate) :
- les cônes pour la vision diurne et colorée dont on distingue trois sous-types L, M et S (ou rouge, vert, bleu), en fonction de leur sensibilité spectrale, et
- les bâtonnets pour la vision crépusculaire et nocturne en « noir et blanc ».
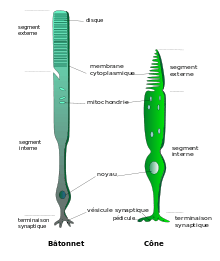
Histologiquement, les photorécepteurs se présentent avec un péricaryon autour du noyau cellulaire dont le pôle supérieur est surmonté successivement par un segment interne renfermant principalement ergastoplasme et mitochondries, puis un segment externe lequel est constitué d'un empilement de citernes (ou disques) membranaires élaborées dans le segment interne pour les bâtonnets, et de replis membranaires de surface décroissante pour les cônes. Ces citernes et replis membranaires renferment les pigments visuels.
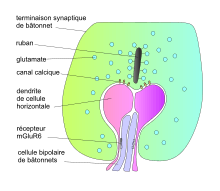
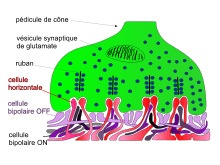
Au pôle inférieur du péricaryon des cônes, des évaginations cytoplasmiques, ou pédicule, définissent des terminaisons synaptiques avec les cellules horizontales et les cellules bipolaires[6]. Ces synapses revêtent un aspect particulier et sont dites en ruban (« ribbon synapses »). Elles se composent d'invaginations du pédicule où se logent les dendrites de deux cellules horizontales et de deux à cinq cellules bipolaires. En regard, au sein du compartiment intracellulaire, se trouve un densité présynaptique autour de laquelle s'accumulent des vésicules emplies de glutamate. Le ruban synaptique est une structure spécialisée qui joue un rôle important pour guider vers les zones d'exocytose les vésicules de glutamate.
La terminaison axonale des bâtonnets, de forme sphérique, est connue sous le nom de sphérule. C'est l'équivalent du pédicule du cône mais en plus petit (3-5 μm de diamètre contre 8-10 μm). La sphérule comporte aussi des rubans synaptiques dirigés vers les invaginations contenant des dendrites de cellules horizontales et de cellules bipolaires.
Dans le pédicule du cône, une trentaine de rubans sont associés à des invaginations contenant des éléments postsynaptiques[7] ; dans la sphérule d'un bâtonnet, deux rubans sont associés avec quatre invaginations et leurs contenus. Un pédicule de cône peut avoir plusieurs centaines de contacts synaptiques.
Sensibilité à la lumière : les pigments visuels
Chaque photorécepteur synthétise dans son segment interne au-dessus du péricaryon, et stocke dans la membrane plasmique de son segment externe, des pigments composés d'une protéine porteuse qui détermine la sensibilité spectrale, et qui est couplée à une molécule chromophore qui capte les photons.
Dans le cas des bâtonnets, le pigment correspond à la rhodopsine constituée par une protéine: l'opsine, et le chromophore : 11-cis rétinal, aldéhyde de la vitamine A de sensibilité maximale correspondant à un rayonnement d'environ 510 nm (de couleur vert).
Pour les cônes, les pigments sont le : cyanolabe (S), chlorolabe (M), et érythrolabe (L), respectivement sensibles à la lumière de longueur d'onde maximale : 420 nm (bleu), 530 nm (vert) et 560 nm (rouge). Chez l'être humain il y a environ 5 à 7 millions de cônes, et 120 millions de bâtonnets.
Des recherches actuelles[8],[9] tendent à prouver que chez un certain pourcentage d'hommes (10 %) et de femmes (50 %), il existerait un quatrième type de cônes sensibles aux oranges.
Cônes (C) et bâtonnets (B)s'opposent quant à la propriété de leur pigments visuels: sensibilité forte (B) et faible (C), acuité forte (C) et faible (B), et adaptation forte (B) et faible (C).
| Propriétés des pigments visuels | ||
| Cônes | Bâtonnets | |
| sensibilité | faible | forte |
| acuité | forte | faible |
| adaptation | faible | forte |
Transduction
L'absorption d'un photon par le chromophore entraîne des modifications électro-chimiques transitoires des photorécepteurs qui affectent sa polarité, et la libération de Glu à son pôle basal.
Mécanismes biochimiques (exemple des bâtonnets) : Au repos (dans l'obscurité), les bâtonnets apparaissent spontanément dépolarisés (-40 mV) en raison de l'existence d'un flux rentrant de cations (sodium et calcium, et dans une moindre mesure (5 %) de magnésium et potassium). Ce flux est lié à l'ouverture de conductances transmembranaires sous l'action du GMPc (guanosine monophosphate cyclique) synthétisé à partir de l'action de la guanylate-cyclase sur le GTP (guanosine triphosphate). Le flux de potassium active un canal antiport : le potassium entrant est excrété en même temps que du sodium est pompé dans le milieu extracellulaire ce qui contribue à accroître le flux entrant global de cet ion.
L'illumination de la rétine provoque la capture de photon par la rhodopsine. Il s'ensuit une modification géométrique du chromophore (photoisomérisation) qui passe du 11-cis rétinal en 11-trans-rétinal. Ce phénomène se produit au sein de la membrane des citernes des segments externes.
Cette photo-isomérisation conduit à l'activation d'une protéine également membranaire: la transducine dont une sous-unité alpha se détache et se recombine transitoirement à une molécule de GTP, et à une enzyme jusqu'alors inactive: la phosphodiestérase. Le complexe résultant concourt à activer la phosphodiestérase laquelle, à son tour, hydrolyse et donc inactive le GMPc en GMP. Or, le GMpc est responsable de l'ouverture des canaux cationiques à l'origine de la dépolarisation. Donc, la diminution de la concentration de GMPc entraîne une fermeture de ces canaux. La diminution du flux entrant de sodium repolarise alors la membrane.
Cette repolarisation qui se propage du segment externe à l'ensemble du photorécepteur se traduit au niveau des terminaisons synaptiques par une réduction de la libération de glutamate dans la fente synaptique.
L'ensemble de ce mécanisme électro-chimique subit une amplification qui permet notamment de contrebalancer le bruit thermique (thermoisomérisation) : 1 photon active 100 transducines qui activent 1 000 phosphodiestérases.
Cascades d'activations/inhibitions sur les réseaux radiaires
- Au repos dans l'obscurité, les photorécepteurs se trouvent spontanément dépolarisés, et libèrent à leur base un neurotransmetteur : le glutamate (Glu). Le Glu diffuse dans la fente synaptique vers les cellules bipolaires ON qu'il inhibe en se fixant sur des récepteurs métabiotropes APB, et vers les cellules bipolaires OFF, qu'il active en se fixant sur des récepteurs ionotropes. Il s'ensuit que seule les cellules ganglionnaire OFF ainsi activées par les cellules bipolaires OFF émettront des potentiels d'action au sein du nerf optique (l'inverse de la fig. 5).
- En présence de lumière dont l'intensité recrutera soit les cônes soit les bâtonnets, l'absorption des photons au niveau des segments externes des photorécepteurs se solde par une hyperpolarisation cellulaire et corrélativement par une diminution de l'excrétion de Glu. Il en résulte une activation des cellules bipolaires ON par désinhibition et donc des cellules ganglionnaires ON associées, et une inhibition des cellules bipolaires OFF (fig. 5).
Champs récepteurs des cellules ganglionnaires : antagonisme centre/périphérie
Le champ récepteur d'un neurone sensoriel désigne l'ensemble des récepteurs en relation avec le neurone sensoriel. Il est constitué de deux parties : centre et périphérie, antagonistes l’une de l’autre (centre excitateur, périphérie inhibitrice). Il améliore le contraste et donc la précision de l’information.
L'activation d'une cellule ganglionnaire dépend de l'illumination d'une région circulaire de la rétine et son inhibition d'une région annulaire circonscrivant la précédente région. Ces deux régions concentriques déterminent le champ récepteur à centre ON (activateur) et à périphérie OFF (inhibitrice).
La configuration inverse comportant un centre OFF et une périphérie ON existe également. Dans le premier cas, l'illumination du pourtour OFF conduit à l'inhibition du récepteur, et celle simultanée des centres ON et pourtour OFF conduit à une activation décroissante en fonction de l'étendue de l'illumination du pourtour. En conséquence, l'activité électrique finale des cellules ganglionnaires traduit le contraste lumineux, estimé grâce à l'antagonisme centre/périphérie de leurs champs récepteurs.
Le centre ON se compose des circuits radiaires incluant successivement : photorécepteurs, cellules bipolaires (et amacrines AII pour les bâtonnets) et cellules ganglionnaires (fig. 5). La périphérie OFF dépend de la présence des cellules horizontales connectées aux photorécepteurs situées dans cette zone. En effet, l'illumination des photorécepteurs de la zone OFF entraîne l'activation des cellules horizontales sous-jacentes, couplées entre elles par des jonctions communicantes. Ces cellules horizontales s'hyperpolarisent et libèrent alors un neurotransmetteur : le GABA, qui inhibe les photorécepteurs de la zone ON. Les cellules horizontales sont ainsi responsables d'une inhibition latérale dont l'extension spatiale dépend du couplage des cellules horizontales entre elles par des jonctions communicantes qui propagent l'hyperpolarisation. Les cellules plexiformes contrôlent cette extension spatiale en découplant les cellules horizontales. Les cellules horizontales H1 pourvues d'un très long axone se connectent aux bâtonnets, et aux cônes L et M, alors que les cellules horizontales H2 dépourvues d'un tel axone se connectent aux cônes majoritairement de type S.
Types de cellules ganglionnaires
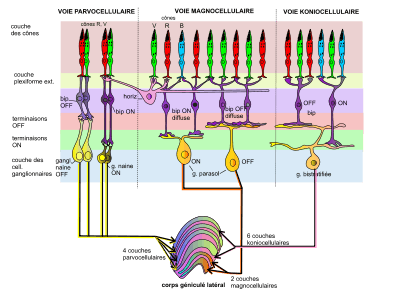
Selon Werblin & Roska (2007), il y aurait chez l'Homme au moins 27 types de cellules amacrines, 10 sortes de cellules bipolaires et 12 types de cellules ganglionnaires, lesquelles prétraitent l'information visuelle et envoient 12 « films rétiniens » d'information visuelle au cerveau. Chaque groupe d'un même type de cellule contribue à produire l'un de ces 12 films[10].
Chez les primates, trois voies principales conduisent en parallèle l'information visuelle vers les structures centrales :
- cellules ganglionnaires naines et voie parvocellulaire P
Les cellules ganglionnaires naines (« midget ») à centre ON (ou respectivement OFF) reçoivent l'information visuelle des cellules bipolaires ON (resp. OFF), elles-mêmes connectées aux cônes R et V (fig. 11) de la fovéa. Ces cellules ganglionnaires possèdent de longs et fins axones qui aboutissent sur les 4 couches parvocellulaires dorsales du corps géniculé latéral. Cette voie est responsable de la haute résolution du système visuel, en raison de la densité élevée des cônes R et V dans la fovéa[11]. Elles contribuent aussi à la perception du rouge et du vert. Un grand nombre d'entre elles sont des « cellules à opposition simple de couleur », c'est-à-dire, par exemple, pour une cellule ganglionnaire à centre rouge ON, les cônes R occupent le centre du champ récepteur et les cônes V la périphérie (et mutatis mutandis pour ON/OFF, Rouge/Vert). Elles donnent une réponse soutenue (tonique) à la lumière ; - cellules ganglionnaires en parasol et voie magnocellulaire M
Les cellules ganglionnaires de grande taille, dites « en parasol », reçoivent l'information des multiples cellules bipolaires ON ou OFF, elles-mêmes connectées à une collection aléatoire de cônes B, V, R, sans sensibilité à une longueur d'onde spécifique et donc non sensibles à la couleur. Ces cellules ganglionnaires en parasol se projettent sur les deux couches magnocellulaires du corps genouillé latéral. La voie magnocellulaire est responsable de l'analyse de contraste de luminance. Ces cellules parasol donnent une réponse transitoire (phasique) à la lumière ; - cellules ganglionnaires bistratifiées de type S et voie koniocellulaire K
Les cellules ganglionnaires bistratifiées ON reçoivent l'information des cellules S-bipolaires ON, elles-mêmes connectées à plusieurs cônes S. Elles peuvent manifester une opposition de couleur bleu/jaune. Elles se projettent sur les couches interlaminaires du corps genouillé latéral. Cette voie koniocellulaire est activée par la lumière bleue et inhibée par le jaune, combinaison de rouge et vert. Leur résolution spatiale est assez mauvaise. - Système des bâtonnets
Il n'y a pas de cellules ganglionnaires spécifiquement dédiées à la vision nocturne. Les bâtonnets empruntent la voie des cellules ganglionnaires des cônes pour transmettent leur signal au système central[11]. Dans un environnement peu éclairé où les cônes ne sont pas recrutés, seule l'activation des bâtonnets se transmet aux cellules bipolaires ON de bâtonnets. Des cellules amacrines AII recueillent ensuite le signal d'une vingtaine de cellules bipolaires et le transmette via des jonctions communicantes aux axones de cellules bipolaires ON de cônes. La projection sur le CGL se fait par les axones des cellules ganglionnaires aboutissant sur les couches parvocellulaires et/ou magnocellulaires du CGL.
Transformation multicanaux : l'image impulsionnelle
On a vu que ce sont seulement les cellules ganglionnaires (CG) qui émettent les potentiels d'action (PA) qui seront transmis au reste du système nerveux central, ce qui montre que depuis les 108 photorécepteurs (PhR) via environ 109 cellules intermédiaires et jusqu'au nerf optique constituée par les axones du million de cellules ganglionnaires (soit une compression de l'ordre de 100 en nombre de cellules), la transformée rétinienne est une transformation d'une intensité lumineuse variant dans le temps à un signal spatiotemporel impulsionnel de potentiels d'actions[12]. On remarque aussi que le nombre relativement peu élevé de fibres en sortie montre que la taille du signal doit être comprimée pour qu'il soit transmis efficacement au reste du système nerveux central. Une méthode "utilisée" par la rétine est alors de transformer l'information visuelle en un signal multicanaux qui tend à séparer les sources qui ont produit la sensation lumineuse, réduisant ainsi la dimension du signal à transmettre. De nombreux scientifiques du champ des neurosciences computationnelles ont tenté de modéliser la rétine afin de créer des prothèses mais aussi pour mieux comprendre son fonctionnement. Parmi eux, on peut citer les travaux de David Marr sur la perception de la luminance dans la rétine des primates[13].
En particulier, Atick[14] a montré que la réponse des cellules ganglionnaires à différentes fréquences spatiales coïncidait avec une réduction des corrélations spatiales entre des locations voisines, montrant ainsi que des principes écologiques peuvent guider la compréhension des fonctions rétiniennes. Un aspect du codage rétinien est donc de souligner des parties non redondantes et qui sont donc relativement saillantes. Dans notre cadre, cette sensibilité va permettre de propager plus rapidement les parties de l'image les plus saillantes, conduisant de plus à une transformation temporelle de l'information spatiale.
De façon analogue, on observe que les cellules ganglionnaires transforment l'information lumineuse en signaux relativement indépendants. Ainsi l'information de couleur, la chrominance est séparée de l'information d'intensité lumineuse, conduisant à un "multiplexage" de l'information lumineuse. On observe ainsi que des cellules ganglionnaires morphologiquement et fonctionnellement différentes (cellules a, b et g) vont porter des canaux différents. Ce découplage sera aussi temporel puisque l'information d'intensité lumineuse est plus rapidement activée que la couleur, créant ainsi des voies à plusieurs latences pour l'information rétinienne.
Finalement, si on présente assez rapidement une image à un sujet pour éviter toute saccade oculaire, celle-ci va se projeter au fond de l'œil en une image distordue et inversée, activer les photo-récepteurs puis tout le réseau rétinien pour enfin être transformée en de multiples canaux par les cellules ganglionnaires. De manière synthétique, chacune de ces cellules peut alors être caractérisée par une sensibilité maximale à un canal particulier et par une réponse temporelle, mais les sensibilités peuvent se recouvrir avec celles d'autres CGs et sont interdépendantes (Salinas01). L'image que nous percevons est alors entièrement codée en un train d'impulsions en environ 20-40 ms. Alors que la vague d'activité rejoint maintenant le nerf optique, le décodage de cette transformation dans le reste du système visuel semble alors tenir du miracle.
Pathologies de la rétine
Parmi les nombreuses pathologies de la rétine, on peut citer les maladies génétiques suivantes :
- l'achromatopsie absence totale de vision des couleurs, acuité visuelle réduite, forte photophobie et nystagmus
- l'amaurose congénitale de Leber
- le daltonisme
- la rétinite pigmentaire
L'achromatopsie et le daltonisme sont stables, alors que l'amaurose congénitale de Leber et les rétinites pigmentaires sont dégénératives. Des essais de thérapie génique ont donné des résultats positifs sur des animaux atteints de certaines formes d'achromatopsie et d'amaurose congénitale de Leber.
Citons également :
- le décollement de rétine
- la dégénérescence maculaire liée à l'âge
- l'hémorragie rétinienne
- occlusion artérielle et veineuse
- les rétinopathies, dont la rétinopathie diabétique
- l'agnosie : trouble de la reconnaissance des objets, des personnes ou des lieux, qui n’est pas rattaché à un déficit sensoriel. L’origine de cette déficience est liée à un dysfonctionnement de l’aire V4.
- la prosopagnosie : forme particulière d’agnosie qui se traduit par une perturbation de l’aptitude à reconnaître les visages.
- l'akinétopsie : perte sélective de la perception du mouvement liée à un dysfonctionnement de l’aire V5.
- l'ataxie visuelle : déficit du contrôle visuel de la préhension et d’autres mouvements.
Recherche et développement, prospective
D'importants moyens sont consacrés à la vision artificielle et notamment à une rétine artificielle ou à d'autres types d'implants rétiniens pouvant améliorer la vue (en cas de dégénérescence maculaire liée à l'âge par exemple[15] ou (re)donner la vue à des non-voyants[16],[17],[18]
Biomimétisme
Depuis 20 ans au moins, divers projets universitaires ou industriels visent à produire une rétine artificielle[19],[20] (éventuellement haute-résolution[21] et/ou programmable[22],[23]), parfois déjà brevetés[24],[25] et qui pourrait aussi s'inscrire dans une perspective transhumaniste[26].
La spin-off Chronocam issue de l'Institut de la vision, un centre de recherche affilié à l'université Pierre-et-Marie-Curie, au CNRS et à lInserm, créée en 2014 à Paris, vise à créer une rétine artificielle (sur la base d'une seconde génération de capteurs CMOS (Complementary metal oxide semi-conductor) pour produire une vision artificielle qui pourrait améliorer les caméras, la vision par ordinateur et être associée au machine learning et à la cobotique, afin de mieux et plus rapidement extraire de l'information à partir des images[27]. Ceci permettrait de s'affranchir des contraintes des capteurs et systèmes photographiques en ne capturant et transmettant que information de changement et en n'envoyant au cerveau (artificiel de cas échéant) que ces informations de "mise à jour" en temps quasi-réel et en consommant moins d'énergie[27]. Selon Chronocam, la vision serait alors environ 30 fois plus rapide qu'avec les capteurs actuels. l'entreprise lors de deux levées de fonds a collecté 20 millions de dollars au total auprès d'entreprises comme Bosch, 360 Capital, Intel Capital, Renault-Nissan et le CEA[27]. Des applications militaires seraient aussi envisagées dans le domaine de la surveillance et du renseignement en lien avec la Direction générale de l'armement (DGA), Thales et Sagem et selon l'entreprise avec la Darpa (pour des applications médicales avec un projet d'implant cortical).
Une autre idée est d'appliquer à un télescope un « algorithme de rétine artificielle » par exemple pour lui permettre de mieux trouver ou suivre une cible (en temps réel)[28],[29]
Notes et références
- S. R. Y. CAJAL, Histologie Du Système Nerveux de l'Homme et Des Vertébrés, Maloine, Paris, 1911.
- M. Imbert, « La neurobiologie de l'image » La recherche 1983;14:600-13.
- Dale Purves, G-J Augustine, D. Fitzpatrick, W-C Hall, LaManta, McNamara, Williams, Neurosciences, De Boeck, , 811 p..
- Stewart A. Bloomfield and Ramon F. Dacheux, « Rod Vision: Pathways and Processingin the Mammalian Retina », Progress in Retinal and Eye Research, vol. 20, no 3, , p. 351-384.
- W. Rowland Taylor, Robert G. Smith, « Transmission of scotopic signals from the rod to rod-bipolar cell in the mammalian retina », Vision Research, vol. 44, , p. 3269-3276.
- Silke Haverkamp, Ulrike Grunert et Heinz Wassle, « The Cone Pedicle, a Complex Synapse in the Retina », Neuron, vol. 27, , p. 85-95.
- appelé « triade » par Missotten.
- Backhaus, Kliegl & Werner « Color vision, perspectives from different disciplines » (De Gruyter, 1998), p. 115-116, section 5.5.
- Pr Mollon (université de Cambridge), Pr Jordan (université de Newcastle) « Study of women heterozygote for colour difficiency » (Vision Research, 1993).
- Werblin F & Roska B (2007) Des films sur la rétine. Pour la Science (juin).
- (en) Rudolf Nieuwenhuys, Jan Voogd, Chr. van Huijzen, The Human Central Nervous System, Springer, 1978, 2008, 967 p..
- (en) M. MEISTER ET M. J. B. II, « The neural code of the retina » Neuron 1999:22:435-50.
- Marr, D. (1974), « The computation of lightness by the primate retina. », Vision Research, 14:1377-1388.
- J. J. ATICK ET A. N. REDLICH, « What does the retina know about natural scenes? », in Neural Computation, p. 196-210, 1992.
- Massé A & Buhannic L (2017) Vers un traitement personnalisé de la dégénérescence maculaire liée à l’âge. Actualités Pharmaceutiques, 56(565), 26-29 (résumé).
- Barale P.O, Mohand-Said S, Ayello-Scheer S, Haidar J, Picaud S & Sahel J.A (2017) Retrouver une vision (artificielle) grâce aux implants rétiniens. Photoniques, (85), 31-33 (résumé).
- Roux, S., Gascon, P., Pham, P., Matonti, F., & Chavane, F. (2017). Clarifier l’impact fonctionnel des rétines artificielles. médecine/sciences, 33(4), 389-392 (résumé).
- Bougrain L & Le Golvan B (2016) Les neuroprothèses. L'Évolution Psychiatrique, 81(2), 353-364.
- Benzi, M., Escobar, M. J., & Kornprobst, P. (2017). A Bio-inspired Synergistic Virtual Retina Model for Tone Mapping (Doctoral dissertation, Inria Sophia Antipolis) (résumé).
- Yamamoto, Y., Ishizaki, T., Matsuda, T., & Kimura, M. (2016, June). Wireless power supply to artificial retina using poly-Si thin-film transistor. In Future of Electron Devices, Kansai (IMFEDK), 2016 IEEE International Meeting for (pp. 1-2). IEEE (résumé).
- Wu, T. (2016). High-resolution Artificial Retina Project in SIAT-CAS (résumé).
- Bernard, T. M., Zavidovique, B. Y., & Devos, F. J. (1993). A programmable artificial retina. IEEE Journal of Solid-State Circuits, 28(7), 789-798.
- Nshare, A. (2002). Définition et conception d'une nouvelle génération de rétines programmables (Doctoral dissertation, Paris 11) (résumé).
- Narayan, K. S., Gautam, V., & Bag, M. (2016). Artificial retina device ; U.S. Patent No. 9,322,713. Washington, DC: U.S. Patent and Trademark Office.
- Lin, P. K. (2016). Structure of artificial electronic retina U.S. Patent No. 9,427,569. Washington, DC: U.S. Patent and Trademark Office.
- Jacques H (2016) " A propos du transhumanisme L’Homme augmenté dans un monde recomposé ", dossier de Jacques Hallard.
- Bergounhoux Julien (2017) Intelligence artificielle, réalité virtuelle... Comment la pépite française Chronocam pourrait tout changer , article paru dans L'usine digitale ; 30 mai
- Abba, A., Bedeschi, F., Caponio, F., Cenci, R., Citterio, M., Coelli, S.... & Marino, P. (2016). Real time tracking with a silicon telescope prototype using the “artificial retina” algorithm. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, 824, 343-345. (résumé).
- Abba, A., Caponio, F., Coelli, S., Citterio, M., Fu, J., Merli, A., ... & Petruzzo, M. (2016). Testbeam results for the first real-time tracking system based on artificial retina algorithm.
Voir aussi
Bibliographie
- R. W. RODIECK, « Quantitative analysis of cat retinal ganglion cell response to visual stimuli », in Vision Research, vol. 5 p. 583-601, 1965.
- R.W. RODIECK (1998), « The first steps in seing », Sinauer.
Vidéographie
- John Dowling (2016) Introduction : l'Initiative Lasker (John Dowling est membre de la National Academy of Sciences, University of Harvard, et de la fondation Lasker qui soutient la recherche sur la rétine) ; enregistrement du 06 juin 2016 09:30 10:00 Colloque Amphithéâtre Marguerite de Navarre - Marcelin Berthelot.
Articles connexes
- Classement thématique des neurosciences
- Hémorragie rétinienne
- Persistance rétinienne
- Dégénérescence rétinienne