Cas9
Cas9 (CRISPR associated protein 9) est une endonucléase d'ADN guidée par ARN, c'est-à-dire une enzyme spécialisée pour couper l'ADN avec deux zones de coupe actives, une pour chaque brin de la double hélice.
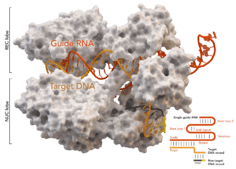
La protéine Cas9 est associée au système immunitaire adaptatif type II de CRISPR (Clustered Regular Interspaced Short Palindromic Repeats). Cette enzyme peut être utilisée en génie génétique pour modifier facilement et rapidement le génome des cellules animales et végétales. Des outils permettant d'éditer le génome existaient depuis les années 1970 mais étaient bien moins efficaces, plus complexes et bien plus coûteux que Cas9. Cette technique Crispr-Cas9, dite des « ciseaux moléculaires », fait beaucoup parler d'elle, entre espoirs de guérir des maladies génétiques et risques de dérives éthiques. Ces questions liées à la modification génétique renvoient directement à la Convention sur les Droits de l'Homme et la biomédecine de 1997, dont l'article 13 est consacré aux interventions sur le génome humain. Il est écrit qu'« une intervention ayant pour objet de modifier le génome humain ne peut être entreprise que pour des raisons préventives, diagnostiques ou thérapeutiques et seulement si elle n'a pas pour but d'introduire une modification dans le génome de la descendance.»[2]
Depuis sa découverte, la protéine Cas9 a été largement utilisée comme outil d'ingénierie du génome pour produire des ruptures du double brin d’ADN ciblées. Ces cassures peuvent conduire à l’inactivation de gènes ou à l'introduction de gènes hétérologues par jonction d'extrémités non homologues ou par recombinaison homologue chez de nombreux organismes. Parallèlement aux nucléases à doigt de zinc et aux protéines TALEN, Cas9 est devenu un outil de premier plan dans le domaine de la génomique. Cas9 a gagné en popularité de par sa capacité à couper l’ADN précisément à n’importe quel emplacement complémentaire de son ARN guide[3]. Contrairement aux méthodes TALEN et à doigts de Zinc, le ciblage de l'ADN par Cas9 est direct et ne requiert pas de modification de la protéine mais seulement de l‘ARN guide[4],[5]. Des versions modifiées de la protéine Cas9 qui se lient mais ne coupent pas l'ADN peuvent être de plus utilisées pour localiser des activateurs ou des suppresseurs de transcription de séquences d'ADN spécifiques afin de contrôler l'activation et l’inactivation de la transcription de certains gènes[6],[7]. Le ciblage Cas9 a été notamment simplifié grâce à la création d’ARN chimérique unique. Des scientifiques ont suggéré que la technologie Cas9 avait le potentiel pour modifier les génomes de populations entières d'organismes[8]. En 2015, des scientifiques en Chine ont utilisé Cas9 pour modifier le génome d'embryons humains pour la première fois[9]. Depuis 2015 et toujours en Chine, des patients atteint notamment de cancers, sont traités à l'aide de CRISPR-Cas9[10].
Fonctionnement
Cas9 est associée aux séquences CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats ou « courtes répétitions palindromiques regroupées et régulièrement espacées ») dans l'immunité adaptative de Streptococcus pyogenes, parmi d'autres bactéries.
Streptococcus. pyogenes utilise l'outil Cas9 pour détecter et défaire l'ADN étranger, tels que l'invasion de l'ADN de bacteriophages ou d'un ADN plasmidique[3]. Cas9 effectue cette détection par déroulement de l'ADN étranger et la vérification de complémentarité avec la région longue d'espacement d'une vingtaine de paires de base de l'ARN guide[11]. Si une séquence d'ADN est apparentée à l'ARN guide, Cas9 découpe l'ADN invasif. En ce sens, l'outil CRISPR/Cas9 a un certain nombre de ressemblances avec le mécanisme de l'interférence par ARN chez les eucaryotes[1].
Invention et brevetage
La technique d'édition de génome CRISPR-Cas9 a été découverte par l'équipe de la chercheuse française Emmanuelle Charpentier avec l'aide de l'Américaine Jennifer Doudna à l'université de Californie à Berkeley. Elle a été par la suite développée à partir de 2012 par plusieurs chercheurs, dont notamment le biologiste moléculaire Feng Zhang, du Broad Institute (en) (associé à Harvard et au MIT). Berkeley conteste devant une commission d'appel de l'United States Patent and Trademark Office le brevet accordé au Broad Institute pour cette découverte[12]. Le , l'United States Patent and Trademark Office a considéré que les brevets déposés par le Broad Institute sur l'usage de CRISPR/Cas9 dans le cas de cellules eucaryotes étaient valides. Pour autant, les revendications de l'université de Berkeley (à l'origine des dépôts de brevets de Jennifer Doudna et d'Emmanuelle Charpentier) quant à l'emploi de CRISPR/Cas9 sur tous types de matériel génétique (y compris les cellules eucaryotes) n'ont pas été rejetées[13],[14].
Outil de génie génétique
Outre sa fonction d'origine bactérienne dans l'immunité, la protéine Cas9 est utilisée comme un outil du génie génétique pour induire des cassures double brin dans l'ADN. Ces ruptures peuvent conduire à l'inactivation du gène ou à l'introduction de gènes hétérologues à travers deux types de réparation : la jonction d'extrémités non-homologues et la recombinaison homologue chez de nombreux organismes modèles de laboratoire.
Ce genre d'outil existait déjà avec les Transcription activator-like effector nucleases (TALEN) et les nucléases à doigt de zinc mais Cas9, grâce à son efficacité, sa rapidité et son faible coût devient un outil de premier plan dans le domaine de la thérapie génique.
La compréhension de l'outil CRISPR/Cas9 a progressé au cours des années 2010, car il peut découper pratiquement toutes les séquences complémentaires de l'ARN guide[15]. Grâce à la spécificité de la cible de Cas9 qui provient de l'ARN guide et de la complémentarité de l'ADN et non pas des modifications de la protéine elle-même (comme TALEN et les nucléases à doigt de zinc), l'outil Cas9 peut cibler un nouvel ADN assez facilement[16]. La souplesse de conception couplée avec les versions de Cas9 qui lient mais ne découpent pas d'ADN apparenté a aussi un potentiel pour la correction et désactivation des gènes en localisant l'activateur ou les répresseurs des séquences spécifiques d'ADN[17],[18]. Une simplification plus poussée a été fournie dans une étude inédite en 2012 qui représente la création d'un ARN chimérique de guidage unique, plutôt que l'ARN guide original composé de deux ARN disparates qui s'associent à de l'ARN-CRISPR, et la trans-activation de l'ARN[15]. Les scientifiques suggèrent que les lecteurs de gènes à la base de Cas9 peuvent être capables d'éditer les génomes de populations entières d'organismes[19]. Tout comme la révolution de la biologie moléculaire qui a accompagné la découverte des enzymes de restriction dans les années 1970, la « boîte à outils Cas9 » détient également un grand potentiel.
Applications
Les premières applications ont été réalisées sur des animaux et notamment des primates[20]. Grâce à Crispr-Cas9 et son coût de développement réduit, des scientifiques ont déjà créé des vaches sans cornes (pour éviter qu'elles ne se blessent). D'autres prévoient de ressusciter des espèces disparues comme le mammouth par exemple[21].
L'industriel Monsanto, filiale de Bayer, a acquis fin 2016 les droits d’exploitation de Crispr-Cas9[22].
Modification d'embryons humains
Le , des chercheurs de Canton ont publié un article dans Protein & Cell (en) annonçant avoir utilisé la technique CRISPR/Cas9 pour modifier génétiquement des embryons humains[23]. Selon Junjiu Huang, qui a dirigé ces recherches, cet article aurait été refusé[24] par Science et Nature à cause des problèmes éthiques que posent de telles recherches. L'article note une sensibilité et une spécificité insuffisantes de la technique pour qu'elle puisse être utilisée en thérapie génique à ce stade[25].
En décembre 2015, au vu des multiples questions de sécurité et d’éthique, un meeting organisé par l’Académie américaine des Sciences et de la Médecine, l’Académie chinoise des sciences, et la Société Royale de Londres, a recommandé un moratoire. Malgré cela, repoussant les accusations d'eugénisme, de nombreux bioéthiciens et scientifiques ont soutenu que si des anomalies dans des gènes particuliers causant des conditions fatales et débilitantes pouvaient être corrigées dans un embryon, alors elles devaient l’être[26].
En janvier 2016, la Grande-Bretagne autorise la manipulation génétique sur des embryons humains à l'Institut Francis Crick situé à Londres. Cela permettrait d'étudier le début du développement de l'embryon et d'identifier ce qui provoque la réussite ou l'échec d'une fécondation in vitro mais relance néanmoins le débat sur l'éthique et la finalité de telles études[27].
Fredrik Lanner, un scientifique suédois de l’Institut Karolinska à Stockholm, utilise cette enzyme dans le but de trouver de nouveaux traitements concernant l’infertilité et les fausses couches. Cette enzyme désactive les gènes CRISPR-cas9 dans les embryons afin d’observer leurs rôles dans le développement précoce de ceux-ci[28],[29]
En juillet 2017, une équipe de chercheur de Portland dans l'Oregon annonce avoir modifié avec succès des embryons humains[30]. Les chercheurs ont corrigé efficacement des gènes défectueux à l'origine de maladies héréditaires. Aucun embryon n'a été autorisé à se développer pendant plus de quelques jours. Le processus appelé « ingénierie de la lignée germinale » modifie le code ADN des enfants qui pourrait ensuite être transmis aux générations suivantes grâce à leurs propres gamètes. Les chercheurs ont notamment pu montrer de façon convaincante qu'il était possible d'éviter les erreurs dues aux effets « hors cible » relevées par une autre étude en 2017[31].
Thérapie génique
Grâce à CRISPR-Cas9, une équipe américaine a réussi à rendre un moustique résistant au paludisme et prévoit de le libérer dans la nature pour transmettre ce gène de résistance à l'ensemble de l'espèce évitant ainsi les 500 000 victimes humaines annuelles liées à cette maladie[32].
CRISPR-Cas9 ouvre également la voie à de nombreuses solutions de thérapie génique telles que la guérison du cancer, de la mucoviscidose, de l'hémophilie ou Alzheimer. En somme, « rendre les humains plus résistants » et rallonger notre espérance de vie[21]. En mai 2017, les premiers tests de lutte contre le SIDA effectués sur des souris ont été concluants[33].
Des chercheurs chinois ont utilisé Crispr-Cas9 en août 2016 sur des patients atteints d'un cancer du poumon[34]. C'est la première fois que Crispr sera utilisé sur des humains adultes. Lu You, oncologiste de l'université chinoise de Sichuan, va tenter de modifier les lymphocytes T des patients avec Crispr. Dans le cas de cancer, les cellules T n'attaquent pas les tumeurs, car elles n'arrivent pas à reconnaître en ces cellules malades des ennemis étrangers au corps humain. Les chercheurs chinois vont donc tenter d'extraire du patient ces cellules de défense, puis d'utiliser Crispr-Cas9 pour « couper » un gène bien particulier, appelé PD-1 pour lui permettre d'attaquer la tumeur. La cellule génétiquement modifiée sera ensuite multipliée in vitro, puis elles seront toutes réinjectées dans le corps du patient[35] (voir aussi Récepteur antigénique chimérique et Transfert adoptif de cellule).
Aux États-Unis, un essai similaire est en attente d'une autorisation de la FDA, le « gendarme » américain de la santé. L'autorisation pourrait arriver d'ici à la fin de l'année.
Une start-up américaine spécialisée sur Crispr et financée par Bill Gates souhaite également réaliser ses premiers essais sur un être humain pour venir à bout d'une maladie rare touchant les yeux.
En 2017, la technologie CRISPR-Cas9 a permis également d'importantes avancées des thérapies de transfert adoptif de cellules en immunologie en facilitant la reprogrammation des cellules immunitaires avec des premiers succès thérapeutiques.
Dans une publication parue dans Nature en 2017, des chercheurs de l'Université de Pittsburgh ont utilisé CRISPR-Cas9 pour modifier directement l'ADN des cellules cancéreuses par l'intermédiaire d'un virus. Les essais chez la souris ont montré une réduction des tumeurs sans nuire aux cellules saines. Au terme de l'étude, toutes les souris traitées étaient encore en vie contrairement au groupe témoin où toutes les souris avaient péri[36].
Forçage génétique
Améliorations variétales
De nombreuses applications sont en cours pour la création et l'amélioration de variétés végétales[37].
L'utilisation du système CRISPR/Cas9 pour la sélection variétale permet d'accélérer et d'améliorer considérablement les méthodes utilisées actuellement par les créateurs de nouvelles variétés.
Des tolérances à des maladies sur le blé, le riz et le concombre sont déjà au point. La maturation chez la tomate peut être améliorée. Dans le futur, de nombreuses autres applications pourront se développer, tels des tolérances aux stress abiotiques (sécheresse, salinité, température,…), des facteurs de qualité améliorés (composés nutritionnels), ...
Inconvénients
Des chercheurs de l’université de Columbia (États-Unis) alertent sur les résultats observés chez deux souris[31]. Traitées avec succès pour une cécité génétique grâce à CRISPR Cas9, les deux rongeurs présentaient, après la thérapie, 1 500 mutations inattendues sur l’ensemble de leur génome en dehors des zones prévues d’intervention[38]. Plus inquiétant encore, CRISPR-Cas9 aurait causé 100 insertions ou délétions de séquences d’ADN. Suite à l’édition de leur génome, les souris ne semblaient pas souffrir de pathologies particulières mais ces mutations sont potentiellement dangereuses, et peuvent provoquer des cancers ou d’autres maladies génétiques. Cependant, dans la semaine qui a suivi la publication de l'étude des scientifiques ont pointé du doigt des erreurs dans l'étude notamment l'identification comme mutation d'erreurs dues en fait à des différences naturelles, le faible nombre d'animaux étudiés ainsi que des erreurs d'identification de gènes[39]. Des scientifiques des entreprises Intellia Therapeutics et Editas Medicine dénoncent les résultats et demandent le retrait de la publication[40] :
« Il est clair que les auteurs ne sont pas des experts en CRISPR Cas9, ni en séquençage de génome, ni en génétique de base. Leur identification de « mutations inattendues » démontre clairement leur manque de perspicacité scientifique sur ce sujet »[41]
L'Institut national de la santé et de la recherche médicale, dans une note du Comité d'éthique de février 2016, développe son avis sur les technologies d'édition du génome. Dans le point numéro 5, l'Inserm rappelle qu'avec l'édition du génome, la médecine touche à une question plus philosophique. En effet, l'édition du génome mettrait en tension la plasticité du vivant et l'idée d'une nature humaine biologiquement invariante. Il désire ainsi mettre en place une réflexion sur la question.[42]
De plus, le Comité international de bioéthique (CIB) de l'Unesco a demandé un moratoire sur les "techniques d'édition de l'ADN des cellules reproductrices humaines afin d’éviter une modification ‘contraire à l’éthique’ des caractères héréditaires des individus, qui pourrait faire resurgir l’eugénisme"[43]. L'Unesco propose d'ailleurs un principe général de précaution dans son rapport de 2015 (proposition 105[44]).
Le 14 février 2017, « un rapport conjoint de l'Académie des sciences et de l'Académie de médecine américaines a levé un tabou » relatif à ces inconvénients « en avalisant l'utilisation de cet outil pour modifier le matériel génétique de l'embryon humain, quitte à ce que ces modifications se transmettent à sa descendance future[45] ».
Références
- Nishimasu, H., Ran, F., Hsu, P. D., Konermann, S., Shehata, S. I., Dohmae, N., ... & Nureki, O., « Crystal structure of Cas9 in complex with guide RNA and target DNA. », Cell, vol. 156(5), , p. 935-949 (DOI 10.1016/j.cell.2014.02.001, lire en ligne).
- « <Convention sur les Droits de l'Homme et la biomédecine> », sur www.rm.coe.int, (consulté le 3 avril 2018).
- Martin Jinek, Krzysztof Chylinski, Ines Fonfara et Michael Hauer, « A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity », Science (New York, N.Y.), vol. 337, no 6096, , p. 816–821 (ISSN 1095-9203, PMID 22745249, DOI 10.1126/science.1225829, lire en ligne).
- (en) Le Cong, F. Ann Ran, David Cox et Shuailiang Lin, « Multiplex Genome Engineering Using CRISPR/Cas Systems », Science, vol. 339, no 6121, , p. 819–823 (ISSN 0036-8075 et 1095-9203, PMID 23287718, PMCID PMC3795411, DOI 10.1126/science.1231143, lire en ligne).
- Prashant Mali, Kevin M. Esvelt et George M. Church, « Cas9 as a versatile tool for engineering biology », Nature Methods, vol. 10, no 10, , p. 957–963 (ISSN 1548-7105, PMID 24076990, PMCID PMC4051438, DOI 10.1038/nmeth.2649, lire en ligne).
- Prashant Mali, John Aach, P. Benjamin Stranges et Kevin M. Esvelt, « CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering », Nature Biotechnology, vol. 31, no 9, , p. 833–838 (ISSN 1546-1696, PMID 23907171, PMCID PMC3818127, DOI 10.1038/nbt.2675, lire en ligne).
- Luke A. Gilbert, Matthew H. Larson, Leonardo Morsut et Zairan Liu, « CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes », Cell, vol. 154, no 2, , p. 442–451 (ISSN 0092-8674, PMID 23849981, PMCID PMC3770145, DOI 10.1016/j.cell.2013.06.044, lire en ligne).
- Kevin M. Esvelt, Andrea L. Smidler, Flaminia Catteruccia et George M. Church, « Concerning RNA-guided gene drives for the alteration of wild populations », eLife, vol. 3, (ISSN 2050-084X, PMID 25035423, PMCID PMC4117217, DOI 10.7554/eLife.03401, lire en ligne).
- (en) David Cyranoski et Sara Reardon, « Chinese scientists genetically modify human embryos », Nature, (DOI 10.1038/nature.2015.17378, lire en ligne).
- (en-US) Preetika Rana, Amy Dockser Marcus et Wenxin Fan, « China, Unhampered by Rules, Races Ahead in Gene-Editing Trials », Wall Street Journal, (ISSN 0099-9660, lire en ligne)
- Robert Heler, Poulami Samai, Joshua W. Modell et Catherine Weiner, « Cas9 specifies functional viral targets during CRISPR-Cas adaptation », Nature, vol. 519, no 7542, , p. 199–202 (ISSN 0028-0836, PMID 25707807, PMCID PMC4385744, DOI 10.1038/nature14245, lire en ligne).
- (en) Kelly Servick, « Accusations of errors and deception fly in CRISPR patent fight », Science, .
- (en) Sharon Begley, « Broad Institute prevails in heated dispute over CRISPR patents », Stat, , consulté le .
- (en) Sharon Begley, « 6 Takeaways from the CRISPR Patent Decision », Scientific American, , consulté le .
- Jinek, M.; Chylinski, K.; Fonfara, I.; Hauer, M.; Doudna, J. A.; Charpentier, E. (2012). A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science 337 (6096): 816–821. DOI:10.1126/science.1225829.
- Mali, P; Esvelt, K. M.; Church, G. M. (2013). Cas9 as a versatile tool for engineering biology. Nature Methods 10 (10): 957–63. DOI:10.1038/nmeth.2649.
- DOI:10.1038/nbt.2675.
- DOI:10.1016/j.cell.2013.06.044.
- DOI:10.7554/eLife.03401.
- La Recherche - « La modification de l'ADN à la portée de tous », Jean-Philippe Braly, mensuel n° 495, janvier 2015, p. 60.
- « CRISPR-CAS9, une révolution biologique qui divise. », JT de 20 h - France 2 - .
- Hervé Ratel, « Monsanto ajoute Crispr à son arsenal », Sciences et Avenir, (lire en ligne).
- (en) « CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes » [PDF], sur link.springer.com.
- Marie-Céline Jacquier, « Des embryons humains modifiés génétiquement par des chercheurs chinois », sur Futura-Sciences, .
- « Manipulation génétique sur l'embryon : une transgression inquiétante », Généthique, .
- « CRISPR-CAS9 : QU'EN DISENT LES PREMIERS CONCERNÉS ? synthèse de presse bioéthique », Généthique - .
- Tristan Vey, « Des manipulations génétiques sur des embryons humains autorisées en Grande-Bretagne », sur lefigaro.fr, (consulté le 1er février 2016).
- (en) Rob Stein, « Breaking Taboo, Swedish Scientist Seeks To Edit DNA Of Healthy Human Embryos », NPR.org, (lire en ligne).
- Stéphanie Schmidt, « Un scientifique suédois modifie l'ADN d'un embryon humain », Trust My Science, (lire en ligne).
- (en) Steve Connor, « EXCLUSIVE: First human embryos edited in U.S., using CRISPR », MIT Technology Review, (lire en ligne).
- (en) « Unexpected mutations after CRISPR–Cas9 editing in vivo - Kellie A Schaefer, Wen-Hsuan Wu, Diana F Colgan, Stephen H Tsang, Alexander G Bassuk & Vinit B Mahajan - Nature Methods 14, 547–548 (2017) doi:10.1038/nmeth.4293 », en ligne le .
- « Un moustique génétiquement modifié contre le paludisme », LE MONDE SCIENCE ET TECHNO - .
- « Le sida éradiqué chez des souris grâce à des "ciseaux à ADN" », Les Échos, .
- « LA RÉVOLUTION CRISPR-CAS9 TESTÉE EN CHINE POUR SOIGNER LE CANCER DU POUMON », Grégory Rozières, Le Huffington Post, .
- (en) « PD-1 Knockout Engineered T Cells for Metastatic Non-small Cell Lung Cancer - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le 2 mai 2017).
- (en) Zhang-Hui Chen, Yan P. Yu, Ze-Hua Zuo et Joel B. Nelson, « Targeting genomic rearrangements in tumor cells through Cas9-mediated insertion of a suicide gene », Nature Biotechnology, vol. advance online publication, (ISSN 1546-1696, DOI 10.1038/nbt.3843, lire en ligne).
- « Le système CRISPR/Cas9 : Pour la compréhension du vivant et l’innovation variétale », Cécile Collonnier, Jardins de France n° 644.
- « CRISPR-Cas9 : 1 500 mutations inattendues observées par Jonathan Herchkovitch », sur PourquoiDocteur.fr.
- (en) Antonio Regalado, « CRISPR companies are hitting back at a paper that warned of unexpected mutations », MIT Technology Review, (lire en ligne).
- (en) Editas Medicine, « The experimental design and data interpretation in “Unexpected mutations after CRISPR–Cas9 editing in vivo” by Schaefer t al.are insufficient to support the conclusions drawn by the authors », http://arep.med.harvard.edu, (lire en ligne).
- (en-US) « Intellia’s Response to Nature Methods Article on CRISPR/Cas9 - Intellia Therapeutics », Intellia Therapeutics, (lire en ligne).
- « <Saisine concernant les questions liées au développement de la technologie CRISPR (clustered regularly interspaced short palindromic repeat)-Cas9 > », sur www.inserm.fr, (consulté le 3 mai 2018).
- « Le Comité internationale de bioéthique de l'Unesco appelle à un moratoire sur les techniques d'édition de l'ADN | Gènéthique », sur www.genethique.org (consulté le 3 avril 2018)
- « Rapport UNESCO »
- « Quelles limites aux manipulations génétiques », sur lesechos.fr
Annexes
Articles connexes
- CRISPR
- Édition génomique
- New Breeding Techniques
- Nucléase à doigt de zinc
- Transcription activator-like effector nuclease
- Portail de la biologie