Ciclosporine
La ciclosporine[2] est un agent immunosuppresseur dont l'utilisation thérapeutique, dès le début des années 1980, a permis un essor considérable du domaine de la transplantation d'organes en prévenant le rejet aigu des allogreffes. Aujourd'hui encore largement employée en transplantation (peau, cœur, rein, poumons, pancréas, moelle osseuse, intestin grêle), quoique concurrencée par des molécules plus récentes, la ciclosporine a également des applications en dermatologie et dans le traitement de certaines maladies auto-immunes.
| Ciclosporine | ||
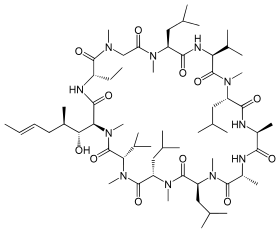 | ||
 | ||
| Modélisation 3D de la molécule de ciclosporine. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | [R-[[R*,R*-(E)]]-(L-alanyl- D-alanyl-N-méthyl-L-leucyl- N-méthyl-L-leucyl-N-méthyl- L-valyl-3-hydroxy-N,4-diméthyl- L-2-amino-6-octénoyl-L-α-amino- butyryl-N-méthylglycyl-N-méthyl- L-leucyl-L-valyl-N-méthyl-L-leucyl) cyclique | |
| No CAS | ||
| No ECHA | 100.119.569 | |
| Code ATC | L04, S01 | |
| DrugBank | DB00091 | |
| PubChem | 2909 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule brute | C62H111N11O12 [Isomères] |
|
| Masse molaire[1] | 1 202,6112 ± 0,0632 g/mol C 61,92 %, H 9,3 %, N 12,81 %, O 15,96 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | variable | |
| Métabolisme | Hépatique | |
| Demi-vie d’élim. | variable (environ 24 h) | |
| Excrétion | ||
| Considérations thérapeutiques | ||
| Classe thérapeutique | Immunosuppresseur Inhibiteur de la calcineurine |
|
| Voie d’administration | Orale Intraveineuse Topique |
|
| Précautions | Néphrotoxicité | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Initialement isolée dans un échantillon de sol en Norvège[3], la ciclosporine A est la forme principale du médicament. Il s'agit d'un peptide cyclique de onze acides aminés synthétisé par un champignon microscopique, Tolypocladium inflatum. Elle comporte des acides aminés dextrogyres, rarement rencontrés dans la nature[4].
Indications
Les propriétés immunosuppressives de la ciclosporine ont été découvertes le par le laboratoire Sandoz (devenu Novartis) à Bâle, au cours d'une étude sur l'immunosuppression dirigée par le docteur Hartmann F. Stähelin (en) (qui découvrit aussi l'étoposide). L'efficacité de la ciclosporine A dans la prévention du rejet des allogreffes fut démontrée d'abord pour les transplantations hépatiques par le docteur Thomas Starzl, de l'Université de Pittsburgh. La première patiente à en avoir bénéficié était une femme de 28 ans, le [5]. La ciclosporine fut autorisée en 1983 par la Food and Drug Administration (FDA).
Outre le domaine de la transplantation d'organes, la ciclosporine est utilisée en dermatologie pour le traitement des formes les plus sévères de psoriasis et de dermatite atopique. En rhumatologie elle est un traitement d'indication exceptionnelle de la polyarthrite rhumatoïde et de maladies apparentées. Elle a été étudiée dans plusieurs autres maladies auto-immunes telles que le syndrome de Stevens-Johnson, dans la rectocolite hémorragique en cas de non-réponse aux corticoïdes[6] et dans certaines uvéites postérieures ou moyennes non infectieuses.
La ciclosporine A a fait l'objet d'études comme possible agent neuroprotecteur dans les traumatismes crâniens et a fait la preuve expérimentale de son efficacité pour réduire les lésions cérébrales associées aux traumatismes[7]. La ciclosporine A bloque la formation du pore de transition de perméabilité mitochondriale, canal de la membrane mitochondriale impliqué dans la genèse des lésions liées aux traumas crâniens et aux maladies neurodégénératives.
Historique de la découverte de la ciclosporine
L’histoire de la ciclosporine illustre le caractère parfois inopiné de certaines découvertes. Le programme de recherche de Sandoz était à l’époque orienté vers la découverte de nouveaux antibiotiques à partir des micro-organismes présents dans des échantillons de terre récoltés un peu partout dans le monde. La ciclosporine rapportée de Scandinavie a été découverte alors que ses propriétés antibiotiques étaient nulles mais elle se révéla efficace sur les maladies auto-immunes comme la polyarthrite rhumatoïde[8].
Mode d'action
Le mode d’action de la ciclosporine n’est pas complètement connu. Il est actuellement admis que la molécule se lie à la cyclophiline des lymphocytes immunocompétents, particulièrement des lymphocytes T. Le complexe ciclosporine-cyclophiline inhibe la calcineurine, protéine phosphatase qui, dans des circonstances normales, active la transcription du gène de l'interleukine 2. Il inhibe également la production d'autres lymphokines, conduisant à une réduction de l'activité des lymphocytes T effecteurs[9].
La ciclosporine A exerce aussi une activité sur les mitochondries. Elle inhibe l'ouverture du pore de transition de perméabilité, bloquant la libération du cytochrome c dans le cytosol. Elle est ainsi un inhibiteur de l'apoptose.
Effets indésirables et interactions
Le traitement par ciclosporine est associé à un risque non négligeable de complications et d'interactions médicamenteuses. Les effets indésirables les plus documentés de la ciclosporine A sont la néphrotoxicité et les maladies opportunistes qui résultent de l'immuno-suppression (infections, plus rarement cancers). Les autres effets adverses sont variés, non spécifiques et rarement graves.
Une autre forme du médicament, la ciclosporine G, a montré une néphrotoxicité moindre que la ciclosporine A[10]. Elle en diffère par la position du second acide aminé, où une L-norvaline remplace l'acide α-aminobutyrique[11].
Les inhibiteurs de l'isoenzyme 3A4 du cytochrome P450 diminuent la métabolisation de la ciclosporine. En particulier, la consommation de jus de pamplemousse, un inhibiteur puissant de cet isoenzyme, peut conduire à l’accumulation de ciclosporine, augmentant le risque d'apparition d'effets secondaires dépendant de la dose[12].
Le scandale de 1985
En octobre 1985, trois médecins de l’hôpital Laennec, à Paris, les professeurs Philippe Even, pneumologue, Jean-Marie Andrieu, cancérologue, et le docteur Alain Venet, immunologiste, expérimentent la ciclosporine A sur deux patients atteints du sida, puis donnent le 29 octobre une conférence de presse annonçant qu'ils ont trouvé un traitement du sida[13] (en fait, la raison de l’augmentation du nombre de T4 des patients était leur neutralisation par la ciclosporine A, mais, du fait même de cette neutralisation, cette augmentation n'est d'aucun secours au patient). Les magazines s'emballent, et Joël de Rosnay lui-même écrit dans un de ses ouvrages[14] qu'à l'avenir, la ciclosporine sera incontournable pour traiter le sida. Hélas, les deux patients traités meurent, ainsi qu'un troisième traité à Grenoble. Le coup sera dur pour l'image de la recherche médicale française, celle du ministère de la santé et celle de l'auteur[15],[16].
Formulations
Le médicament est commercialisé par Novartis sous les noms Sandimmun (présentation originale) et Neoral (microémulsion la plus récente)[17]. Les formes génériques ont été commercialisées sous divers noms (Cicloral par Sandoz, Gengraf par Abott). Depuis 2002, la ciclosporine est disponible en émulsion topique sous forme de collyre unidose pour le traitement du syndrome de l’œil sec dans les formes chroniques et de la kératoconjonctivite sèche sous le nom Restasis.
Le médicament est également formulé pour certaines préparations vétérinaires sous la marque Atopica ® pour le traitement de la dermatite atopique canine et féline. La ciclosporine est efficace chez le chien et le chat à moindre dose et avec moins d'effets indésirables.
Divers
La ciclosporine fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[18].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- On rencontre également la forme « cyclosporine », mais la DCI est « ciclosporine ».
- Yves Landry « Initiation à la connaissance du médicament-UE6 PACES » Ediscience, 2e édition, août 2012, p. 110
- (en) Borel JF, « History of the discovery of cyclosporin and of its early pharmacological development », Wien. Klin. Wochenschr., vol. 114, no 12, , p. 433-7 (PMID 12422576)
- (en) Starzl TE, Klintmalm GB, Porter KA, Iwatsuki S, Schröter GP, « Liver transplantation with use of cyclosporin a and prednisone », N Engl J Med., vol. 305, no 5, , p. 266-9 (PMID 7017414)
- (en) Lichtiger S, Present DH, Kornbluth A et al., « Cyclosporine in severe ulcerative colitis refractory to steroid therapy », N Engl J Med., vol. 330, no 26, , p. 1841-5 (PMID 8196726)
- (en) Sullivan PG, Thompson M, Scheff SW, « Continuous infusion of cyclosporin A postinjury significantly ameliorates cortical damage following traumatic brain injury », Exp Neurol., vol. 161, no 2, , p. 631-7 (PMID 10686082, DOI 10.1006/exnr.1999.7282)
- (en) Calne RY, White DJG, Thiru S, Evans DB, McMaster P, Dunn DC et al., « Cyclosporin A in patients receiving renal allografts from cadaver donors », Lancet, vol. II, , p. 1323-1327
- (en) Foxwell B. M., Ruffel B., « The mechanisms of action of cyclosporine », Cardiology Clinics, vol. 8, n° 1, 1990, p. 107-117 ()
- (en) Henry ML, Elkhammas EA, Davies EA, Ferguson RM, « A clinical trial of cyclosporine G in cadaveric renal transplantation », Pediatr Nephrol., vol. 9 Suppl, , S49-51 (PMID 7492487)
- (en) Calne RY, White DJ, Thiru S, Rolles K, Drakopoulos S, Jamieson NV, « Cyclosporin G: immunosuppressive effect in dogs with renal allografts », Lancet, vol. 1, no 8441, , p. 1342 (PMID 2860538)
- La Revue Prescrire, décembre 2012, tome 32, n°350 (Suppl. Interactions Médicamenteuses), p. 219
- http://www.jp-m.eu/dossiers/dufoix.php
- Joël de Rosnay, Le Macroscope, première édition
- « La troublante affaire cyclosporine-sida » Science&Vie no 820 - janvier 1986, page 36
- http://www.persee.fr/web/revues/home/prescript/article/reso_0751-7971_1999_num_17_95_2157
- (en) Gibaud S, Attivi D (2012) « Microemulsion for oral administration and their therapeutics applications » Expert Opin Drug Deliv.
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Portail de la médecine
- Portail de la biochimie
- Portail de la chimie
- Portail de la pharmacie