Virus Nipah
Le virus Nipah est l'agent infectieux qui, chez l'homme, provoque l'infection à virus Nipah, maladie respiratoire et neurologique grave présentant un taux de létalité variant de 40 % à 75 % selon les épidémies. Il s'agit d'un virus à ARN monocaténaire de polarité négative (groupe V de la classification Baltimore) et à génome non segmenté, appartenant à la famille des Paramyxoviridae, genre Henipavirus. Son réservoir naturel est la roussette, notamment les espèces présentes en Océanie, en Asie du Sud-Est, en Asie du Sud et en Afrique subsaharienne.
| Type | Virus |
|---|---|
| Domaine | Riboviria |
| Embranchement | Negarnaviricota |
| Sous-embr. | Haploviricotina |
| Classe | Monjiviricetes |
| Ordre | Mononegavirales |
| Famille | Paramyxoviridae |
| Genre | Henipavirus |
Description
Le génome du virus Nipah est constitué de 18,2 kilobases codant six protéines structurelles[4]. Comme c'est la règle chez les paramyxovirus[5], le nombre de nucléotides dans ce génome est un multiple de six, ce qu'on appelle « la règle de six[6] ». Un écart par rapport à cette règle, par mutation ou formation d'un génome incomplet, rend inefficace la multiplication du virus[7], vraisemblablement du fait de contraintes structurelles dues à l'interaction entre l'ARN et la nucléoprotéine N du virus[8].
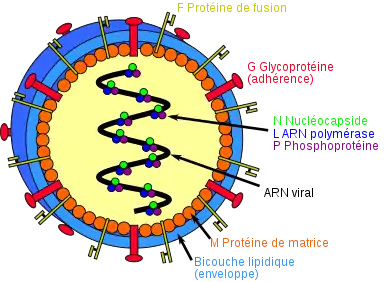
Le virus Nipah est entouré d'une enveloppe virale formée d'une bicouche lipidique recouvrant des protéines de matrice notées M. La surface du virus présente des glycoprotéines G assurant l'adhérence (attachment en anglais) du virus sur la cellule hôte, en particulier sur l'éphrine B2, une protéine hautement conservée présente chez de nombreux mammifères[9],[10],[11], et des trimères de protéines F assurant la fusion de la membrane virale avec la membrane plasmique de la cellule hôte, un effet collatéral étant la formation de grands syncytia résultant de la fusion de plusieurs cellules hôtes voisines sous l'effet de cette protéine virale[12] ; la structure tridimensionnelle de la protéine d'attachement G a été établie par cristallographie aux rayons X[13]. L'intérieur du virus est constitué d'un ARN viral et d'une protéine N de nucléocapside complexée avec une protéine L fonctionnant comme enzyme de type ARN polymérase ARN-dépendante elle-même liée à une phosphoprotéine P indispensable à l'activité enzymatique de la protéine L.
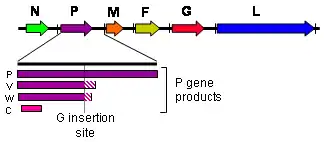
Comme les autres Henipavirus, le virus Nipah produit plusieurs protéines différentes à partir de l'unique gène P à la suite d'un processus d'édition des ARN messagers, dans ce cas par une modification post-transcriptionnelle consistant en l'ajout d'un ou deux résidus de guanosine au niveau d'un site d'édition du gène P avant sa transcription par les ribosomes de la cellule hôte[14] : le gène P produit ainsi une protéine P à partir de l'ARN messager non modifié, une protéine V dans le cas de l'insertion d'un résidu de guanosine, et une protéine W dans le cas de l'insertion de deux résidus de guanosine ; un quatrième produit de transcription, la protéine C, résulte d'un cadre de lecture ouvert alternatif. Si la phosphoprotéine P contribue à l'activité ARN polymérase ARN-dépendante de la protéine L, les protéines V, W et C jouent un rôle d'inhibiteur des défenses antivirales de la cellule hôte, sans que les mécanismes exacts de leur mode d'action soit bien compris[14],[15].
Compte tenu du danger biologique qu'il représente, le virus Nipah ne peut être manipulé que dans un laboratoire P4 ou BSL-4[16],[17].
Le virus Nipah a provoqué une épidémie en 1998 en Malaisie, avec les porcs comme hôtes intermédiaires, ce qui a eu pour conséquence l'abattage de nombreux élevages[18],[19].
Notes et références
- (en) Image publiée sur flickr par le NIAID (juillet 2018).
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- (en) Gaya K. Amarasinghe, Yīmíng Bào, Christopher F. Basler, Sina Bavari, Martin Beer, Nicolás Bejerman, Kim R. Blasdell, Alisa Bochnowski, Thomas Briese, Alexander Bukreyev, Charles H. Calisher, Kartik Chandran, Peter L. Collins, Ralf G. Dietzgen, Olga Dolnik, Ralf Dürrwald, John M. Dye, Andrew J. Easton, Hideki Ebihara, Qi Fang, Pierre Formenty, Ron A. M. Fouchier, Elodie Ghedin, Robert M. Harding, Roger Hewson, Colleen M. Higgins, Jian Hong, Masayuki Horie, Anthony P. James, Dàohóng Jiāng, Gary P. Kobinger, Hideki Kondo, Gael Kurath, Robert A. Lamb, Benhur Lee, Eric M. Leroy, Ming Li, Andrea Maisner, Elke Mühlberger, Sergey V. Netesov, Norbert Nowotny, Jean L. Patterson, Susan L. Payne, Janusz T. Paweska, Michael N. Pearson, Rick E. Randall, Peter A. Revill, Bertus K. Rima, Paul Rota, Dennis Rubbenstroth, Martin Schwemmle, Sophie J. Smither, Qisheng Song, David M. Stone, Ayato Takada, Calogero Terregino, Robert B. Tesh, Keizo Tomonaga, Noël Tordo, Jonathan S. Towner, Nikos Vasilakis, Viktor E. Volchkov, Victoria Wahl-Jensen, Peter J. Walker, Beibei Wang, David Wang, Fei Wang, Lin-Fa Wang, John H. Werren, Anna E. Whitfield, Zhichao Yan, Gongyin Ye et Jens H. Kuhn, « Taxonomy of the order Mononegavirales: update 2017 », Archives of Virology, vol. 162, no 8, , p. 2493-2504 (PMID 28389807, PMCID 5831667, DOI 10.1007/s00705-017-3311-7, lire en ligne)
- (en) Lin-Fa Wang, Brian H. Harcourt, Meng Yu, Azaibi Tamin, Paul A. Rota, William J. Bellini et Bryan T. Eaton, « Molecular biology of Hendra and Nipah viruses », Microbes and Infection, vol. 3, no 4, , p. 279-287 (PMID 11334745, DOI 10.1016/S1286-4579(01)01381-8, lire en ligne)
- (en) Daniel Kolakofsky, Thierry Pelet, Dominique Garcin, Stéphane Hausmann, Joseph Curran et Laurent Roux, « Paramyxovirus RNA Synthesis and the Requirement for Hexamer Genome Length: the Rule of Six Revisited », Journal of Virology, vol. 72, no 2, , p. 891-899 (PMID 9444980, PMCID 124558, lire en ligne)
- (en) Y. P. Chan, K. B. Chua, C. L. Koh, M. E. Lim et S. K. Lam, « Complete nucleotide sequences of Nipah virus isolates from Malaysia », The Journal of General Virology, vol. 82, no Pt 9, , p. 2151-2155 (PMID 11514724, DOI 10.1099/0022-1317-82-9-2151, lire en ligne)
- (en) Kim Halpin, Bettina Bankamp, Brian H. Harcourt, William J. Bellini et Paul A. Rota, « Nipah virus conforms to the rule of six in a minigenome replication assay », The Journal of General Virology, vol. 85, no Pt 3, , p. 701-707 (PMID 14993656, DOI 10.1099/vir.0.19685-0, lire en ligne)
- (en) Filip Yabukarski, Philip Lawrence, Nicolas Tarbouriech, Jean-Marie Bourhis, Elise Delaforge, Malene Ringkjøbing Jensen, Rob W H Ruigrok, Martin Blackledge, Viktor Volchkov et Marc Jamin, « Structure of Nipah virus unassembled nucleoprotein in complex with its viral chaperone », Nature Structural & Molecular Biology, vol. 21, no 9, , p. 754-759 (PMID 25108352, DOI 10.1038/nsmb.2868, lire en ligne)
- (en) Matthew I. Bonaparte, Antony S. Dimitrov, Katharine N. Bossart, Gary Crameri, Bruce A. Mungall, Kimberly A. Bishop, Vidita Choudhry, Dimiter S. Dimitrov, Lin-Fa Wang, Bryan T. Eaton et Christopher C. Broder, « Ephrin-B2 ligand is a functional receptor for Hendra virus and Nipah virus », Proceedings of the National Academy of Sciences of the United States of America, vol. 102, no 30, , p. 10652-10657 (PMID 15998730, PMCID 1169237, DOI 10.1073/pnas.0504887102, JSTOR 3376138, Bibcode 2005PNAS..10210652B, lire en ligne)
- (en) Oscar A. Negrete, Ernest L. Levroney, Hector C. Aguilar, Andrea Bertolotti-Ciarlet, Ronen Nazarian, Sara Tajyar et Benhur Lee, « EphrinB2 is the entry receptor for Nipah virus, an emergent deadly paramyxovirus », Nature, vol. 436, no 7049, , p. 401-405 (PMID 16007075, DOI 10.1038/nature03838, Bibcode 2005Natur.436..401N, lire en ligne)
- (en) Thomas A. Bowden, Max Crispin, E. Yvonne Jones et David I. Stuart, « Shared paramyxoviral glycoprotein architecture is adapted for diverse attachment strategies », Biochemical Society Transactions, vol. 38, no 5, , p. 1349-1355 (PMID 20863312, PMCID 3433257, DOI 10.1042/BST0381349, lire en ligne)
- (en) K. B. Chua, W. J. Bellini, P. A. Rota, B. H. Harcourt, A. Tamin, S. K. Lam, T. G. Ksiazek, P. E. Rollin, S. R. Zaki, W.-J. Shieh, C. S. Goldsmith, D. J. Gubler, J. T. Roehrig, B. Eaton, A. R. Gould, J. Olson, H. Field, P. Daniels, A. E. Ling, C. J. Peters, L. J. Anderson2 et B. W. J. Mahy, « Nipah Virus: A Recently Emergent Deadly Paramyxovirus », Science, vol. 288, no 5470, , p. 1432-1435 (PMID 10827955, DOI 10.1126/science.288.5470.1432, JSTOR 3075321, Bibcode 2000Sci...288.1432C, lire en ligne)
- (en) Thomas A. Bowden, Max Crispin, David J. Harvey, A. Radu Aricescu, Jonathan M. Grimes, E. Yvonne Jones et David I. Stuart, « Crystal Structure and Carbohydrate Analysis of Nipah Virus Attachment Glycoprotein: a Template for Antiviral and Vaccine Design », Journal of Virology, vol. 82, no 23, , p. 11628-11636 (PMID 18815311, PMCID 2583688, DOI 10.1128/JVI.01344-08, lire en ligne)
- (en) Sachin Kulkarni, Valentina Volchkova, Christopher F. Basler, Peter Palese, Viktor E. Volchkov et Megan L. Shaw, « Nipah Virus Edits Its P Gene at High Frequency To Express the V and W Proteins », Journal of Virology, vol. 83, no 8, , p. 3982-3987 (PMID 19211754, PMCID 2663244, DOI 10.1128/JVI.02599-08, lire en ligne)
- (en) Megan L. Shaw, Adolfo García-Sastre, Peter Palese et Christopher F. Basler, « Nipah Virus V and W Proteins Have a Common STAT1-Binding Domain yet Inhibit STAT1 Activation from the Cytoplasmic and Nuclear Compartments, Respectively », Journal of Virology, vol. 78, no 11, , p. 5633-5641 (PMID 15140960, PMCID 15140960, DOI 10.1128/JVI.78.11.5633-5641.2004, lire en ligne)
- (en) « Biosafety in Microbiological and Biomedical Laboratories, 5th Edition », CDC, (consulté le ).
- (en) Section VIII—Agent Summary Statements, CDC, 2009.
- Stéphane Biacchesi, Christophe Chevalier, Marie Galloux, Christelle Langevin, Ronan Le Goffic et Michel Brémont, Les virus : Ennemis ou alliés ?, Versailles, Quæ, coll. « Enjeux Sciences », , 112 p. (ISBN 978-2-7592-2627-6, lire en ligne), IV. Pourquoi certains virus sont-ils dangereux ?, chap. 1 (« Les virus émergents »), p. 76, accès libre.
- « Le lac maudit », de Chong Fah Hing, in Revue Jentayu, numéro spécial "En ces temps incertains", juillet 2020 (ISBN 979-10-96165-19-3).
- Portail de la virologie