Enveloppe virale
L’enveloppe virale est une structure externe existant chez certains virus. Elle consiste en une membrane lipidique constituée à partir de la membrane en double couche de la cellule hôte, et de protéines virales qui y sont insérées. L'enveloppe virale contient habituellement une capside contenant l'acide nucléique viral. Selon l'espèce de virus, l'enveloppe provient de la membrane extérieure de la cellule, ou de celles du réticulum endoplasmique, par exemple de l'appareil de Golgi au sein de la cellule.

La présence d'une enveloppe virale est un critère important pour la distinction entre virus, la taxonomie des virus. On y distingue les virus enveloppés des virus nus. Alors que les virus nus ne peuvent quitter leur cellule hôte qu'à la destruction de celle-ci (lyse), les virus enveloppés peuvent être libérés sans une telle destruction. L'enveloppe virale a une grande importance pour l'infection de la cellule par le virus, la stabilité envers les influences externes, notamment les désinfectants, ainsi qu'une plus grande capacité de changement de la surface du virus. Cette variabilité au moyen de l'enveloppe est un avantage évolutionnaire par rapport aux virus nus. Elle permet aux virus enveloppés d'échapper plus facilement aux défenses immunitaires de l'hôte, ou de mieux s'adapter à un nouvel hôte. Ces propriétés de l'enveloppe virale deviennent évidentes quand on constate que tous les virus émergents chez l'homme, qui représentent un danger de pandémie, sont des virus enveloppés, comme le HIV, le SRAS, le virus de la grippe, le virus Ebola ou le virus du Nil occidental.
Découverte
Les débuts de la virologie et la définition des virus comme une nouvelle forme d'agents infectieux sont liés à la découverte de deux virus nus : le virus de la mosaïque du tabac (Dmitri Ivanovski, 1892 et Martinus Beijerinck, 1898) et celui de la fièvre aphteuse (Friedrich Löffler et Paul Frosch, 1897)[1]. Le virus de la fièvre jaune découvert par Walter Reed (1901)[2] a été le premier virus identifié chez l'homme, et également le premier virus enveloppé décrit. Mais ces recherches se sont limitées aux modes de transmission, la morphologie des virus est restée tout d'abord inconnue, sauf leur extrême petitesse (invisibilité au microscope optique).
Ce n'est que dans les années 1930 que cette barrière de résolution insuffisante du microscope a pu être franchie avec le microscope électronique par Ernst Ruska et son frère Helmut. Déjà, les premières vues avec cette nouvelle technique montraient des contours de virus de forme allongée ou ronde[3]. Avec les premiers produits de contraste, il n'était cependant pas encore possible de faire de différences dans la structure fine des virus, ni de représenter l'enveloppe. Cependant, Helmut Ruska proposa en 1943 une première classification des virus selon leur taille et leur forme, avec les échantillons alors disponibles[4]. Précédemment, les virus étaient classés par les organismes hôtes et la maladie provoquée.
Dans les années 1950, les virus ont pu être cultivés à dessein dans des cultures de cellules mises au point dans ce but par Renato Dulbecco et Harry Eagle, et multipliés en grand nombre. La pureté et la concentration de ces préparations de virus a permis une détermination plus précise de la composition chimique des virus, et notamment de leur partie lipidique. Jusqu'à la mise au point de cette technique, il a fallu se limiter à l'isolation des virus à partir de cellules infectées, ou de leur culture inventée en 1932[5] et améliorée en 1946[6] sur des embryons de poulet. Certains virus perdaient leur capacité à infecter les embryons de poulet, quand on les traitait au préalable avec diverses substances, et notamment des solvants des graisses comme l'éther (diéthyléther) ou des détergents comme le désoxycholate de sodium[7]. Cette « sensibilité à l'éther » comme on l'appelait ne s'observait qu'avec un certain nombre de virus, comme les virus de la grippe, ou les virus de l'herpès. D'autres, comme celui de la poliomyélite ou de la fièvre aphteuse restent infectieux même après traitement par l'éther. La sensibilité à l'éther devint donc un critère supplémentaire important dans la classification des virus, et a pu être mise en relation dès les années 1950 avec la présence de lipides dans les virus purifiés[8]. Les virus sensibles à l'éther montrent une proportion de lipides de 20 à 30 %.


On souçonnait alors que la fraction de lipides pourrait être corrélée avec la structure d'une membrane. L'existence de membranes en double couche de lipides avait été montrée dans les cellules par les travaux de Gorter et Grendel dès 1925[9], et il était tentant de supposer une structure analogue chez les virus contenant des lipides. La preuve en a été apportée de façon décisive par le fait que la composition des lipides des virus correspondait à celle des cellules-hôtes dans lesquelles les virus avaient été cultivés[10]. La première indication d'une enveloppe virale sur les images de microscope électronique peut être retracée ultérieurement dans une étude de Coriell en 1950. Il a isolé des virus d'herpès simplex à partir de vésicules d'herpès. Il y observa une forme curieuse, ronde, mais évidée au centre, qu'il décrivit comme « en forme de doughnut (beignet) »[11]. Aujourd'hui, on décrit cette forme typique du virus de l'herpès comme « en œuf sur le plat ». Ceci se réfère à une capside icosaédrique à l’intérieur, entourée d'une enveloppe virale très épaisse. Ce n'est qu'en 1959, quand des produits de contraste à base de sels d'uranium ont été mis au point[12] que la structure des virus s'est montrée beaucoup plus différenciée, si bien que l'on pouvait distinguer l'enveloppe virale. Aujourd'hui encore, ce contraste négatif est la méthode la plus importante pour l'examen des virus au microscope électronique.
Avec les études sur les membranes cellulaires dans les années 1960 et 1970, on a bien mieux compris aussi la structure des enveloppes virales. Ceci a été encore amélioré par la diffractométrie de rayons X, la microscopie électronique à balayage des faces de fracture d'enveloppes congelées, et la spectroscopie en résonance magnétique nucléaire, mais aussi grâce aux nouvelles théories sur les propriétés des membranes biologiques, comme le modèle de la mosaïque fluide mis au point par Singer et Nicolson en 1972 pour décrire l'arrangement et l’organisation des membranes biologiques[13]. Dans les vingt dernières années, c'est surtout la microscopie électronique cryogénique qui a permis des progrès décisifs dans la connaissance de la structure fine des enveloppes virales. Avec ces techniques, on peut déterminer la forme et l'arrangement de chacune des protéines de l’enveloppe, et par analyse de Fourier, aboutir à une représentation de l'enveloppe virale avec une définition de 0,6 à 1 nm.
Structure de l'enveloppe virale
Une enveloppe virale consiste toujours en protéines virales d'enveloppe incorporées dans une membrane en double couche lipidique. L'insertion des protéines virales peut se produire dès leur synthèse dans les ribosomes du réticulum endoplasmique rugueux (RER), sur la membrane du RER, ou alors, les protéines de membrane produites sur le RER sont transportées par le circuit normal vers la membrane cellulaire, la membrane nucléaire ou l'appareil de Golgi. Les protéines de membrane dans ce processus sont concentrées et stockées ensemble, entourées de petites surfaces de membrane. Les protéines de membrane de la cellule sont alors expulsées, et ne sont pas incorporées dans l'enveloppe virale. En raison de cette expulsion des protéines de membrane de la cellule, la membrane en double couche de l'enveloppe virale ne comprend pas toute la membrane cellulaire, mais seulement sa partie lipidique.
La fraction de protéines d'enveloppe insérées est parfois si élevée que la fraction lipidique n'apparaît nulle part à la surface : elle est partout recouverte de protéines. La membrane lipidique de l'enveloppe virale n'est donc plus accessible directement pour les anticorps. Chez certains virus, comme les Hepadnaviridae, la fraction de protéine dans l'enveloppe virale est si grande que l'enveloppe consiste presque exclusivement en protéines d'enveloppe serrées les unes contre les autres. Elles sont alors très régulièrement rangées, et forment une barrière contre les influences extérieures et les détergents plus résistante que chez les autres virus enveloppés.
Fraction lipidique

La membrane lipidique de l'enveloppe virale consiste, comme toutes les membranes cellulaires, en une double couche de phospholipides. Ceux-ci possèdent une tête hydrophile, qui forme des deux côtés la surface de la membrane, et deux chaînes carbonées hydrophobes dirigées vers l'espace entre les deux couches. Les phospholipides entrant dans la structure de l’enveloppe virale sont la phosphatidylcholine ou lécithine, la phosphatidyléthanolamine, la phosphatidylsérine, le phosphatidylinositol et la sphingomyéline. Les trois derniers ne se trouvent pour l'essentiel que dans la couche externe de la membrane. Aux phospholipides s'ajoute encore une grande fraction de cholestérol[14]. Les membranes cellulaires, et ainsi également les enveloppes virales, varient dans leur composition en phospholipides et cholestérol. Une grande teneur en cholestérol est typique pour les membranes cellulaires, tandis que les membranes du réticulum endoplasmique et de l’appareil de Golgi n'en contiennent que peu. Le taux de cholestérol d'une membrane est exprimé en quotient C/P (quotient molaire cholestérol/phospholipides). Il influe de façon décisive sur la morphologie de la membrane. Les membranes riches en cholestérol (quotient C/P typiquement de 0,4 à 0,8) sont plus stables, moins flexibles et, avec une épaisseur de 5 à 6 nm, environ un tiers plus épaisses que les pauvres en cholestérol[15]. Comme la composition en lipides d'une enveloppe virale est en première approximation celle de la membrane cellulaire originale, on peut retrouver entre les enveloppes virales cette différence selon qu'elles proviennent de la membrane cellulaire externe ou de systèmes membranaires intracellulaires.
Un examen plus approfondi montre que la plupart des enveloppes virales ont une composition en lipides légèrement différente de leur membrane d'origine. On ne sait pas encore comment s'effectue cette différenciation de la composition. On suppose une préférence différente entre les phospholipides pendant l'agrégation des protéines d'enveloppe dans la membrane, due à une interaction différente entre les protéines d'enveloppe et les divers lipides, ce qui provoque une liaison privilégiée de certains d'entre eux. La découverte de ce que l'on appelle radeaux lipidiques, c'est-à-dire de microsurfaces nageant dans la membrane et contenant une grande quantité de cholestérol, a montré l'inhomogénéité de la structure de la membrane. Ces radeaux lipidiques paraissent avoir aussi une importance pour l'inclusion sélective dans l'enveloppe virale. Chez certains virus, la présence de ces microsurfaces est même une condition nécessaire pour l'incorporation de protéines d'enveloppe et la construction de l’enveloppe virale[16], car elle élève localement la densité de protéines d'enveloppe et permet leur agrégation. Inversement, la présence de cholestérol dans l'enveloppe virale de certains virus est nécessaire pour leur pénétration dans la cellule. C'est ainsi que dans une culture de virus de la maladie de Carré dans un milieu contenant un antagoniste de la production de cholestérol, la capacité du virus ainsi produit à infecter de nouvelles cellules a chuté d'environ 80 %[17]. Le même phénomène a été observé pour des enveloppes virales du virus varicelle-zona, qui n'ont pas pour origine des membranes cellulaires riches en cholestérol[18].
Tableau : comparaisons des composants lipidiques de membranes cellulaires typiques : MC, RER, REL, AG et d'enveloppes virales : HIV-1 et SVHB. (Voir note[n 1])
| Lipide | MC | RER | REL | AG | HIV-1[19] | SVHB[20] |
|---|---|---|---|---|---|---|
| Cholestérol | 34,5 | 6,6 | 10,4 | 9,1 | 46,8 | 3,1 |
| Phosphatidylcholine | 20,7 | 60,4 | 56,9 | 48,8 | 12,7 | 78,9 |
| Sphingomyéline | 16,0 | 3,3 | 12,4 | 12,2 | 15,1 | 1,9 |
| Phosphatidyléthanolamine | 12,6 | 17,6 | 21,7 | 18,3 | 13,1 | 9,2 |
| Phosphatidylinositol | 4,6 | 8,8 | 6,9 | 7,3 | 1,1 | 3,6 |
| Phosphatidylsérine | 10,3 | 3,3 | — | 4,3 | 8,0 | 0,9 |
| Total lipides % | 87,0 | 91,0 | 96,6 | 82,0 | 28,0 | 24,0 |
| Quotient C/P | 0,53 | 0,07 | 0,11 | 0,10 | 0,88 | 0,03 |
Comme on peut le voir sur les contenus en lipides indiqués sur le tableau, la composition en lipides d'une enveloppe virale permet de conclure à la membrane cellulaire d'origine. Dans l'exemple donné, le HIV-1 a la composition typique d'une membrane cellulaire, et la particule vide SHBV – dont la composition en lipides est la même que celle du virion complet – a le profil lipidique du réticulum endoplasmique rugueux. Les enrichissements et appauvrissements spécifiques des composants par rapport à la membrane d'origine sont aussi visibles. Comme la composition lipidique des membranes de divers types cellulaires est variable, des variations correspondantes de l'enveloppe virale sont attendues pour le même virus, selon le type cellulaire dans lequel il se multiplie, que ce soit dans l'organisme ou en culture. Il peut aussi se produire de légères variations au sein d'une même cellule, si la membrane cellulaire est polarisée, comme les cellules tapissant un vaisseau. Des enveloppes virales différentes peuvent s'y développer dans les zones basales ou apicales[21].
L'importance de la composition lipidique pour les fonctions importantes de l'enveloppe virale, comme la pénétration du virus, l'infectiosité, la fusion de membrane et la structure de la particule virale a été longtemps négligée, car l'attention primordiale se portait sur les propriétés des protéines d'enveloppe. Beaucoup de recherches sur divers virus montrent pourtant récemment le rôle important joué par les lipides pour le fonctionnement de ces protéines d'enveloppe : en particulier, l'enrichissement en cholestérol dans les radeaux lipidiques semble influencer de façon décisive le fonctionnement de l'enveloppe virale[22]. La membrane lipidique y joue un rôle substantiel sur l'arrangement des protéines d'enveloppe et leur repliement correct en structure tertiaire
Protéines d'enveloppe virale

1 : Oligosaccharides – 2 : Pont disulfure – 3 : Domaine transmembranaire – 4 : Membrane lipidique – 5 : Ancrage intracellulaire – 6 : Cytoplasme – C/N : extrémités C/N de la chaîne protéique.
Les protéines d'enveloppe virales sont insérées dans la membrane lipidique de la même façon que les protéines transmembranaires cellulaires. Un ou plusieurs domaines protéiques hydrophobes traversent la membrane et séparent ainsi un petit domaine interne hydrophile, et un plus grand extérieur. Dans la plupart des cas, l'extrémité C (carboxyle) de la chaîne protéique est à l'intérieur, ce qui la fait appartenir à la classe 1 des protéines membranaires.
Le domaine interne (aussi nommé ancre intracellulaire ou domaine ancre) est hydrophile et peut servir à des liaisons suivantes avec des éléments internes. Dans la plupart des cas, ceci sera une capside. Chez les virus avec plusieurs capsides, ou de construction plus complexe, le domaine interne se lie à d'autres protéines, qui complètent l'habillage interne de l'enveloppe virale. Celles-ci sont entre les capsides et l'enveloppe, dans l'espace matrice, et sont nommées protéines de matrice ou protéines matricielles. Dans le cas le plus simple, le domaine interne de la protéine d'enveloppe consiste en une seule extrémité, repliée, de la protéine. Quand la protéine d'enveloppe traverse plusieurs fois la membrane lipidique (multipass), le domaine interne comprend une ou plusieurs boucles. L'interaction entre les domaines internes, directe ou par l’intermédiaire de protéines matricielles ou de la capside, est la force déterminante pour replier la membrane pendant l'enveloppement.
Le domaine transmembranaire consiste en une hélice α hydrophobe, dont la longueur est définie par l'épaisseur de la membrane lipidique. Les virus enveloppés par des membranes cellulaires, plus épaisses et riches en cholestérol, ont besoin pour cette hélice par exemple de 26 acides aminés (virus de la grippe). Si les virus sont enveloppés de membrane du RER, 18 à 20 acides aminés suffisent pour l'hélice transmembranaire (virus de la fièvre jaune). L'élucidation de la structure d'une protéine d'enveloppe peut ainsi donner une indication sur le type de membrane qui a servi à la construction du virion. La protéine d'enveloppe peut aussi posséder plusideurs domaines transmembranaires, dont les hélices forment un faisceau resserré à travers la membrane. Les protéines d'enveloppe de la famille des Flaviviridae possèdent deux hélices transmembranaires, dont la forte liaison entre elles est due à un flanc hydrophile : ces domaines ont donc une structure amphiphile[23]. Comme les lipides de la membrane repoussent les hélices, on peut établir la règle générale que la proportion lipidique d'une enveloppe virale est d'autant plus faible que les protéines d'enveloppe possèdent de domaines transmembranaires.

1 : domaines intracellulaires – 2 : site épitope pour les lymphocytes T – 3 : site de liaison à l'hépatocyte – 4 : région hypervariable – 5 : membrane lipidique – C : extrémité carboxylate.
La partie externe d'une protéine d'enveloppe est la plupart du temps glycosylée à maints endroits, c'est-à-dire liée de façon covalente avec de courtes chaînes de sucres (oligosaccharides), si bien que les protéines d'enveloppe virales sont comptées parmi les glycoprotéines. Cette partie externe de la protéine enveloppe est destinée à la liaison aux récepteurs et à la fusion des membranes au moment de l’infection par le virus. Les autres régions sont aussi reconnues par les anticorps de la défense immunitaire, si bien que les épitopes situés dans les régions exposées se trouvent souvent dans des segments très variables, que l'on nomme régions hypervariables. Ces régions hypervariables de la protéine d'enveloppe conduisent à une grande flexibilité immunologique du virus, car leurs possibilités de mutation limitent les possibilités de liaison avec les anticorps, et peuvent vite s'adadapter aux divers récepteurs cellulaires de leurs nouveaux hôtes.
Les destins essentiels des domaines externes – liaison avec les récepteurs et fusion des membranes – peuvent être réunis sur la même protéine d'enveloppe, ou distribués sur plusieurs protéines différentes. À de rares exceptions près, les protéines d'enveloppe se regroupent en complexes d'une même ou de plusieurs sortes. Ces oligomères, s'ils sont assez gros, peuvent apparaître en microscopie électronique comme des "spikes" (pointes) ou anciennement péplomères. Des spikes très caractéristiques s'observent par exemple dans les familles de virus Orthomyxoviridae et Coronaviridae ; ces derniers ont reçu leur nom à cause de ce caractère.
Le nombre de différentes protéines d'enveloppe et la composition de leurs oligomères caractérise beaucoup de familles de virus. Chez les Rhabdoviridae, il existe une seule sorte de protéine d'enveloppe, qui forme de simples trimères. Chez les rétrovirus, comme le virus du sarcome de Rous, deux glycoprotéines (SU et TM) s'arrangent en un hétérodimère, qui s'associe avec deux autres hétérodimères identiques pour fomer un hexamère. Les alphavirus possèdent deux ou trois protéines d'enveloppe, qui s'associent en trois sous-trimères, à leur tour associés trois par trois.
Chez les virus qui bourgeonnent sur la membrane cellulaire, les protéines d'enveloppe sont d'abord incluses dans la membrane cellulaire, qui est enrichie en protéines possédant la possibilité de fusion. Cette modification de la membrane cellulaire peut conduire à ce que les membranes cellulaires de cellules voisines fusionnent entre elles au moyen de ces protéines virales, et forment ainsi des cellules géantes, appelées syncytiums. Ceci peut être un avantage pour le virus, car avec la fusion des cellules, l'infection peut se développer, et un appareil de synthèse plus grand est mis à disposition du virus. Ceci est par exemple le cas avec le virus respiratoire syncytial. La fusion de cellules de la peau par le virus de la rougeole[24] provoque une inflammation locale, qui apparaît sous l'aspect des taches rougeâtres de la rougeole. Beaucoup de virus ont cependant mis au point des stratégies pour empêcher la formation de syncytiums, car ceux-ci peuvent gêner le bourgeonnement de nouveaux virus. La propriété de fusion des protéines d'enveloppe est alors premièrement activée par une étape supplémentaire d'activation, dans laquelle la région fusionnelle est libérée par le dégagement par une peptidase ou une glycoside hydrolase, ou par l’acidité du milieu (pH < 6) qui amène un changement de conformation de la protéine d'enveloppe, qui relève la région fusionnelle vers l'extérieur. L'exemple le plus connu est celui de la protéine d'enveloppe hémagglutinine des virus de la grippe, qu'il faut d'abord activer par une neuraminidase, et qui possède une activité dépendant de l'acidité.
Les protéines d'enveloppe remplissent occasionnellement dans la membrane cellulaire pendant la multiplication virale des fonctions autres que le simple enveloppement du virion. Pour ceci, elles peuvent s'arranger en nouvelles structures, et par exemple, comme dans le cas du coronavirus du SRAS, former des pores, qui conduisent à la lyse de la cellule[25].
Enveloppes virales symétriques

La partie interne des protéines d'enveloppe peut interagir avec la capside enveloppée de telle sorte qu'une seule protéine (ou un dimère ou trimère bien défini) ne se lie qu'à un seul capsomère. Cet arrangement fixe va transporter la forme et la symétrie d'une capside icosaédrique vers celles de l'extérieur de l'enveloppe virale, et malgré la mobilité de la membrane lipidique, on obtient des enveloppes virales de structure strictement icosaédrique[26]. Cette forme de morphogenèse de l'intérieur vers l'extérieur se retrouve dans le genre alphavirus de la famille des Togaviridae (par exemple le virus de la forêt de Semliki[27] et le virus de Sindbis) et du genre Flavivirus de la famille des Flaviviridae.
Chez les virus plus grands de la famille des Bunyaviridae (80 à 120 nm) on peut aussi démontrer l'ordre régulier des protéines d'enveloppe sous forme d'un icosaèdre (nombre de triangulation T = 12), mais il n'existe aucune capside de symétrie icosaédrique qui puisse soutenir cette symétrie de l'intérieur[28]. Dans ce cas, une interaction étroite entre les protéines d'enveloppe définit la forme de l'enveloppe virale, ce que l'on peut appeler morphogenèse de l'extérieur vers l'intérieur. Chez les bunyavirus, trois capsides en hélice sont enfermées dans l'enveloppe, ce qui permet comme dans le cas des virus de la grippe des échanges de segments d'ARN (réarrangement) et une grande flexibilité génétique. Cette flexibilité chez les virus de la grippe est obtenue au prix de la présence de plusieurs capsides, ou brins d'ARN, irrégulières groupées dans une enveloppe asymétrique et donc très instable, qui peut être inactivée par le dessèchement ou des détergents doux. Par contre, la disposition strictement symétrique des protéines d'enveloppe donne à la famille des bunyaviridae une stabilité relativement plus forte, si bien que par exemple dans le genre hantavirus, les virus restent infectieux même desséchés pendant des mois, et résistent même à la désintégration par l’urine, bien que l'urée agisse comme un détergent et inactive d'autres virus enveloppés.
Le nombre de triangulation des capsides icosaédriques


Pour une description plus précise d'une capside icosaédrique, Donald Caspar et Aaron Klug ont introduit un indice géométrique[29], appelé nombre de triangulation (T). Il caractérise la taille et la complexité d'une capside icosaédrique.
En arrangeant trois molécules identique d'une protéine quelconque, on peut former un triangle équilatéral – symétrique par rotation de 120°. Ceci est la plus petite unité possible symétrique pour former une capside icosaédrique. Comme un icosaèdre est formé de 20 triangles équilatéraux, il faut 3 × 20 = 60 molécules au moins pour faire l'icosaèdre le plus simple. Ce nombre minimal de 60 est désigné par le nombre de triangulation T = 1. De plus grandes capsides plus complexes ont des multiples entiers de 60 molécules, c'est-à-dire couramment 180 (T=3), 240 (T=4) ou 960 (T=16). Les nombres de triangulation géométriquement possibles sont donnés par la formule T = h² + hk + k² où h et k sont des nombres entiers.
Formes spéciales

Chez quelques familles de virus, il n'y a pas de double membrane lipidique externe, formant une structure externe, mais elle se trouve à l'intérieur du virion. Deux cas de familles sont particulièrement extraordinaires, ce sont des bactériophages, les Corticoviridae et les Tectiviridae, où la membrane lipidique se trouve à l'intérieur d'une capside icosaédrique. Cette structure n'est pas désignée sous le nom d'enveloppe virale, puisqu'elle ne se trouve pas à l'extérieur, et qu'elle ne remplit pas les tâches typiques d'une enveloppe virale, comme l'adhésion à la surface de la cellule. La petite bulle de membrane présente chez les Tectiviridae sert, après adhésion de la capside à la surface de la bactérie à une entrée active de l'ADN à double brin du bactériophage dans la cellule hôte à infecter.
Chez les représentants de la famille des Poxviridae, l'enveloppe virale consiste en une double membane externe et en plus une interne. Dans le cytosol, les virus de la variole se présentent avec une simple enveloppe. La première enveloppe n'a pas pour origine le bourgeonnement d'une membrane cellulaire, mais de la construction d'une membrane lipidique tout à fait nouvelle sur le côté externe de la capside encore pas mûre, et qui va devenir biconcave. Pour la reconstruction de la membrane, le virus utilise des éléments de membrane empruntés à la région de transition entre l'appareil de Golgi et le réticulum endoplasmique (compartiment intermédiaire)[30]. La particule virale déjà enveloppée une fois reçoit une deuxième membrane virale par bourgeonnement de la membrane de l’appareil de Golgi.
Apparition pendant la multiplication virale
La synthèse des protéines d'enveloppe et l'apparition de l'enveloppe virale marquent la dernière phase du cycle de multiplication d'un virus enveloppé ; auparavant, le génome viral doit être répliqué, et éventuellement empaqueté dans une capside[31].
Le processus d’enveloppement d'un virus, également nommé bourgeonnement (budding) correspond à un enveloppement spécifique dans une vésicule membranique qui se sépare. Au sein des cellules, la formation et la fusion de vésicules de membrane est un processus constant pour le transport de matières, ce que l'on appelle exocytose ou endocytose. Un virus enveloppé utilise ces propriétés et mécanismes déjà présents dans le flot membranaire, en le modifiant et le dirigeant par l’intermédiaire des protéines de structure virales. L'énergie nécessaire pour courber la membrane lipidique et la formation de vésicules provient exclusivement de l’interaction mutuelle des protéines de membrane, de celle des protéines de membrane avec les structures internes comme les protéines matricielles, et les capsides, ou des capsides avec la membrane lipidique ; un apport supplémentaire d'énergie par exemple sous forme d'ATP n’est pas nécessaire à ce stade. La disposition énergétiquement plus favorable des protéines d'enveloppe surmonte, par exemple chez les Togaviridae la courbure énergétiquement défavorable de la membrane lipidique au moyen de liaisons hydrogène, de liaisons ioniques et surtout par des interactions dues à leur hydrophobie. La création de l'enveloppe virale – quel que soit le système membranaire – est donc dirigé uniquement par la traduction génétique, le transport et la concentration des protéines d'enveloppe sur le compartiment de membrane approprié. Le bourgeonnement, organisation spontanée de capside, membrane lipidique et protéines d'enveloppes, présente un grand intérêt du point de vue thermodynamique. Beaucoup de modèles ont été faits pour le décrire, afin de pouvoir calculer les interactions des parties en présence[32]. En accord avec la durée mesurée in vitro du processus de bourgeonnement, il a pu être montré sur un modèle une durée de 10 à 20 min[33]. Les processus limitants ont été identifiés comme la diffusion des protéines d'enveloppe le long de la membrane lipidique, ainsi que l'expulsion de l'eau entre l’enveloppe et la capside. Les calculs de modèle font aussi attendre le bourgeonnement des virus aux endroits de la membrane cellulaire où existe déjà une courbure morphologique de la membrane lipidique. Ceci est en accord avec les examens en microscopie électronique de cellules infectées, où on peut voir les virus bourgeonner de façon prédominante sur les endroits déjà courbés de l’appareil de Golgi, ou de la membrane cellulaire.
Les mécanismes de l'enveloppement sont similaires en principe pour toutes les membranes de la cellule. Le premier modèle de bourgeonnement a été mis au point sur l’exemple du virus de la forêt de Semliki (Semliki-forest-virus ou SFV). Dans ce cas, la liaison de l'ancre intracellulaire des protéines d'enveloppe à une capside déjà fermée conduit à la courbure de la membrane lipidique[34]. On en a déduit la thèse que pour que l'enveloppe virale apparaisse, il fallait nécessairement la présence de protéines d'enveloppe et leur liaison aux protéines de la capside. Ce premier modèle a été substantiellement restreint, quand on a observé chez des rétrovirus un enveloppement des capsides aussi en l'absence de protéines d'enveloppe (protéines ENV), quand il y avait des protéines de capside (protéines GAG) dans les cultures transfectées[35].

À côté du cas particulier des protéines GAG des rétrovirus, il y a trois autres variantes importantes pour le bourgeonnement (voir figure). La voie la plus simple est une légère courbure de la membrane par interaction des protéines d'enveloppe au moyen de leurs domaine d'ancre. Une capside terminée se lie à ces protéines agrégées et poursuit le bourgeonnement par l'interaction avec les protéines d'enveloppe (figure, cas A). Dans un deuxième cas (B), la construction de la capside n'a lieu que par la liaison avec les protéines d'enveloppe. L'interaction entre protéines de capside et protéines d'enveloppe rend possible d'abord l'intégration de l'acide nucléique, puis la complétion du virus pendant la fin du bourgeonnement. Cette variante peut aussi être complétée par une protéine de matrice entre l'enveloppe et la capside. Chez les virus qui n'ont pas de capside symétrique (par exemple le virus de la diarrhée virale bovine et son cousin le virus de l'hépatite C), il suffit de liaisons entre l'acide nucléique et des protéines basiques (p. ex. nucléoprotéines), qui à leur tour interagissent avec les protéines d'enveloppe, à l'intérieur de la membrane, comme le feraient des protéines de matrice.
Dans la troisième variante (C), l'interaction des ancres intracellulaires des protéines d'enveloppe n'est possible que par l’intermédiaire de protéines de matrice. Quand cette interaction a commencé à produire une courbure de la membrane lipidique, alors une capside (comme dans le cas des virus de l'herpès), ou plusieurs capsides en hélice (comme chez les Orthomyxoviridae peuvent se lier et être enveloppées.
- Création d'une enveloppe virale par bourgeonnement : micrographies électroniques de cellules infectées
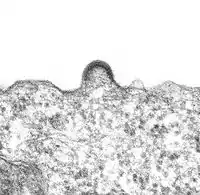 Agrégation de protéines d'enveloppe et courbure de la membrane cellulaire par HIV-1.
Agrégation de protéines d'enveloppe et courbure de la membrane cellulaire par HIV-1. Virus de Lassa en fin de détachement de l'enveloppe virale.
Virus de Lassa en fin de détachement de l'enveloppe virale. Herpèsvirus humain type 6 après libération de la membrane cellulaire.
Herpèsvirus humain type 6 après libération de la membrane cellulaire. Particules enveloppées du virus de la fièvre de la vallée du Rift (Bunyaviridae) dans la lumière du réticulum endoplasmique.
Particules enveloppées du virus de la fièvre de la vallée du Rift (Bunyaviridae) dans la lumière du réticulum endoplasmique.
Bourgeonnement à la membrane cellulaire

L'apparition de l’enveloppe virale à la membrane cellulaire demande d'abord le transport des protéines d'enveloppe à la surface de la cellule. Les protéines virales sont produites par les ribosomes du réticulum endoplasmique granuleux (REG), où les protéines d'enveloppe, encore en cours de synthèse, traversent la membrane du REG et y prennent leur place. Les protéines de membrane sont glycosylées par le système membraneux de l'appareil de Golgi. Une fois modifiées, à maturité, les protéines d'enveloppe sont transportées par des vésicules d'exocytose qui se détachent, sont transportées à la membrane, avec laquelle elles fusionnent. Le domaine de la protéine d'enveloppe qui se trouvait auparavant dans la lumière du REG se retrouve maintenant dirigé vers l'extérieur de la cellule. Les autres composants du virus (capside, acide nucléique et éventuellement protéines de matrice), peuvent maintenant être enveloppés[36]. La voie de formation par la membrane cellulaire présuppose l'arrivée de protéines d'enveloppe virales, ce qui peut conduire à la formation de syncytiums (voir supra). Ces protéines virales présentées vers l'extérieur peuvent être reconnues comme étrangères par les cellules de défense immunitaire, si bien qu'il peut y avoir une réponse immunitaire précoce contre les protéines d'enveloppe. Tous les virus dont les enveloppes dérivent de la membrane cellulaire s'introduisent dans les cellules pour les infecter par fusion de l'enveloppe avec la membrane cellulaire. Cette manière de pénétrer de l’extérieur par fusion (fusion from without) permet l'infection sans transport dans un endosome.
Des familles importantes de virus qui se distinguent par leur bourgeonnement à la membrane cellulaire sont par exemple les Retroviridae, Orthomyxoviridae, et Togaviridae, et toutes les familles de virus ayant un génome à ARN à simple brin de polarité négative (antisens) (ordre des Mononegavirales), c'est-à-dire les Bornaviridae, Rhabdoviridae, Filoviridae et Paramyxoviridae.
Bourgeonnement à la membrane du Golgi et du REG
Comme les protéines d'enveloppe commencent toujours par être implantées dans les membranes du système de membranes intracellulaires, il peut aussi s'y produire un bourgeonnement. Dans cette voie, la membrane choisie peut être celle du REG, ou – après un transport par vésicule – celle de l’appareil de Golgi. Ceci est déterminé de façon prédominante par les modifications éventuellement nécessaires des membranes d'enveloppe, qui ne peuvent souvent être accomplies que par les enzymes de l'appareil de Golgi. Très souvent, le bourgeonnement a lieu dans la région de passage des deux systèmes de membranes, ce que l'on appelle le compartiment intermédiaire. La particule de virus enveloppée se retrouve toujours après bourgeonnement dans la lumière du système membraneux, d'où elle est transportée au sein d'une vésicule de transport (exosome). Cet enveloppement intracellulaire des virus peut se produire sans destruction de la cellule, puisqu'aucune protéine virale n'apparaît à la surface cellulaire, et que le processus normal d'exocytose est utilisé pour l'excrétion des virus. Pour l’infection de la prochaine cellule-hôte, tous ces virus doivent être pris par un endosome, avec la membrane duquel l'enveloppe virale fusionne (fusion from within). Des familles importantes de virus avec bourgeonnement intracellulaire sont les Coronaviridae, Hepadnaviridae et Flaviviridae.
Bourgeonnement à la membrane nucléique
Les membres de la famille Herpesviridae sont un cas particulier en ce qui concerne leur construction, leur stratégie de multiplication et aussi dans la genèse de leur enveloppe virale, parce que les très grandes capsides des virus de l'herpès sont fabriquées dans le noyau cellulaire, où l'ADN à double brin des virus est synthétisé. Dès les premières investigations au microscope électronique sur les cellules où se multiplie le virus de l’herpès simplex, on a pu observer des capsides bourgeonnant vers la face interne de la membrane nucléaire et des particules enveloppées dans l'espace périnucléaire[37]. Comme cet espace périnucléaire est relié au REG par des tubes de membrane, on a supposé que les virions enveloppés étaient expulsés de la cellule par des vésicules membraneuses de l'appareil de Golgi. Un examen de la composition lipidique de l'enveloppe virale montra cependant que les composants lipidiques n'étaient pas ceux de la membrane nucléaire, mais ceux de la membrane de Golgi[38]. Cette constatation conduisit à la découverte que les virus de l'herpès reçoivent d'abord une enveloppe par bourgeonnement sur la membrane nucléaire, mais que celle-ci fusionne avec la membrane externe de l’espace périnucléaire, et la capside nue est relâchée dans le cytosol. Ce n'est qu'après un deuxième bourgeonnement sur une vésicule qui se détache de l’appareil de Golgi, qui est enrichi en protéines d'enveloppe et de matrice, que la capside reçoit son enveloppe définitive. C'est seulement cet enveloppement secondaire, comme on l’appelle, qui donne lieu à l'enveloppe définitive du virus relâché.
Enveloppes virales vides et virus défectueux
Chez certains virus, les protéines d'enveloppe sont en mesure de provoquer un bourgeonnement sans avoir de liaison avec une structure interne. Ceci est en particulier le cas quand l'interaction entre domaines ancres internes des protéines d'enveloppe est particulièrement élevée. Il en résulte des enveloppes virales vides ou incomplètement remplies. L'existence de ces enveloppes vides a été découverte pour la première fois dans des recherches sur l’antigène Australia, qui ont conduit à la découverte du virus de l'hépatite B (VHB) par B. Blumberg. L'antigène découvert consiste en trois protéines d'enveloppe de VHB (Antigène d'HB de surface ou AgHBs). Dans le sang de personnes infectées par le VHB, on trouve l'AgHBs surtout sous la forme de particules sphériques vides de diamètre 22 à 24 nm et des structures en forme de tube vide (Tubuli) de longueur variable (200 à 700 nm)[39]. On ne trouve un seul virus infectieux, complet, de 42 nm que pour 1 000 à 10 000 particules contenant l'AgHBs. Cette production énorme d'enveloppes virales vides sert en premier lieu à saturer les anticorps contre l'enveloppe virale, et empêcher ainsi qu'ils capturent des virus complets.
Les enveloppes vides, comme dans l’exemple de l'AgHBs, sont souvent plus petites que le virus complet, et se trouvent aussi dues à un enveloppement incorrect ou incomplet d'un génome segmenté (comme pour le virus de la grippe par exemple). Ces particules sont aussi désignées sous les appellations anglaises defective interfering particles (DIP) ou virus-like particles (VLP). Chez le virus de l'hépatite C, on a supposé l'existence de particules incomplètes dans le sérum sanguin car on a constaté que le rapport stœchiométrique entre les protéines basiques de capside et les acides nucléiques est variable[40].
Un exemple particulier d'enveloppe virale est fourni par le virus de l'hépatite D, qui ne possède par lui-même pas assez de gènes pour un jeu complet de protéines d'enveloppe. Il doit compter sur la présence de VHB dans la même cellule, car il ne peut être enveloppé et sécrété qu'avec les protéines du VHB. Il est pour cette raison nommé virus défectueux, sous-virus satellite ou viroïde[41].
Les capsides de virus enveloppés et nus
Dans les enveloppes virales à haut contenu lipidique, les protéines d'enveloppe sont arrangées de manière flexible et peuvent se déplacer de côté dans la membrane. Cette propriété liquide de l'enveloppe virale signifie qu'il y aura toujours enveloppement complet, même s'il y a une erreur d'arrangement des protéines d'enveloppe, ou un manque de symétrie de l’enveloppe. Ce genre d'erreur chez un virus nu conduirait à une protection incomplète de l’acide nucléique ou à la rupture de la capside. Sous l’abri d'une enveloppe, il y a une plus grande liberté de structure pour la capside comparée à celle des virus nus, car la capside n'est pas la protection immédiate du génome contre les nucléases ou le point d'attaque du système immunitaire. Les capsides des virus enveloppés peuvent donc montrer des défauts, ou même ne couvrir le génome qu'en réseau. Ceci est très important ches les rétrovirus et leurs voisins taxonomiques les hepadnavirus (p. ex. le virus de l’hépatite B)[42], car la capside non enveloppée mais déjà fermée peut absorber pendant la multiplication encore de l'ATP et des nucléotides, pour compléter le génome déjà encapsulé. Dans les capsides de certains virus enveloppés, les trous permettent une libération du génome par exemple aux pores nucléaires, sans que la capside doive au préalable se désintégrer dans le cytosol.
Importance biologique
L'enveloppe virale facteur pathogène
L'enveloppe virale, étant la structure externe, est responsable de toutes les propriétés du virion, en ce qui concerne les voies d'infection, la défense contre le système immunitaire et l'infection de la cellule. Dans ces combats avec l'organisme hôte, où l'enveloppe est au premier rang, se sont développés au cours de l'évolution des virus des mécanismes avantageux pour la multiplication du virus, ce que l'on désigne par virulence ou pathogénicité. Un de ces phénomènes est le camouflage moléculaire, c'est-à-dire l'imitation de protéines de l'hôte par des protéines d'enveloppe, si bien qu'elles ne sont plus reconnues comme étrangères par le système immunitaire, et elles peuvent même imiter certaines des fonctions de ces protéines.
Un exemple de ce camouflage immunologique est la similitude entre des parties de protéines d'enveloppe de certaines espèces de virus de la famille des Coronaviridae avec le fragment Fc de l’anticorps IgG[43]. La protéine d'enveloppe E2 du virus de l'hépatite C est structurellement semblable à une partie (fragment ab) de l'anticorps IgG[43]. À côté de ce genre de camouflage structurel, certaines liaisons entre les protéines de l'hôte et l'enveloppe virale peuvent être utilisées. C'est le cas dans la liaison spécifique de l'albumine à l'enveloppe du virus de l'hépatite B[44].
Outre la pure imitation de protéines de l'hôte, les protéines d'enveloppe peuvent imiter pour se camoufler les propriétés de liaison des protéines de l'hôte. Chez les rétrovirus du genre lentivirus, on a décrit la similitude des domaines externes de la protéine d'enveloppe gp41 avec l'interleukine 2 ; elles provoquent la liaison aux récepteurs de l'interleukine des cellules immunitaires cibles de ces virus[45].
La capacité des rétrovirus en culture cellulaire à induire un bourgeonnement, sans posséder de protéine d'enveloppe propre, est utilisée par la technique génétique pour produire des particules virales artificielles, dont on peut choisir les propriétés de surface. Par exemple, on peut introduire dans ces pseudotypes des protéines d'enveloppe étrangères, pour étudier par exemple leur liaison à certains récepteurs, ou pour les utiliser en recherche comme vecteurs viraux. La formation de ces pseudotypes semble liée aux radeaux lipidiques évoqués plus haut (voir supra)[46].
L'apparition de pseudotypes a aussi été décrite dans le cas d'infections naturelles. Par exemple, deux espèces de virus, pendant une infection commune d'une même cellule, peuvent monter dans une enveloppe nouvelle des protéines d'enveloppe des deux virus, ou bien un virus peut être complètement enveloppé dans l'enveloppe d'un autre virus. Ce phénomène d'apparition de pseudotypes est désigné comme un « mélange phénotypique » (Phenotypic mixing)[47].
Enveloppe virale et inactivation du virus
La perte de l’enveloppe virale, ou l'élimination des composantes lipidiques de l'enveloppe empêchent le virus enveloppé d'infecter la cellule hôte. Cette circonstance est utilisée pour inactiver les virus enveloppés, pour maîtriser la diffusion du virus. La composante la plus sensible de l'enveloppe virale, la membrane lipidique, peut être détruite par des alcools dissolvant les graisses, comme l'éthanol ou l'isopropanol[48]. Dans le cas d'une proportion élevée de lipides dans l’enveloppe virale, comme chez les virus de la grippe, les détergents doux ou le savon suffisent à diminuer l’infectiosité du virus. Pour inactiver de possibles virus comme le HIV, le HBV ou le HCV dans des produits sanguins pour la transfusion, une combinaison de solvants doux et de détergents est utilisée[49].
Origine des pandémies et nouveaux virus
La grande flexibilité immunologique des protéines d'enveloppe permet à certains virus enveloppés de se multiplier chez diverses espèces hôtes. C'est ainsi que des infections peuvent, en franchissant la barrière d'espèce, apparaître comme nouvelle, ou utiliser des hôtes intermédiaires comme contaminateurs. Les virus transmis par des arthropodes (comme p. ex. les moustiques ou les acariens), nommés arbovirus, sont pour cette raison pour la plupart des virus enveloppés. Le seul genre nu des Coltivirus, dont les membres peuvent être transmis comme des arbovirus, possèdent, en guise d'enveloppe virale, une deuxième capside. Les virus sont particulièrement pathogènes quand ils surviennent dans une nouvelle population hôte, où n'existe aucune immunité contre eux. C'est pourquoi les virus enveloppés, pour lesquels le passage de l'animal à l'homme est particulièrement facilité, possèdent un potentiel particulièrement élevé pour provoquer des infections nouvelles chez l'homme.
Bibliographie
Bibliographie actuelle
- (en) Joe Bentz, Viral Fusion Mechanisms., Boca Raton, CRC-Press, , 529 p. (ISBN 0-8493-5606-7)
- (en) Robert Brasseur, Molecular Description of Biological Membranes by Computer Aided Conformational Analysis., vol. 1, Boston, CRC-Press, , 352 p. (ISBN 0-8493-6375-6, lire en ligne)
- (en) S. J. Flint, L. W. Enquist, V. R. Racaniello et A. M. Skalka, Principles of Virology. : Molecular Biology, Pathogenesis, and Control of Animal Viruses., Washington, ASM-Press, , 2e éd. (ISBN 1-55581-259-7)
- (en) Stephen C. Harrison, « Principles of Virus Structure. », dans David M. Knipe, Peter M. Howley et al., Fields’ Virology, Philadelphia, (ISBN 0-7817-1832-5), p. 53–85page consultée le 10/1/2012
- (en) M. K. Jain et R. C. Wagner, Introduction to Biological Membranes, New York, Wiley, (ISBN 0-471-03471-1)
- (en) John A. T. Young, « Virus Entry and Uncoating. », dans David M. Knipe, Peter M. Howley et al., Fields’ Virology, Philadelphia, (ISBN 0-7817-1832-5)page consultée le 10/1/2012
Bibliographie historique
- (en) Frank Fenner, B. R. McAuslan et coll., The Biology of Animal Viruses., New York, London, Academic Press (réimpr. 1974) (1re éd. 1968) (ISBN 978-0-12-253040-1 et 0-12-253040-3)
- (en) Alena Lengerová, Membrane Antigens., Iéna,
- (de) Wolfhard Weidel, Virus – Die Geschichte vom geborgten Leben., Berlin, Göttingen, Heidelberg,
Liens web
- (en)« The lipid inner and outer composition of HIV particles. », PNAS, (consulté le )
- (en)« Reconstruction of an alphavirus (RRV) particle from cryo-EM analysis and image processing. » (consulté le )
Références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Virushülle » (voir la liste des auteurs).
- Pour un tableau général, voir : (de)Karlheinz Lüdtke, « Zur Geschichte der frühen Virusforschung », MPI für Wissenschaftsgeschichte, (consulté le )
- (en) W. Reed, « Recent researches concerning the etiology, propagation and prevention of yellow fever by the United States Army Commission. », J. Trop. Med., vol. 5, , p. 143–158
- (de) B. v. Borries, E. Ruska et H. Ruska, « Bakterien und Virus in übermikroskopischer Aufnahme. », Klin. Wochenschrift, vol. 17, , p. 921–925 (lire en ligne)
- (de) H. Ruska, « Versuch zu einer Ordnung der Virusarten. », Arch. ges. Virusforsch., vol. 2, , p. 480–498
- (en) E. W. Goodpasture, A. M. Woodruff et G. J. Buddingh, « Vaccinal infection of the chorio-allantoic membrane of the chick embryo. », Amer. J. Pathol., vol. 8, , p. 271 (PMID 16560579)
- (en) W. I. B. Beverige et F. M. Burnet, « The cultivation of viruses and rickettsiae in the chick embryo. », Med. Res. Council Spec. Rept., vol. 256,
- (en) W. B. Dunham et W. J. Macneal, « Culture on the Chick Chorio-allantois as a Test of Inactivation of Vaccinia Virus. », J. Bacteriology, vol. 44, no 4, , p. 413–424 (PMID 16560579, lire en ligne)
- (en) M. Uhler et S. Gard, « Lipid content of standard and incomplete influenza A virus. », Nature, vol. 173, no 4413, , p. 1041–1042 (ISSN 0028-0836 et 1476-4687)
- (en) E. Gorter et F. Grendel, « On bimolecular layers of lipoid on the chromocytes of the blood. », J. Exp. Med., vol. 41, no 4, , p. 439–443 (ISSN 0022-1007 et 1540-9538, lire en ligne)
- (en) L. H. Frommhagen, N. K. N. K. Freeman et N. K. Freeman, C. A. Knight, « The lipid constituents of influenza virus, chick allantoic membrane and sedimentable allantoic protein. », Virology, vol. 5, no 1, , p. 173–175 (PMID 13519759)
- (en) Lewis L. Coriell, Geoffrey Rake, Harvey Blank et T. F. McNair Scott, « Electron microscopy of herpes simplex. », J Bacteriol., vol. 59, no 1, , p. 61–68 (ISSN 0021-9193 et 1098-5530, PMID 15400321, lire en ligne)
- (en) S. Brenner et R. W. Horne, « A negative staining method for high resolution electron microscopy of viruses. », Biochim. Biophys. Acta, vol. 34, , p. 103–110 (ISSN 0006-3002, PMID 13804200)
- (en) S. J. Singer et G. L. Nicholson, « The fluid mosaic model of the structure of cell membranes », Science, vol. 175, no 4023, , p. 720–731 (ISSN 0036-8075 et 1095-9203, PMID 4333397, résumé)
- (en) J. W. Corran et W. C. Lewis, « Lecithin and Cholesterol in Relation to the Physical Nature of Cell Membranes. », Biochem J., vol. 18, no 6, , p. 1364–1370 (PMID 16743417, lire en ligne)
- (en) R. P. Rand et V. Luzzati, « X-ray diffraction study in water of lipids extracted from human erythrocytes: the position of cholesterol in the lipid lamellae. », Biophys. J., vol. 8, no 1, , p. 125–137 (PMID 5641398, lire en ligne)
- (en) Jason P. Laliberte, Lori W. McGinnes, Mark E. Peeples et Trudy G. Morrison, « Integrity of membrane lipid rafts is necessary for the ordered assembly and release of infectious Newcastle disease virus particles. », J. Virol., vol. 80, no 21, , p. 10652–10662 (ISSN 0022-538X, PMID 17041223, lire en ligne)
- (en) Heidi Imhoff, Veronika von Messling, Georg Herrler et Ludwig Haas, « Canine distemper virus infection requires cholesterol in the viral envelope. », J. Virol., vol. 81, no 8, , p. 4158–4165 (ISSN 0022-538X, PMID 17267508, lire en ligne)
- (en) S. Hambleton, S. P. Steinberg, M. D. Gershon et A. A. Gershon, « Cholesterol dependence of varicella-zoster virion entry into target cells. », J. Virol., vol. 81, no 14, , p. 7548–7558 (ISSN 0022-538X, PMID 17494071, lire en ligne)
- Composition molaire recalculée à partir de : (en) R. C. Aloia, F. C. Jensen, C. C. Curtain, P. W. Mobley et L. M. Gordon, « Lipid composition and fluidity of the human immunodeficiency virus. », PNAS, vol. 85, no 3, , p. 900–904 (ISSN 0027-8424 et 1091-6490, PMID 2829209, lire en ligne)
- Calculé à partir des tables 1 et 4 de : (en) O. Satoh, H. Imai, T. Yoneyama, T. Miyamura, H. Utsumi, K. Inoue et M. Umeda, « Membrane structure of the hepatitis B virus surface antigen particle. », J. Biochemistry Tokyo, vol. 127, no 4, , p. 543–550 (PMID 10739944, résumé)
- (en) G. van Meer et K. Simons, « Viruses budding from either the apical or the basolateral plasma membrane domain of MDCK cells have unique phospholipid compositions. », EMBO J., vol. 1, no 7, , p. 847–852 (ISSN 0261-4189 et 1460-2075, PMID 6329709, lire en ligne)
- (en) Nathalie Chazal et Denis Gerlier, « Virus Entry, Assembly, Budding, and Membrane Rafts (Article de revue). », Microbiol. Mol. Biol. Rev., vol. 67, no 2, , p. 226–237 (PMID 12794191, lire en ligne)
- (en) Birke Andrea Tews et Gregor Meyers, « The pestivirus glycoprotein Erns is anchored in plane in the membrane via an amphipathic helix. », J. Biol. Chem., Epub (11/9/2007), vol. 282, no 45, , p. 32730-41 (ISSN 0021-9258 et 1083-351X, PMID 17848558, lire en ligne)
- (en) B. Rentier, E. L. Hooghe-Peters et M. Dubois-Dalcq, « Electron microscopic study of measles virus infection: cell fusion and hemadsorption. », J. Virol., vol. 28, no 2, , p. 567–577 (ISSN 0022-538X, PMID 722861, lire en ligne)
- (en) J. Torres, K. Parthasarathy, X. Lin, R. Saravanan, A. Kukol et D. X. Liu, « Model of a putative pore: the pentameric alpha-helical bundle of SARS coronavirus E protein in lipid bilayers. », Biophys. J., vol. 91, no 3, , p. 938–947 (PMID 16698774, lire en ligne)
- (en) R. H. Cheng, R. J. Kuhn, N. H. Olson, M. G. Rossmann, H. K. Choi, T. J. Smith et T. S. Baker, « Nucleocapsid and glycoprotein organization in an enveloped virus. », Cell, vol. 80, no 4, , p. 621–630 (ISSN 0092-8674, PMID 7867069)
- (en) R. H. Vogel, S. W. Provencher, C. H. von Bonsdorff, M. Adrian et J. Dubochet, « Envelope structure of Semliki Forest virus reconstructed from cryo-electron micrographs. », Nature, vol. 320, no 6062, , p. 533–535 (ISSN 0028-0836 et 1476-4687, PMID 3960136, résumé)
- (en) Carl-Henrik von Bonsdorff et Ralf Pettersson, « Surface structure of Uukuniemi virus. », J. Virol., vol. 16, no 5, , p. 1296–1307 (ISSN 0022-538X, PMID 52726, lire en ligne)
- (en) Donald L. D. Caspar, Aaron Klug, « Physical Principles in the Construction of Regular Viruses. », dans Cold Spring Harbor Symposia on Quantitative Biology, XXVII, New York, Cold Spring Harbor Laboratory, , p. 1-24page consultée le 10/1/2012
- (en) Cristina Risco, Juan R. Rodríguez, Carmen López-Iglesias, José L. Carrascosa, Mariano Esteban et Dolores Rodríguez, « Endoplasmic reticulum-Golgi intermediate compartment membranes and vimentin filaments participate in vaccinia virus assembly. », J. Virol., vol. 76(): S., no 4, , p. 1839–1855 (ISSN 0022-538X, PMID 11799179, lire en ligne)
- Pour une revue de la maturation et du bourgeonnement des virus, consulter : (en) Henrik Garoff, Roger Hewson et Dirk-Jan E. Opstelten, « Virus maturation by budding. », Microbiol. Mol. Biol. Rev., vol. 62, , p. 1171–1190 (PMID 9841669, lire en ligne)
- (en) Shelly Tzlil, Markus Deserno, William M. Gelbart and et Avinoam Ben-Shaul, « A statistical-thermodynamic model of viral budding. », Biophys. J., vol. 86, no 4, , p. 2037–2048 (PMID 15041646, lire en ligne)
- (en) D. M. Lerner, J. M. Deutsch et G. F. Oster, « How does a virus bud? », Biophys J., vol. 65, no 1, , p. 73–79 (PMID 8369463, lire en ligne)
- (en) Henrik Garoff et Kai Simons, « Location of the spike glycoproteins in the Semliki Forest virus membrane. », PNAS, vol. 71, no 10, , p. 3988–3992 (ISSN 0027-8424 et 1091-6490, PMID 4530279, lire en ligne)
- (en) M. Delchambre, D. Gheysen, D. Thines, C. Thiriart, E. Jacobs, E. Verdin, M. Horth, A. Burny et F. Bex, « The GAG precursor of simian immunodeficiency virus assembles into virus-like particles. », EMBO J., Nature Publishing Group, vol. 8(): S., no 9, , p. 2653–2660 (ISSN 0261-4189 et 1460-2075, PMID 2684654, lire en ligne)
- (en) T. L. Cadd, U. Skoging et P. Liljeström, « Budding of enveloped viruses from the plasma membrane. », BioEssays, vol. 19, no 11, , p. 993–1000 (PMID 9394621, résumé)
- (de) D. Falke, R. Siegert et W. Vogell, « Elektronenmikroskopische Befunde zur Frage der Doppelmembranbildung des Herpes-simplex-Virus. », Arch Gesamte Virusforschung, vol. 9, , p. 484–496 (PMID 13821428)
- (en) Ida L. van Genderen, Renato Brandimarti, Maria R. Torrisi, Gabriella Campadelli et Gerrit van Meer, « The phospholipid composition of extracellular herpes simplex virions differs from that of host cell nuclei. », Virology, vol. 200, no 2, , p. 831-836 (PMID 8178468)
- (en) L. M. Stannard, J. Moodie, G. A. Keen et A. Kipps, « Electron microscopic study of the distribution of the Australia antigen in individual sera of 50 serologically positive blood donors and two patients with serum hepatitis. », J. Clin. Pathol., vol. 26(): S., no 3, , p. 209-216 (PMID 4700502)
- (en) Christian G. Schüttler, Christine Thomas, Thomas Discher, Georg Friese, Jürgen Lohmeyer, Ralph Schuster, Stephan Schaefer et Wolfram H. Gerlich, « Variable ratio of hepatitis C virus RNA to viral core antigen in patient sera. », J. Clin. Microbiol., vol. 42, no 5, , p. 1977-1981 (PMID 15131157, lire en ligne)
- (en) F. Bonino,, K. H. Heermann,, M. Rizzetto, et W. H. Gerlich, « Hepatitis delta virus: protein composition of delta antigen and its hepatitis B virus-derived envelope. », J Virol., vol. 58, no 3, , p. 945-950 (ISSN 0022-538X, PMID 3701932)
- (en) R. A. Crowther, N. A. Kiselev, B. Böttcher, J. A. Berriman, G. P. Borisova, V. Ose et P. Pumpens, « Three-dimensional structure of hepatitis B virus core particles determined by electron cryomicroscopy. », Cell, vol. 77, no 6, , p. 943–950 (ISSN 0092-8674, PMID 8004680, résumé)
- (en) E. L. Oleszak, J. Kuzmak, B. Hogue, R. Parr, E. W. Collisson, L. S. Rodkey et J. L. Leibowitz, « Molecular mimicry between Fc receptor and S peplomer protein of mouse hepatitis virus, bovine corona virus, and transmissible gastroenteritis virus. », Hybridoma, vol. 14(): S., no 1, , p. 1-8 (PMID 7768529, résumé)
- (en) J. A. Quiroga, I. Mora, V. Carreño, M. I. Herrera, J. C. Porres et W. H. Gerlich, « Inhibition of albumin binding to hepatitis B virions by monoclonal antibody to the preS2 domain of the viral envelope. », Digestion, vol. 38(): S., no 4, , p. 212−220 (PMID 2452108, résumé)
- (en) P. F. Serres, « Molecular mimicry between the trimeric ectodomain of the transmembrane protein of immunosuppressive lentiviruses (HIV-SIV-FIV) and interleukin 2. », C R Acad. Sci. III, vol. 323, no 11, , p. 1019–1029 (ISSN 0001-4036, PMID 11144025, résumé)
- (en) John A. G. Briggs, Thomas Wilk et Stephen D. Fuller, « Do lipid rafts mediate virus assembly and pseudotyping? (Article de revue) », J. General Virology, vol. 84(Pt 4): S. 757–768, (PMID 12655075, DOI 10.1099/vir.0.18779-0, lire en ligne)
- (en) J. Dragúnová, O. Kozuch et M. Gresíková, « Phenotypic mixing between vesicular stomatitis and Uukuniemi viruses. », Acta Virol., vol. 30(): S., no 6, , p. 512–514 (PMID 2881472, résumé)
- (en) W. R. Moorer, « Antiviral activity of alcohol for surface disinfection. (Article de revue) », Int. J. Dent. Hyg., vol. 1(): S., no 3, , p. 138-142 (PMID 16451513, résumé)
- (en) B. Horowitz, A. M. Prince, M. S. Horowitz et C. Watklevicz, « Viral safety of solvent-detergent treated blood products. (Article de revue) », Dev. Biol. Stand., vol. 81, , p. 147-161 (PMID 8174797, résumé) (Résumé tronqué à 400 mots)
Note
- Membranes cellulaires : MC : membrane cellulaire ; RER : réticulum endoplasmique rugueux ; REL : réticulum endoplasmique lisse ; AG : appareil de Golgi. Enveloppes virales : HIV-1 : Virus de l'immunodéficience humaine et SVHB, particule antigénique sphérique du virus de l’hépatite B. Les fractions lipidiques sont exprimées en pourcentage molaire lipidique de cellules de foie de rats. Données de Jain et Wagner 1980. SER contient en outre 2 % de cardiolipine
Voir aussi
- Portail de la virologie
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine