Oxyde de strontium
L'oxyde de strontium ou strontiane, de formule brute SrO, se forme quand du strontium brûle dans de l'oxygène. Dans l'air, la même réaction forme un mélange de l'oxyde et du nitrure de strontium, Sr3N2. La stontiane peut être aussi formée par la décomposition du carbonate de strontium, SrCO3 à la chaleur. C'est un oxyde fortement basique.
| Oxyde de strontium | ||

| ||
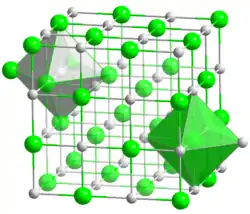 | ||
| poudre d'oxyde de strontium (en haut) et structure (en bas, __ Sr2+ __ O2−) | ||
| Identification | ||
|---|---|---|
| Nom UICPA | oxyde de strontium | |
| Synonymes |
strontia, strontiane |
|
| No CAS | ||
| No ECHA | 100.013.837 | |
| No CE | 215-219-9 | |
| PubChem | 73975 | |
| SMILES | ||
| InChI | ||
| Apparence | solide incolore ou blanc[1]. | |
| Propriétés chimiques | ||
| Formule | SrO | |
| Masse molaire[2] | 103,62 ± 0,01 g/mol O 15,44 %, Sr 84,56 %, |
|
| Moment dipolaire | D | |
| Diamètre moléculaire | nm | |
| Propriétés physiques | ||
| T° fusion | 2 460 °C[3] | |
| T° ébullition | 3 200 °C (décomp.)[3] | |
| Solubilité | g/l réagit avec l'eau[3] | |
| Masse volumique | 4,7 g/cm3 à 25 °C[4] 5,0 g/cm3[5] |
|
| Cristallographie | ||
| Système cristallin | cubique | |
| Classe cristalline ou groupe d’espace | (no 225) |
|
| Structure type | Sr[6], O[6] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,8710[6] | |
| Précautions | ||
| SGH[4],[3] | ||
 |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Synthèse
L'oxyde de strontium peut être obtenu à partir du carbonate de strontium, qui se trouve dans la nature comme le minéral strontianite. À 1 268 °C sous pression atmosphérique normale, le carbonate de strontium se décompose en oxyde de strontium et dioxyde de carbone :
Propriété
L'oxyde de strontium cristallise dans la structure du chlorure de sodium. À des pressions élevées de plus de 36 GPa, une transformation de phase dans la structure du chlorure de césium est observée. Celle-ci s'accompagne d'une réduction de volume de 13 %, la masse volumique du cristal augmente alors à plus de 7,1 g/cm3[5].
L'oxyde de strontium réagit vivement avec l'eau pour donner de l'hydroxyde de strontium,
Avec de la poudre d'aluminium et sous vide, l'oxyde de strontium peut être réduit en strontium (aluminothermie):
Utilisation
Environ 8 % en masse des tubes cathodiques sont de l'oxyde de strontium ce qui a été l'utilisation principale de la strontiane depuis 1970[7]. Les télévisions couleur et autres appareils contenant des tubes cathodiques couleur, en particulier ceux vendus aux États-Unis, sont obligés légalement d'utiliser l'oxyde de strontium dans la face avant pour bloquer les émissions de rayons X (ces téléviseurs à émission de rayons X ne sont plus en production). L'oxyde de plomb(II) peut être utilisé dans le cou et l'entonnoir, mais provoque une décoloration lorsqu'il est utilisé dans la plaque avant[8].
Auparavant, l'oxyde de strontium a été utilisé dans la production de sucre (saccharose) à partir de betterave sucrière (méthode strontienne)[9],[10].
L'oxyde de strontium forme également par réaction avec de l'alumine des aluminates de strontium qui ont encore d'autres applications.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Strontium oxide » (voir la liste des auteurs) et en allemand « Strontiumoxid » (voir la liste des auteurs)..
- David R. Lide, Handbook of Chemistry and Physics, 87e éd.,1998, Boca Raton, FL: CRC Press. pp. 4–87. (ISBN 0-8493-0594-2)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Strontium oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 juillet 2016 (JavaScript nécessaire).
- Strontium oxide (mono) sur mpbio.com + clic sur le bouton 'See More'
- Yosiko Sato, Raymond Jeanloz, Phase Transition in SrO, Journal of Geophysical Research, 1981, vol. 86, pp. 11773–11778. DOI:10.1029/JB086iB12p11773.
- David R. Lide, CRC Handbook of Chemistry and Physics, 90e éd. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, pp. 10-248.
- Joyce A. Ober, Désirée E. Polyak, "Mineral Yearbook 2007:Strontium" (pdf), United States Geological Survey, consulté le 14 octobre 2009.
- F. Méar, P. Yot, M. Cambon, M. Ribes, The characterization of waste cathode-ray tube glass., Waste management, 2006, vol. 26(12), pp. 1468–1476. (ISSN 0956-053X), , DOI:10.1016/j.wasman.2005.11.017.
- (de) H. Ost, Lehrbuch der Technischen Chemie, Verlag von Robert Oppenheim, Berlin, 1890, p. 369ff.
- Stephen G. Hibbins, Kirk-Othmer encyclopedia of chemical technology 4e éd. : Strontium and Strontium Compounds, vol. 22, John Wiley & Sons.
- Portail de la chimie
- Portail des sciences des matériaux