Liaison carbone-oxygène
Une liaison carbone-oxygène est une liaison covalente entre un atome de carbone et un atome d'oxygène, l'une des liaisons les plus abondantes — avec la liaison carbone-hydrogène et la liaison carbone-carbone — en chimie organique et en biochimie[1].
Une liaison C-O est fortement polarisée vers l'atome d'oxygène, son électronégativité étant de 3,44 contre 2,55 pour le carbone. La longueur de liaison C-O dans les dérivés d'alcanes est d'environ 143 pm, c'est-à-dire légèrement moins qu'une liaison C-N ou une liaison C-C. On trouve des liaisons plus courtes dans les acides carboxyliques (136 pm) à cause du caractère partiel de double liaison, et des liaisons plus longues dans les époxydes (147 pm)[2]. L'énergie de liaison est également plus forte pour la liaison C-O que pour les liaisons C-N et C-C. Elle est par exemple de 91 kcal/mol (à 298 K) dans le méthanol, contre 87 kcal/mol dans la méthylamine, et 88 kcal/mol pour l'éthane.
Le carbone et l'oxygène forment également des liaisons doubles dans des groupes fonctionnels appelés carbonyles (aldéhydes, cétones) et carboxyles (acides carboxyliques, esters carboxyliques, etc.), dans les cations oxonium (principalement des intermédiaires réactionnels), mais aussi des composés inorganiques, les oxydes de carbone. Dans les furanes, l'atome d'oxygène contribue au système π délocalisé via son orbitale p pleine et rend donc ceux-ci aromatiques. Les liaisons doubles C-O des groupes carbonyle ont une longueur d'environ 123 pm. Dans les halogénures d'acyle, ces liaisons ont un caractère de liaison triple partiel et sont donc plus courtes, environ 117 pm. Seul le monoxyde de carbone possède une liaison triple C-O formelle, très courte (112,8 pm) et très forte, plus forte par exemple qu'une liaison triple N–N[3].
Si la plupart du temps l'oxygène est divalent, il peut, plus rarement, être trivalent comme dans le tétrafluoroborate de triéthyloxonium.
Synthèse
On peut citer parmi les réactions importantes formant une liaison C-O, la synthèse de Williamson (éther), la substitution nucléophile d'acyle et l'addition électrophile sur les alcènes. La réaction de Paternò-Büchi est l'équivalent carbonylique de la métathèse des alcènes.
Exemples de groupes fonctionnels comportant un oxygène
La liaison carbone-oxygène est présente dans les groupes fonctionnels suivants :
| Famille chimique | Ordre de liaison | Formule | Représentation topologique | Exemple |
|---|---|---|---|---|
| Alcool | 1 | R3C–OH | -skeletal.png.webp) |
éthanol |
| Éther-oxyde | 1 | R3C–O–CR3 | .png.webp) |
éther diéthylique |
| Peroxyde | 1 | R3C–O–O–CR3 |  |
peroxyde de di-tert-butyle |
| Ester | 1 | R3C–CO–O–CR3 |  |
acrylate d'éthyle |
| Ester de carbonate | 1 | R3C–O–CO–O–CR3 |  |
 carbonate d'éthylène |
| Cétone | 2 | R3C–CO–CR3 |  |
acétone |
| Aldéhyde | 2 | R3C–CHO | 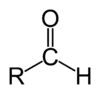 |
 acroléine |
| Furane | 1,5 |  |
 furfural | |
| Sel de pyrylium | 1,5 |  |
 anthocyane | |
Notes et références
- Organic Chemistry, John McMurry, 2e éd.
- CRC Handbook of Chemistry and Physics, 65e éd.
- (en) Standard Bond Energies, Department of Chemistry, Michigan State University.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon–oxygen bond » (voir la liste des auteurs).
Voir aussi
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | * | CLu | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn |
| Fr | CRa | * * |
Lr | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | ||||
| * * |
Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, mais pas d'usage courant | Liaison inconnue / non évaluée |
- Portail de la chimie