Stomate
Un stomate est un orifice de petite taille présent dans l'épiderme des organes aériens des Embryophytes (sur la face inférieure des feuilles le plus souvent). Il permet les échanges gazeux entre la plante et l'air ambiant (dioxygène, dioxyde de carbone, vapeur d'eau...) ainsi que la régulation de l'évapotranspiration et de la pression osmotique.




Sur la feuille, on parle de « face adaxiale » pour celle dont la cuticule présente peu de stomates, et de « face abaxiale » pour celle qui présente de nombreux stomates[1].
Origine
L'apparition des stomates est une conséquence de la vie terrestre, la sortie du milieu marin imposant un contrôle des déperditions hydriques de l'organisme. Celui-ci se protège par la cuticule (couche cireuse), étanche à certains échanges gazeux (ex : blocage de la vapeur d'eau, mais pas du fluorure d'hydrogène qui peut passer par les stomates, mais aussi, lorsque ces derniers sont fermés, lentement migrer au travers de la couche cireuse via des composants lipidiques[1].
Localisation
Les stomates se trouvent principalement sur les feuilles où ils peuvent être très nombreux, de 50 à 500 /mm2. Pour une même espèce, leur nombre dépend notamment des conditions de lumière subies par la jeune feuille. Lorsque les stomates sont totalement ouverts, la surface cumulée des ostioles représente de l'ordre de 2 % de la surface foliaire[2].
Chez la plupart des plantes dicotylédones, les feuilles sont hypostomatiques : il y a davantage de stomates sur la face inférieure (ou face abaxiale) que sur la face supérieure des feuilles (ou face adaxiale), celles-ci ayant une position horizontale ou subhorizontale. En raison de cette position stratégique, les stomates présents sur la face inférieure moins éclairée sont protégés du soleil et abrités des vents desséchants, ce qui permet de réduire la perte d'eau par transpiration[3]. Les monocotylédones sont différentes, puisque leurs feuilles sont orthotropes (tenues verticalement), si bien qu'elles sont généralement amphistomatiques (même nombre de stomates sur les deux épidermes). Ils sont beaucoup moins nombreux chez les espèces xérophytes, et sont alors souvent enfoncés dans l'épiderme au fond de sillons.
Si la plante a les feuilles flottantes, comme le nénuphar par exemple, il n'y aura aucun stomate sur l'épiderme inférieur comme il peut absorber des gaz directement de l'eau par la cuticule. Dans le cas d'une feuille submergée, aucun stomate ne sera présent.
Nombre de stomates et densité
Ce nombre varie considérablement chez une même espèce, selon les feuilles ou les parties de la feuille (densité généralement plus élevée au centre de la feuille), etc.
Au sein d'une même espèce il peut aussi varier selon le contexte édaphique ou climatique ; ainsi en zone tropicales, les Citrus ont fréquemment plus de 500 stomates par mm2, ce qui est moins fréquent en climat méditerranéen[4].
Le nombre et la densité ne sont d'ailleurs pas les seuls indicateurs à prendre en compte pour évaluer les échanges gazeux possibles, car beaucoup de très petits stomates peuvent permettre un même flux d'échanges gazeux qu'un nombre moins élevé de stomates plus grands. À titre d'exemple la surface moyenne d'un stomate était évaluée à 17,0 microns/mm2 de feuille pour le citronnier Eureka ; 13,2 pour le pomélo Marsh, 26,6 pour l'oranger Valencia et 8,7 pour l'oranger Washington Navel[5].
Le nombre moyen de stomates par unité de surface (densité) varie aussi selon l'espèce ; à titre d'exemple, en moyenne, on en trouve environ 8000/cm2 sur la feuille d'ananas et deux fois moins (4000/cm2) chez le bananier[5].
Chez des espèces proches de Citrus le nombre de stomates du citronnier et du mandarinier sont comparables (environ 580 stomates par mm2) mais l'oranger en possède nettement moins (460/mm2 chez l'oranger Berna ou Washington Navel tels qu'observés par Turell en 1947[6]).
Les aiguilles du pin Pinus radiata, qui n'ont qu'une fine cuticule, plus fine que celle du pin d'Alep par exemple, obturent très rapidement leurs stomates par temps chaud et sec, alors que le pin d'Alep et Pinus pinea sont plus lents et continuent à transpirer. Le nombre de stomates par cm2 est nettement plus faible chez les individus méditerranéens (2500 à 3000 chez P. halepensis, 3500 à 5000 chez P. Pinea, 6000 à 8000 chez P. radiata)[7].
Remarque : la densité de stomates, au sein d'une même espèce, variété ou essence peut aussi permettre de distinguer au sein de clones divers niveaux de ploïdie.
Description
Un stomate est constitué de deux cellules stomatiques, dites cellules de garde, réniformes (en forme de rein), qui délimitent l'orifice stomatique dit ostiole. Celui-ci s'ouvre plus ou moins, selon les besoins, en fonction de la turgescence des cellules stomatiques. Sous l'ostiole se trouve un espace vide appelé chambre sous-stomatique, siège des échanges gazeux via un parenchyme (parenchyme lacuneux).
Selon la disposition des stomates
Certaines plantes ont des feuilles sans stomate : la feuille est dite astomatique (ex : plantes aquatiques tels que le Potamot).
Lorsque les stomates sont disposés sur[8] :
- la face abaxiale (face dite inférieure, ou dorsale) de la feuille, la disposition (ou la feuille) est dite hypostomatique ou hypostomatée
- la face adaxiale (face dite supérieure, ou ventrale) de la feuille, la disposition (ou la feuille) est dite épistomatique ou épistomatée (plantes aquatiques comme Nymphea alba)
- les deux faces de la feuille, la disposition (ou la feuille) est dite amphistomatique ou amphistomatée (ex : monocotylédones, plantes succulentes)
Selon les cellules de garde
| Type de stomates[9] | Exemples[10] |
|---|---|
| anomocytique : les cellules de garde sont entourées par des cellules épidermiques sans morphologie particulière. | Renonculacées, Gérianacées, Cucurbitacées, Malvacées |
| anisocytique : les trois cellules annexes entourant les cellules de garde sont de tailles différentes | Brassicacées, Nicotiana, Solanum |
| paracytique : les deux cellules annexes sont parallèles aux cellules de garde | Rubiacées, Magnoliacées, Convolvulacées |
| diacytique : les cellules de garde sont entourées par deux cellules annexes perpendiculaires aux cellules de garde | Caryophyllacées |
| cyclocytique : les cellules annexes forment un anneau autour des cellules de garde | Bignonia unguis-cati, Pyrostegia |
Rôle et fonctionnement

1 Cellule épidermique
2 Cellule de garde
3 Ostiole
4 Ions K+
5 Eau
6 Vacuole
Rôles
- Contrôle des échanges de gaz avec leur milieu.
L'air contenant le dioxyde de carbone et le dioxygène entre par l'ouverture du stomate, l'ostiole, pour être utilisé dans la photosynthèse et la respiration. C'est via les stomates que 90-95 % des pertes en eau se font, par évapotranspiration au niveau des feuilles[11].
- optimisation de la photosynthèse
Les plantes de sous-bois et de forêts qui présentent généralement un indice foliaire élevé, donc un ombrage mutuel des feuilles très important, ont un feuillage qui forme un couvert discontinu, avec des trouées et des taches de soleil (en), qui est hétérogène parce que l'éclairement n'est pas uniforme sur tous les plans horizontaux. Elles sont certainement adaptées à l'utilisation optimale des taches de soleil par l'ouverture différentielle des stomates[12].
- Contribution à l'aspiration de la sève vers le haut
Une quantité significative de vapeur d'eau est dégagée dans l'atmosphère par ces pores (évapotranspiration). Ce dégagement d'eau provoque une tension sur la colonne d'eau dans du xylème jusqu'aux feuilles. Cette tension est le principal moteur faisant monter la sève brute jusqu'en haut de l'arbre.
- Contribution à la détoxication de la plante
Le jour, les stomates permettent l'évacuation des excès d'oxygène, gaz qui est un déchet métabolique issu de la photosynthèse dans les cellules du chlorenchyme (cellules du parenchyme contenant des chloroplastes).
L'ozone troposphérique est un polluant rapidement phytotoxique[13]. Il pénètre passivement les feuilles via les stomates puis se solubilise dans l'apoplaste où il crée des radicaux libres oxygénés (ROS) source de stress oxydatif[13]. Le contrôle de la conductance stomatique et un mécanisme de détoxication des ROS par des antioxidants permettent conjointement de limiter l'entrée d'ozone et de limiter les dégâts pour la plante[13]. On a montré que pour une concentration d'ozone égale 120 ppb, ces deux moyens de défense existent aussi chez les arbres (démontré en chambres phytotroniques pour trois génotypes de peuplier euraméricain). La fermeture des stomates implique cependant une diminution de la photosynthèse. Certaines plantes (tabac par exemple) se montrent plus sensibles que d'autres à l'ozone qui est un polluant d'autant plus présent que le temps est ensoleillé, facteur qui, via des photorécepteurs tels que les phytochromes (cryptochromes notamment), favorise l'ouverture des stomates[13].
Fonctionnement
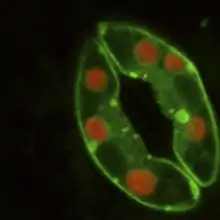
Les protoplastes des cellules de garde sont activés par la lumière bleue[14]
Dans de bonnes conditions hydriques, les deux cellules stomatiques absorbent l'eau, se courbent, et tel un ballon trop gonflé, permettent l'ouverture de l'ostiole et les échanges.
Ces cellules sont caractérisées par une paroi extérieure, opposée à l'ostiole, mince et une paroi interne caractérisée d'un épaississement cellulosique. De plus elles possèdent un réseau de microfibrilles de cellulose à orientation radiale. Lorsque les cellules de garde sont turgescentes, la paroi extérieure plus mince et plus souple se dilate plus que la paroi interne plus épaisse et plus rigide. Les cellules s'incurvent et l'ostiole s'ouvre[15].
Hugo von Mohl avait postulé en constatant la présence de chloroplastes sur les cellules stomatiques (ou cellules de garde) que le mécanisme d'ouverture de l'ostiole repose sur l'augmentation du volume des cellules de garde par des phénomènes d'osmose. En effet, l'énergie produite par les chloroplastes permettrait de jouer sur le caractère hypotonique ou hypertonique par la transformation de l'amidon en glucose ou de glucose en amidon, molécules qui n'ont pas les mêmes caractéristiques osmotiques.
En réalité certaines cellules de garde ne possèdent pas de chloroplastes (l'oignon par exemple) et ce postulat a été abandonné. L'ion potassium est en réalité l'élément déterminant du phénomène : son entrée et sa sortie de la vacuole est étroitement contrôlée et gouverne la turgescence des cellules stomatiques et donc l'ouverture des stomates. En cas de stress hydrique les racines synthétisent de l'acide abscissique qui agit sur les cellules stomatiques et provoque leur fermeture par plasmolyse, limitant ainsi les pertes d'eau[16].
Pour éviter les pertes excessives d'eau tout en maintenant autant que possible l'ascension de la sève brute, la plante régule l'ouverture et la fermeture de l'ostiole en fonction des conditions climatiques (chaleur, humidité, luminosité) et internes. Certaines plantes (dites CAM comme les Crassulacées) n'ouvrent leurs stomates que la nuit pour éviter les trop grandes déperditions d'eau. Mais en général, les stomates s'ouvrent :
- lorsque la concentration en CO2 diminue (c'est-à-dire lorsque la photosynthèse augmente donc lorsqu'il y a plus de lumière) ;
- en réponse à une irradiation à la lumière bleue (donc lorsque l'ensoleillement est fort et la photosynthèse à son maximum).
Et ils se ferment en réponse :
- à des taux élevés internes en CO2 ;
- à des températures élevées ;
- à un vent fort et une faible hygrométrie ;
- à des signaux hormonaux (ex : acides abscissiques ou ABA).
Études
Les biomiméticiens et d'autres chercheurs s'intéressent aux stomates dont on étudie les formes, le fonctionnement, les fonctions, la résistance stomatique (en s.cm-1) le coefficient de diffusion de vapeur d'eau dans l'air, le diamètre et la surface ouverte, la profondeur (longueur du canal stomatique), la densité (en nombre de stomates par cm2, ou parfois exprimée en distance moyenne entre stomates)[17],[1].
Mieux comprendre leur fonctionnement permettrait d'aboutir à des applications utiles pour divers domaines scientifiques et techniques [18];
Voir aussi
Articles connexes
Bibliographie
- (en) Eduardo Zeiger, G. D. Farquhar et I. R. Cowan, Stomatal Function, Stanford University Press, , 503 p. (lire en ligne)
- (en) M. Fricker et C. Willmer, Stomata, Springer Science & Business Media, , 375 p. (lire en ligne)
Références
- Jean-Pierre Garrec et Roger Plebin, « Permeabilite au fluorure d'hydrogene (HF) des cuticules avec ou sans stomates de feuilles: Influence de la presence des stomates et comparaisons avec la permeabilite a l'eau », Environmental and Experimental Botany, vol. 26, no 4, , p. 299–308 (DOI 10.1016/0098-8472(86)90017-1, lire en ligne, consulté le )
- Sané de Parcevaux et Laurent Huber, Bioclimatologie : Concepts et applications, éditions Quae, , p. 192.
- Anu Singh Cundy et Gary Shin, Découvrir la biologie, De Boeck Superieur, , p. 770.
- Hirano E (1931) Relative abundance of stomata in citrus and some related genera. Bot. Gaz., 92, 296-310
- Bernard Aubert et Sané De Parcevaux, « Résistance à la diffusion gazeuse au niveau de l'épiderme foliaire de quelques plantes fruitières tropicales et subtropicales », Fruits, (lire en ligne, consulté le )
- Turell FM (1947) Citrus leaf stomata : structure composition and pore size in relation to penetration of liquids. Bot. Gaz., vol. ,o8, nb. 4, juin 1947.
- Gaussen H (1968) La résistance à la sécheresse des arbres xérophiles. Revue Forestière Française.
- (en) AM Hetherington et FI Woodward, « The role of stomata in sensing and driving environmental change », Nature, vol. 424, no 6951, , p. 901-908
- Walter S. Judd, Christopher S. Campbell, Elizabeth A. Kellogg et Peter Stevens, Botanique systématique. Une perspective phylogénétique, De Boeck Supérieur, , 467 p..
- (en) Aslam Khan, Plant Anatomy and Physiology, Gyan Publishing House, , p. 134.
- (en) Ernst Steudle, « Transport of water in plants », Environment Control in Biology, vol. 40, no 1, , p. 29-37 (DOI 10.2525/ecb1963.40.29)
- Sané de Parcevaux et Laurent Huber, Bioclimatologie. Concepts et applications, éditions Quae, , p. 282.
- Jennifer Dumont, « Thèse de doctorat en Sciences du Vivant / Biologie végétale : Rôle de la régulation stomatique et de la capacité de détoxication foliaire dans l'estimation d'un seuil de risque à l'ozone pour la végétation », Université de Lorraine (thèse), (lire en ligne, consulté le )
- Gautier H (1991) Physiologie des stomates. Réponse à la lumière bleue des protoplastes de cellules de garde ; Thèse de Doctorat, Université de Toulouse 3
- (en) AC Wille et WJ Lucas, « Ultrastructural and histochemical-studies on guard-cells », Planta, vol. 160, no 2, , p. 129-142 (DOI 10.1007/BF00392861)
- (en) K. Raschke et M.P.Fellows, « Stomatal movement in Zea mays: Shuttle of potassium and chloride between guard cells and subsidiary cells », Planta, vol. 101, no 4, , p. 296-316 (DOI 10.1007/BF00398116)
- Yves Lespinasse et Dominique Noiton, « Contribution à l'étude d'une plante haploïde de pommier (Malus pumila Mill.). Étude descriptive et comparaison avec des clones de ploïdie différente. I. - Caractères végétatifs : entrenoeuds, feuilles et stomates », Agronomie, vol. 6, no 7, , p. 659 (lire en ligne, consulté le )
- (en) Maciej A. Zwieniecki, Katrine S. Haaning et al., « Stomatal design principles in synthetic and real leaves », Journal of the royal society Interface, (DOI 10.1098/rsif.2016.0535)
- Portail de la botanique
- Portail de la biologie