Dilvasène
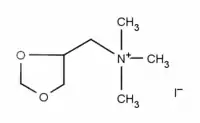
L'iodure d'oxapropanium est un composé organique hétérocyclique de la famille des dioxolanes, breveté comme médicament sous le nom de Dilvasène.
| Dilvasène | |
| |
| Identification | |
|---|---|
| Nom UICPA | Iodure de 1,3-dioxolan-4-ylméthyl(triméthyl)azanium |
| Synonymes |
2249 F |
| No CAS | |
| PubChem | 10939 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H16INO2 [Isomères] |
| Masse molaire[1] | 273,1119 ± 0,0076 g/mol C 30,78 %, H 5,9 %, I 46,47 %, N 5,13 %, O 11,72 %, |
| Propriétés physiques | |
| T° fusion | 70 à 71 °C |
| Écotoxicologie | |
| DL50 | 300 mg·kg-1 (souris, oral) [2] 2,5 mg·kg-1 (souris, i.v.)[2] 35 mg·kg-1 (souris, s.c.)[2] |
| Considérations thérapeutiques | |
| Classe thérapeutique | Cholinergique |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Synthétisé pour la première fois en 1944 dans le laboratoire de chimie thérapeutique de l'Institut Pasteur[3],[4],[5], l'iodure d'oxapropanium est obtenu par réaction d'un acétal cyclique d'α-monohalogénohydrine de glycérol avec la diméthylamine, dont le produit, traité par l'iodure de méthyle, donne un sel d'ammonium quaternaire.
Histoire
Étudié comme hypotenseur et vasodilatateur par Ernest Fourneau et Daniel Bovet et breveté en 1948 par la société Rhône-Poulenc[6] pour ses propriétés cholinergiques, le Dilvasène a été prescrit au début des années 1950 par injection intraveineuse dans le traitement de certains troubles psychiques comme la démence précoce[7],[8],[9],[10].
Dans les années 1960, Jacques van Rossum et Everhardus Ariens (en)[11], puis D. R. Garrison et ses collaborateurs[12],[13], se sont servis de la structure moléculaire du Dilvasène pour développer de nouveaux composés antimuscariniques[14],[15].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Bulletin de la Société de chimie biologique, vol. 26, , p. 516.
- Marcel Delépine, Ernest Fourneau (1872-1949) : Sa vie et son œuvre (extrait du Bulletin de la Société chimique de France), Paris, Masson, s.d. (vers 1950).
- Ernest Fourneau, Daniel Bovet, Filomena Bovet et Georges Montézin, « Activité acétylcholinique particulièrement intense dans une nouvelle série d'aminoacétals de polyols », Bulletin de la Société de chimie biologique, vol. 26, , p. 516-527.
- Ernest Fourneau et Daniel Bovet, « Propriétés parasympathicomimétiques des acétals du bétaïnealdéhyde », C. r. Soc. biolog., vol. 138, , p. 469.
- Brevet US 2445393, Rhône-Poulenc, 1948.
- (en) Ronald Verbeke et Georges René De Vleeschhouwer, « On the Pharmacology of Iodomethylate of Dimethylamino-1-methylene-dioxy-2,3-propane (2249 F, Dilvasene) », Archives internationales de pharmacodynamie et de thérapie, vol. 81, no 1, , p. 1 et suiv..
- P. Royer et R. Thiébaux, « Action biologique des injections intraveineuses de vasodilatateurs de synthèse dans les maladies mentales : 2249-F (Dilvasène) », Presse médicale, vol. 58, no 25, , p. 446.
- (en) P. Royer et R. Thiébaux, « Comparative Effect of Intravenous Injections of Acetylcholine Bromide and Dilvasene in Dementia Praecox », Strasbourg médical, no 1 (suppl), , p. 28-30.
- (en) P. Royer et R. Thiébaux, « Comparative Effect of Intravenous Injections of Acetylcholine (Fiamberti) and of 2249 F (Dilvasene), in the Therapy of Mental Diseases », Sistema nervoso, vol. 3, no 2, , p. 95-103.
- Jacobus Maria van Rossum et Everhardus Jacobus Ariens, « Pharmacodynamics of Parasympathetic Drugs : Structure-Action Relationship in Homologous Series », Arch. int. pharmacodyn., vol. 18, , p. 418.
- (en) Marian May et David J. Triggle, « Studies on the Cholinergic Receptor : Part I. Cholinomimetic Activities of Some analogs of Cis-2-methyl-4-dimethylaminomethyl-1,3-dioxolane Methiodide », Journal of Pharmaceutical Sciences, vol. 57, no 3, , p. 511–513 (DOI 10.1002/jps.2600570332).
- (en) David R. Garrison, Marian May, Horace F. Ridley et David J. Triggle, « Studies on the Cholinergic Receptor : Part II. Monosubstituted and Bicyclic Derivatives of Cis-2-methyl-4-dimethylaminomethyl-1,3-dioxolane Methiodide », J. Med. Chem., vol. 12, no 1, , p. 130-134 (DOI 10.1021/jm00301a033).
- (en) Laszlo Gyermek, Pharmacology of Antimuscarinic Agents, CRC Press LLC, coll. « Pharmacology and Toxicology », , 528 p. (ISBN 0-8493-8559-8, lire en ligne), p. 268.
- (en) David J. Triggle et Bernard Belleau, « Studies on the Chemical Basis for Cholinomimetic and Cholinolytic Activity : Part I. The Synthesis and Configuration of Quaternary Salts in the 1,3-Dioxolane and Oxazoline Series », Canadian Journal of Chemistry, vol. 40, no 6, , p. 1201-1215 (lire en ligne).
- Portail de la chimie
- Portail de la pharmacie
- Portail de la médecine