Cinnoline
La cinnoline, 1,2-naphtyridine ou benzopyridazine est un composé aromatique hétérocyclique de formule brute C8H6N2. C'est un isomère d'autres diazanaphtalènes comme la quinazoline, la quinoxaline et la phtalazine. C'est donc un composé bicyclique de squelette moléculaire identique au naphtalène et dans lequel deux atomes de carbone ont été remplacés par deux atomes d'azote. Dans le cas de la cinnoline, ce sont les atomes 1 et 2 qui ont été remplacés par des atomes d'azote, ce qui fait que sa structure est celle d'un cycle pyridazine fusionné avec un cycle benzène. Plus généralement, les cinnolines sont des dérivés de la cinnoline.
| Cinnoline | |

| |
| Identification | |
|---|---|
| Nom UICPA | cinnoline |
| Synonymes |
1-benzopyridazine, 1,2-benzodiazine |
| No CAS | |
| No ECHA | 100.005.423 |
| No CE | 205-964-8 |
| PubChem | 9208 |
| ChEBI | 36617 |
| SMILES | |
| InChI | |
| Apparence | solide en aiguilles incolores[1] |
| Propriétés chimiques | |
| Formule | C8H6N2 [Isomères] |
| Masse molaire[2] | 130,1466 ± 0,0072 g/mol C 73,83 %, H 4,65 %, N 21,52 %, |
| pKa | 2,64[3] |
| Propriétés physiques | |
| T° fusion | 38 °C[4] 40−41 °C[5] |
| T° ébullition | 114 °C à 0,4 hPa[5] |
| Écotoxicologie | |
| LogP | 0,93[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Découverte et synthèse
La cinnoline a été découverte comme un sous-produit de la réaction de cyclisation de l'alcyne o-C6H4(NH2)C≡CCO2H dans l'eau donnant majoritairement l'acide 4-hydroxycinnoline-3-carboxylique. Ce dernier composé peut ensuite être décarboxylé et son groupe hydroxyle réduit pour donner encore de la cinnoline. Cette réaction est appelée « synthèse de Richter de la cinnoline »[6]. D'autre méthodes plus élaborées existent, comme la déshydrogénation de la dihydrocinnoline par l'oxyde mercurique fraîchement précipité. Elle peut être isolée sous forme de chlorhydrate[7], sa forme free base (pure) peut être obtenue sous la forme d'une huile par le traitement des chlorhydrates avec une base.
Il est également possible de synthétiser la cinnoline par électrolyse de la N-[2-(2-nitrophényl)éthyl]-1-propanamine. Elle est effectuée dans une solution tamponnée de méthanol et d'eau[8]. Cette réaction a un bon rendement[8].
Dérivés
On appelle aussi cinnolines, les dérivés substitués de la cinnoline. On peut notamment citer parmi eux le chlorhydrate de cinnoline[9], l'acide cinnoline-4-carboxylique[10], la 4(1H)-cinnolinone[11], la benzo[c]cinnoline et la cinoxacine (en), un antibiotique.
Une réaction organique classique pour synthétiser de tels dérivés est la synthèse de Widman–Stoermer[12], une réaction de fermeture de cycle d'une α-vinylaniline en présence d'acide chlorhydrique et de nitrite de sodium, NaNO2 :
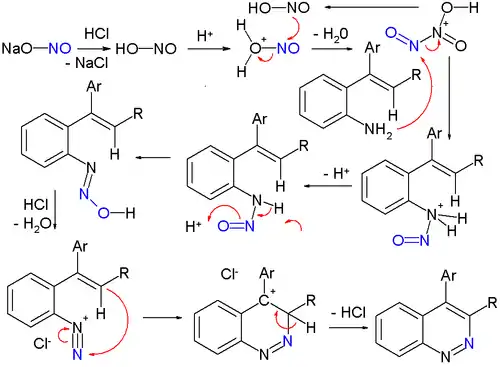
Le nitrite de sodium est d'abord converti en acide nitreux, puis se transforme en un intermédiaire électrophile, HO-N+(=O)-N=O. Cet intermédiaire par réaction avec l'α-vinylaniline forme une nitrosamine stable qui expulse plus tard une molécule d'eau pour former un chlorure de diazonium qui réagit enfin avec le groupe vinyle lors de l'étape de fermeture du second cycle.
Une réaction conceptuellement proche est la synthèse de triazine de Bamberger. Une autre méthode de formation de cinnolines est la synthèse de cinnoline de Borsche-Koelsch[13]
Notes et références
- M. Busch, A. Rast, Ueber das Cinnolin, Chem. Ber., 1897, vol. 30, pp. 521–527. DOI:10.1002/cber.189703001103.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- (en) « Cinnoline », sur ChemIDplus, consulté le 12 juin 2014
- J. S. Morley, Cinnolines, Part XX VII : The Preparation and Nitration of Cinnoline, J. Chem. Soc., 1951, pp. 1971–1975. DOI:10.1039/JR9510001971
- Victor von Richter, « Über Cinnolinderivate », Chemische Berichte, vol. 16, , p. 677–683
- (en) Parrick, J.; Shaw, C. J. G. and Mehta, L. K., Rodd's Chemistry of Carbon Compounds, vol. 4, , 2nd éd., 1–69 p., « Pyridazines, cinnolines, benzocinnolines and phthalazines »
- (en) B. A. Frontana-Uribe, C. Moinet, L. Toupet,, « N-Substituted 1-Aminoindoles from Electrogenerated N-Substituted 2-(ortho-Nitrosophenyl)ethylamines », Eur. J. Org. Chem, vol. 2, , p. 419-430 (DOI 10.1002/(SICI)1099-0690(199902)1999:2<419::AID-EJOC419>3.0.CO;2-V, lire en ligne, consulté le )
- Fiche Sigma-Aldrich du composé Cinnoline hydrochloride, consultée le 13 juin 2014.
- Fiche Sigma-Aldrich du composé Cinnoline-4-carboxylic acid, consultée le 13 juin 2014.
- Fiche Sigma-Aldrich du composé 4(1H)-Cinnolinone, consultée le 13 juin 2014.
- (en) Bradford P. Mundy, Michael G. Ellerd, Frank G. Jr. Favaloro, Name Reactions and Reagents in Organic Synthesis, Hoboken (N. J.), J. Wiley & sons, , 882 p. (ISBN 0-471-22854-0)
- (en) « Borsche-Koelsch Cinnoline Synthesis », dans Comprehensive Organic Name Reactions and Reagents (ISBN 9780470638859, DOI 10.1002/9780470638859, lire en ligne)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cinnoline » (voir la liste des auteurs).
- Portail de la chimie
