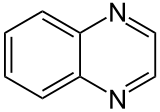
Quinoxaline
La quinoxaline aussi appelé benzopyrazine est un composé organique hétérocyclique contenant un noyau benzénique soudé à un cycle pyrazine. C'est un isomère d'autres diazanaphtalènes comme la quinazoline, la cinnoline et la phtalazine. Plus généralement, les quinoxalines sont des dérivés de la quinoxaline.
| Quinoxaline | |
| |
  |
|
| Identification | |
|---|---|
| Nom UICPA | quinoxaline |
| Synonymes |
1,4-benzodiazine, benzo[a]pyrazine, benzopyrazine |
| No CAS | |
| No ECHA | 100.001.862 |
| No CE | 202-047-4 |
| No RTECS | VD1225000 |
| PubChem | 7045 |
| ChEBI | 36616 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H6N2 [Isomères] |
| Masse molaire[1] | 130,1466 ± 0,0072 g/mol C 73,83 %, H 4,65 %, N 21,52 %, |
| Propriétés physiques | |
| T° fusion | 29−32 °C[2] 29−34 °C[3],[4] 27−32 °C[5] |
| T° ébullition | 220−223 °C[2],[3],[4],[5] |
| Solubilité | Soluble dans l'eau, miscible dans l'alcool éthylique, l'éther, le benzène, l'acétone[5] |
| Masse volumique | 1,124 g·cm-3 à 25 °C[2],[4],[5] |
| Point d’éclair | 98 °C[2],[3],[4],[5] |
| Précautions | |
| SGH[2],[5] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La quinoxaline peut être synthétisée par condensation de l'ortho-phénylènediamine (1,2-diaminobenzène) avec du éthanedial (glyoxal)[6]. De la même façon, les quinoxalines peuvent être formées en condensant d'autres 1,2-diaminobenzènes sur des 1,2-dicétones[6] Des dérivés substitués se forment également lorsque des acides α-cétoniques, des α-chlorocétones, des alcools α-aldéhyde ou des alcools α-cétone sont utilisés à la place des dicétones. La quinoxaline et ses dérivés peuvent être aussi formés par réduction d'acides aminés substitués par des groupes 1,5-difluoro-2 ,4-dinitrobenzène (DFDNB)[7].
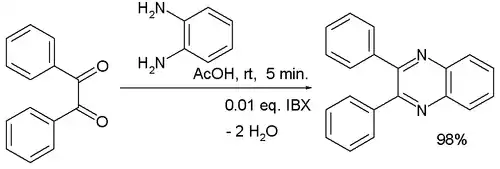
Une étude a utilisé de l'acide 2-iodoxybenzoïque (IBX) en tant que catalyseur dans la réaction du benzile avec du 1,2-diaminobenzène[8] :
Utilisation
Les quinoxalines sont utilisées comme colorants, produits pharmaceutiques comme des antibiotiques tels que l'échinomycine, sulfaquinoxaline ou actinoleutine et aussi pour la vulcanisation[9].
Quelques études ont été menées afin d'explorer les propriétés antitumorales des composés quinoxalines[10]. En 2007, la quinoxaline et ses dérivés ont été étudiés comme ligands catalyseurs[11].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Quinoxaline » (voir la liste des auteurs) et en allemand « Chinoxalin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Quinoxaline99%.
- Quinoxaline, 99% chez Acros Organics.
- Quinoxaline sur chemblink.com.
- Quinoxaline, 98+% chez Alfa Aesar.
- D. J. Brown, E. C. Taylor, The Chemistry of Heterocyclic Compounds', Quinoxalines: Supplément II: 61, p. 16, 1re éd., John Wiley & Sons, New York, 2004. (ISBN 0-471-26495-4).
- Xiang-Hong Wu, Gang Liu et al, Solution-phase reductive cyclization of 2-quinoxalinol analogs: Systematic study of parallel synthesis, Mol. Diver, 2004, vol. 8(2), pp. 165–147. DOI:10.1023/B:MODI.0000025639.89179.60.
- Heravi, Majid M. Facile synthesis of quinoxaline derivatives using o-iodoxybenzoic acid (IBX) at room temperature, Arkivoc, 2006, vol. 2006(16), pp. 16-22. DOI:10.3998/ark.5550190.0007.g02.
- T. Otaka, S. Shoji, Y. Hamura, T. Funayama, Deutsches Patent DE102005055649A1, 2006.
- Jean Renault, Michel Baron, Patrick Mailliet et al., Heterocyclic quinones.2.Quinoxaline-5,6-(and 5-8)-diones-Potential antitumoral agents, Eur. J. Med. Chem., 1981, vol. 16(6), pp. 545–550
- Xianghong Wu, Anne E. V. Gorden, Regioselective Synthesis of Asymmetrically Substituted 2-Quinoxalinol Salen Ligands, J. Org. Chem., 2007, vol. 72(23), pp. 8691–8699. DOI:10.1021/jo701395w, .
- Portail de la chimie