Chlorométhane
Le chlorométhane, également appelé chlorure de méthyle, Fréon 40 ou R40, est un composé chimique de formule CH3Cl. Il s'agit d'un fluide frigorigène également utilisé comme réactif pour de nombreuses synthèses.
Pour les critères administratifs, voir Chlorure de méthyle (maladie professionnelle).
| Chlorométhane | |
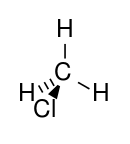 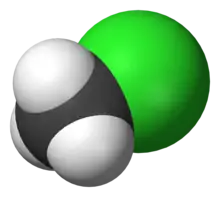 Structure du chlorométhane |
|
| Identification | |
|---|---|
| Nom UICPA | chlorométhane |
| Synonymes |
chlorure de méthyle |
| No CAS | |
| No ECHA | 100.000.744 |
| No CE | 200-817-4 |
| PubChem | 6327 |
| ChEBI | 36014 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore à odeur douceâtre |
| Propriétés chimiques | |
| Formule | CH3Cl [Isomères] |
| Masse molaire[1] | 50,488 ± 0,003 g/mol C 23,79 %, H 5,99 %, Cl 70,22 %, |
| Propriétés physiques | |
| T° fusion | −97,6 °C[2] |
| T° ébullition | −24,2 °C[2] |
| Solubilité | 5 g·l-1 (eau,25 °C) [3] |
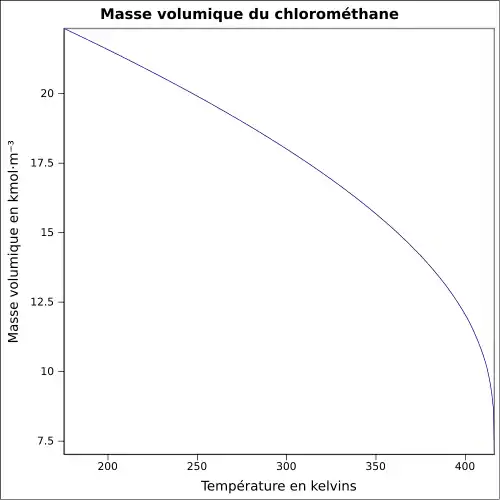
| Masse volumique | 2,3065 g·l-1 (0 °C,1 013 mbar) [3]
|
| T° d'auto-inflammation | 632 °C [2] |
| Limites d’explosivité dans l’air | 7,6–19 %vol [3] |
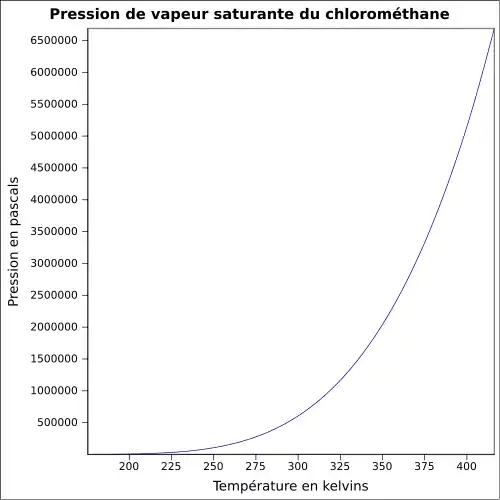
| Pression de vapeur saturante | 4,896 bar à 20 °C 6,6 bar à 30 °C 10,9 bar à 50 °C [3] |
| Point critique | 143 °C, 66,7 bar, 0,353 kg·l-1 [3] |
| Point triple | −97,71 °C, 0,00876 bar [3] |
| Thermochimie | |
| S0gaz, 1 bar | 234,36 J·K-1·mol-1 [5] |
| S0liquide, 1 bar | 140,08 J·K-1·mol-1 [5] |
| ΔfH0gaz | −83,68 kJ·mol-1 [5] |
| ΔfH0liquide | −102,4 kJ·mol-1 [5] |
| ΔfusH° | 6,431 kJ·mol-1 à 175,44 K [5] |
| ΔvapH° | 20,5 kJ·mol-1 [5] |
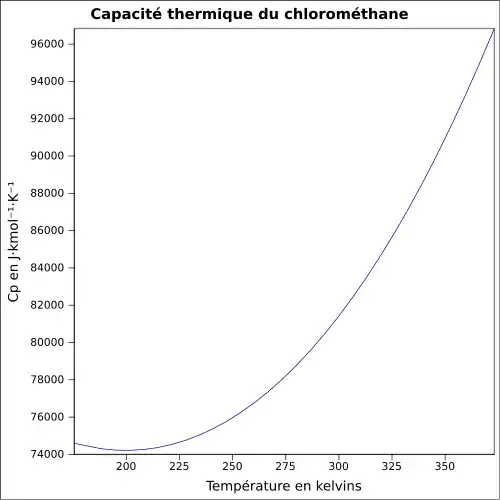
| Cp | 81,2 J·K-1·mol-1 à 298 K [5]
|
| PCI | −764,0 kJ·mol-1 (gaz) [5] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 11,22 ± 0,01 eV (gaz)[7] |
| Précautions | |
| SGH[8] | |
   Danger |
|
| NFPA 704 | |
| Transport[3] | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[9] | |
| Écotoxicologie | |
| DL50 | 1,8 g·kg-1 (rat, oral) [10] |
| LogP | 0,91 [3] |
| Seuil de l’odorat | bas : 10 ppm[11] |
| Unités du SI et CNTP, sauf indication contraire. | |
Biogenèse et présence dans la nature
Les halogénoalcanes (espèces contenant une liaison carbone-halogène) sont produits - probablement via des différents processus biologiques - par certains champignons, animaux et plantes. La molécule CH3Cl a ainsi été proposée comme un possible marqueur de vie, au cas où elle serait détectée dans des atmosphères d'exoplanètes rocheuses.
Une plante de milieux saumâtres Batis maritima produit un enzyme methyl chloride transferase qui catalyse la synthèse de CH3Cl à partir de S-adenosine-L-methionine et de chlore[12]. Cette protéine a été purifiée, puis introduite et exprimée par génie génétique dans la bactérie E. coli. Elle semble aussi être active chez des microchampignons tels que Phellinus pomaceus, des algues rouges (ex : Endocladia muricata) ou une espèce végétale devenue localement invasive, Mesembryanthemum crystallinum, toutes connues pour aussi produire du CH3Cl.[12],[13], tout comme par la plante-modèle de laboratoire Arabidopsis thaliana[14].
Présence dans l'univers
En 2017 la molécule CH3Cl a été détectée dans et en dehors du Système solaire. D'abord par l'interféromètre ALMA autour de la proto-étoile de type solaire IRAS16293-2422, dans une zone où des planètes pourraient se former. Ensuite par le spectromètre ROSINA (à bord de la sonde Rosetta) dans la comète 67P/Tchourioumov-Guérassimenko[15],[16].
La découverte de CH3Cl dans des lieux antérieurs à l'origine de la vie (connue) indique que d'autres biomarqueurs plus définitifs devront être utilisés pour conclure à la présence de vie sur d'autres planètes. Les organohalogènes pourraient par contre constituer un élément de compréhension de la chimie impliquée dans l'origine de la vie.
Propriétés physico-chimiques
Le chlorométhane est hydrolysé par l'eau à haute température pour former du méthanol CH3OH et du chlorure d'hydrogène HCl :
Cette réaction est catalysée par des composés alcalins. La réaction réciproque permet de synthétiser CH3Cl en faisant barboter du chlorure d'hydrogène dans du méthanol en présence éventuellement de chlorure de zinc ZnCl2 comme catalyseur, ou en faisant réagir du méthanol et du chlorure d'hydrogène à 350 °C sur de l'alumine Al2O3 :
À plus basse température, le chlorométhane forme un hydrate avec l'eau, ce qui pose un problème dans les systèmes de réfrigération[17].
Utilisation
Le chlorométhane est utilisé pour la préparation du diméthyldichlorosilane Si(CH3)2Cl2 via la synthèse de Müller-Rochow[17] :
- 2 CH3Cl + Si → Si(CH3)2Cl2.
C'est une voie de synthèse importante pour la fabrication des silicones.
Il est aussi utilisé comme réactif pour la réaction de Wurtz-Fittig ou les réactions de Friedel-Crafts utilisée pour la production d'alkylbenzènes[17]. C'est un réactif important pour la méthylation notamment des amines pour la formation de méthylamines quaternaires ou des groupes hydroxyles pour former de éthers[17].
Production et synthèse
Ce gaz est produit par chloration du méthane avec du chlore gazeux de 400 à 500 °C. Le mécanisme de chloration est une réaction radicalaire en chaîne via des radicaux issus de la dissociation du chlore. Cette dissociation peut être obtenue par voie thermique, photochimique ou par des catalyseurs. La voie thermique est préférée[17] et elle conduit à une série de substitutions successives:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Le résultat de cette série de réactions est un mélange de chlorométhane, dichlorométhane, chloroforme et tétrachlorure de carbone. Ces composés sont ensuite séparés par distillation. Un excès de méthane est utilisé dans le réacteur et un recyclage est employé en présence d'un gaz inerte afin d'éviter de travailler dans un domaine où le mélange méthane-chlore est explosif[17].
Une autre voie de synthèse est l'hydrochloration du méthanol par du chlorure d'hydrogène. Cette réaction est actuellement privilégiée, car elle consomme du chlorure d'hydrogène, qui est un sous-produit difficile à écouler, au lieu d'en produire comme dans le cas de la chloration. De plus la synthèse conduit à la seule production du chlorométhane et évite la production des composés multichlorés[17].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- CHLORURE DE METHYLE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Entrée « Methyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 février 2010 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Methyl chloride », sur NIST/WebBook, consulté le
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- (en) « Chlorométhane », sur ChemIDplus, consulté le
- « Methyl chloride », sur hazmap.nlm.nih.gov (consulté le )
- Ni X, Hager LP, « cDNA Cloning of Batis maritima Methyl Chloride Transferase and Purification of the Enzyme », Proc Natl Acad Sci USA, vol. 95, no 22, , p. 12866–71 (PMID 9789006, PMCID 23635, DOI 10.1073/pnas.95.22.12866)
- Ni X, Hager LP, « Expression of Batis maritima Methyl Chloride Transferase in Escherichia coli », Proc Natl Acad Sci USA, vol. 96, no 7, , p. 3611–5 (PMID 10097085, PMCID 22342, DOI 10.1073/pnas.96.7.3611)
- Nagatoshi Y, Nakamura T (2007) "Characterization of three halide methyltransferases in Arabidopsis thaliana". Plant Biotechnol. 24: 503–506. doi:10.5511/plantbiotechnology.24.503.
- « Première détection du Fréon-40 dans le milieu interstellaire avec ALMA et Rosetta », sur CNRS, (consulté le ).
- (en) Edith C. Fayolle, Karin I. Öberg, Jes K. Jørgensen, Kathrin Altwegg, Hannah Calcutt et al., « Protostellar and cometary detections of organohalogens », Nature Astronomy, vol. 1, , p. 703-708 (DOI 10.1038/s41550-017-0237-7).
- (en) Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann, Chlorinated Hydrocarbons, Wiley-VCH Verlag GmbH & Co., coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a06_233.pub2)
- Portail de la chimie