Biolixiviation
La biolixiviation (appelée aussi lixiviation biologique ou lixiviation bactérienne) est une technique d'extraction de métaux d’intérêts économiques d'une roche, mettant en jeu des micro-organismes capables de convertir ces métaux de la forme solide à la forme soluble, qui pourront ensuite être extraits. Cette méthode est également utilisée à des fins de purification de certains minéraux comme le quartz.
Historique[1]
En 1947, Colmer et Hinkle, en s’intéressant à la pollution de la rivière Ohio (États-Unis) par les eaux de drainage de mines de charbon, notent l’existence d’une énorme quantité d’acide sulfurique. La présence d’un tel acide n’est pas surprenante dans les effluents miniers, et s’explique par l’oxydation atmosphérique de la pyrite (FeS2), espèce minérale contenue dans le charbon. La quantité d’acide sulfurique présente est néanmoins trop importante pour provenir d’une oxydation purement chimique, et ils soupçonnent une oxydation d’origine biologique. Ils mettent en effet en évidence la présence de bactéries, capables d’oxyder le fer ou des composés soufrés, telles que Acidithiobacillus ferrooxidans ou Thiobacillus ferrooxidans. L’industrie voit rapidement un intérêt (économique et écologique), dans l’utilisation de ce genre de micro-organismes pour l’extraction de métaux à partir de minéraux sulfurés. Les premiers essais de cette nouvelle technique, appelée biolixiviation, furent menés dans le début des années 1990. Son utilisation véritablement industrielle vit le jour dans les années 1998-1999.
Principe
Le processus de dégradation des minéraux sulfurés par les bactéries, qui est à l’origine un phénomène naturel, constitue la base du procédé de biolixiviation. Ces micro-organismes, qui sont chimiolithoautotrophes (en), puisent leur source d’énergie dans les phénomènes d’oxydation d’éléments chimiques minéraux, comme le fer ou le soufre, constituants majeurs de minerais sulfurés qui renferment d’importantes quantités de métaux de grande valeur économique (cuivre, nickel, cobalt). La biolixiviation permet, par des installations industrielles de grandes envergures, de mettre à profit la capacité métabolique de certaines bactéries comme Sulfolobus metallicus, Thiobacillus ferrooxydans et Thiooxidans, Leptospirillum ferrooxidans, afin de libérer par des réactions d’oxydoréductions, les ions métalliques d’intérêts. Les champignons comme Aspergillus niger ou Penicilium funiculosum sont également utilisés. La plupart de ces micro-organismes sont acidophiles (pH compris entre 1,5 et 3,5) et mésophiles ou thermophiles (température comprise entre 35 °C à 70 °C). Ils sont ainsi capables de tolérer une concentration importante d’ions métalliques dissous, et de se multiplier dans des conditions extrêmes de température et de pH. La biolixiviation est principalement utilisée en biohydrométallurgie, et permet par conséquent de récupérer de nombreux métaux d’intérêts économiques, comme le cuivre, le zinc, le plomb, l'arsenic, l'antimoine, le nickel, l'or, l'argent, le manganèse, le cobalt.
Procédés
Les procédés mis en œuvre dans la technique de biolixiviation sont multiples, mais peuvent être regroupés en deux grandes familles : les procédés statiques et les procédés dynamiques, le but étant de récupérer le métal d’intérêt sous forme dissoute, qui sera ensuite précipité par extraction sur solvant ou par électrolyse.
Statique
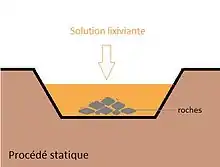
Le principe est de faire transiter une solution acide, contenant les micro-organismes, à travers un minerai issu directement d’une mine. Ces procédés sont surtout utilisés pour l’extraction du zinc, du cuivre, du nickel et du cobalt. On retrouve trois modes d’utilisation principaux parmi les procédés statiques. Le mode in situ, qui consiste à placer le minerai concassé dans des vallons aux parois imperméables. L’ensemble est saturé par une solution acide (pH ̴ 2-3), sous aération, afin de récupérer le métal dissous à la base du vallon. Le mode « en amas » consiste à arroser la surface d’un amas de minerai par une solution acide, puis de récupérer après percolation, la solution contenant le métal d’intérêt. Le troisième mode, dit en « stalle noyée », repose sur l’inondation du minerai dans la solution bactérienne acide, ce qui augmente la surface de contact entre les bactéries et le minerai, mais au détriment d’un mauvais échange gazeux d’O2 et de CO2, nécessaires à l’oxydation des sulfures et à la croissance des bactéries[2].
Dynamique
Le minerai préalablement broyé et mélangé à la solution bactérienne, est mis sous agitation dans un réacteur, afin de faciliter les échanges gaz/liquide/solide.
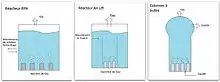
Trois types de dispositifs sont utilisés. Le RPA (réacteur parfaitement agité), est le seul applicable à l’échelle industrielle. Il s’agit d’un bioréacteur mis sous agitation mécanique, dans lequel de l'air est injecté au fond de la cuve pour aérer le milieu. Le réacteur « air-lift », formé de deux compartiments communicants, permet de créer des mouvements de fluide, grâce à l’aération d’un seul compartiment. Enfin, la « colonne à bulles » est un réacteur en forme de tube dans lequel le gaz est introduit par un distributeur. Le liquide est ensuite pompé vers le haut à la différence des réacteurs air-lift[3].
Applications
Les micro-organismes utilisés dans ces différents procédés peuvent agir suivant 2 voies : la voie directe, où les réactions sont directement catalysées par les bactéries, et la voie indirecte, où les réactions sont accélérées par l’acidification due à la formation d’acides organiques. La dégradation du minerai n’est donc pas réalisée directement par les micro-organismes, mais par leurs produits, par la formation de complexes solubles entre les ions métalliques et les acides organiques. Le manganèse, sous forme réduite Mn(II) et Mn(III), est extrait à l’aide de ces deux voies. D’autres métaux comme le cobalt, le nickel ou le cuivre, sont extraits par voie indirecte. Le cuivre, composant majoritaire de la chalcopyrite (CuFeS2) est dissous grâce à l’acide sulfurique excrété par Thiobacillus thiooxidans, ou par l’oxydation du fer ferrique (Fe3+) généré par l’oxydation du fer ferreux (Fe2+) de Leptospirillum ferrooxidans. Le nickel, contenu dans la pentlandite ((Fe,Ni)9S8) est extrait grâce à l’acide citrique ou l’acide oxalique produits par les champignons Aspergillus niger ou du genre Penicillium, le nickel étant nocif pour certaines bactéries. L’arsénopyrite (FeAsS), contenant l'or, est solubilisée par voie directe, grâce à l’oxydation de Thiobacillus ferrooxidans. L'or est ensuite complexé avec une solution de cyanure.
Enjeux
L’avantage majeur de la biolixiviation réside dans la possibilité de traiter et d’extraire des métaux d’intérêts économiques, à partir de déchets miniers et de ressources minérales que les techniques classiques (fonderie, pyrométallurgie), ne sont pas en mesure de revaloriser. Cette technique a par exemple permis d’atteindre un rendement de 90 % pour l’extraction d’or par cyanuration, alors que celui-ci était inférieur à 10 % avant l’avènement de cette technique[2]. Environ 20 % du cuivre exporté sur le marché mondial provient d’une extraction par biolixiviation. Les procédés statiques permettent une extraction de gisements peu riches en métaux d’intérêts, pour un coût relativement faible, mais le temps de réaction est lent. Les procédés dynamiques font intervenir des installations plus petites, sont plus rapides, mais sont aussi plus coûteux. Chaque technique comporte ses avantages et ses inconvénients, selon la localisation du gisement, l’environnement en périphérie, et la teneur en métaux des minerais.
Notes et références
- « http://www.cgm.cnrs-gif.fr/gelatinosus/cours_astier_l3s6/6_biodepollution.pdf »(Archive • Wikiwix • Archive.is • Google • Que faire ?)
- « http://www.techniques-ingenieur.fr/base-documentaire/download/m2238/biotechnologies-dans-la-metallurgie-extractive.html?execution=e1s1 »(Archive • Wikiwix • Archive.is • Google • Que faire ?)
- http://www.brgm.fr/result/telechargement/telechargement.jsp?id=RSP-BRGM/RP-50210-FR
Sources
- « http://www.brgm.fr/result/RAPPORT_SP.jsp?pageActive=0&cook=1306501065477 »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 03/05/11
- « http://www2.brgm.fr/dma/chapitres/2moyensdaction/2prevention/methodesbio.html »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 03/05/11
- « http://www.brgm.fr/brgm/Environnement/fichiers/enjeux_16.pdf »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 05/05/11
- « http://www2.ademe.fr/servlet/KBaseShow?sort=-1&cid=96&m=3&catid=10143 »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 06/05/11
- « http://www.brgm.fr/dcenewsFile?ID=1137 »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 22/04/11
- « http://epatras.economie.fgov.be/DisplayPDF/ExtraData/FR/685/163678.pdf »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 22/04/11
- « http://www.courseweb.uottawa.ca/EVS3520/Data/ChapitreC.pdf »(Archive • Wikiwix • Archive.is • Google • Que faire ?) le 22/04/11
- Portail de la mine
- Portail de la production industrielle