Cubane
Le cubane ou pentacyclo[4.2.0.02,5.03,8.04,7]octane est un alcane synthétique de formule brute C8H8. Les huit atomes de carbone sont disposés aux sommets d'un cube. C'est un prismane et un des hydrocarbures platoniciens[4].
| Cubane | |
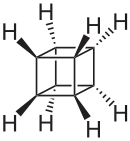 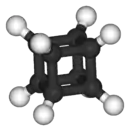 représentations du cubane |
|
| Identification | |
|---|---|
| Nom UICPA | pentacyclo[4.2.0.02,5.03,8.04,7]octane |
| Synonymes |
[4]prismane, quadriprismane |
| No CAS | |
| PubChem | 136090 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H8 [Isomères] |
| Masse molaire[1] | 104,1491 ± 0,007 g/mol C 92,26 %, H 7,74 %, |
| Propriétés physiques | |
| T° fusion | 130 à 131 °C[2] |
| T° ébullition | 133 °C[2] |
| Masse volumique | 1,29 g·cm-3[2] |
| Cristallographie | |
| Symbole de Pearson | [3] |
| Classe cristalline ou groupe d’espace | R3 (n°148) [3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le cubane est une substance solide cristalline. Il a été synthétisé la première fois en 1964 par Philip Eaton[5], professeur de chimie à l'université de Chicago aux États-Unis. Avant cette synthèse, les chercheurs pensaient qu'une molécule organique cubique n'était que théorique, que le cubane était impossible à cause des liaisons entre carbone avec des angles de 90 °, inhabituelles, fortement contraintes et donc instables. Curieusement, une fois formé, le cubane est cinétiquement stable à cause de l'absence de réarrangement possible menant à une décomposition.
Le cubane et ses dérivés ont de nombreuses propriétés importantes[6]. L'angle de liaison entre carbone de 90 ° signifie que les liaisons sont fortement contraintes. Ainsi, les composés du cubane sont très réactifs. Le cubane a aussi la plus haute densité (1,29 g·cm-3) de tous les hydrocarbures, ce qui contribue à sa propriété de stocker beaucoup d'énergie[6]. Des chercheurs étudient le cubane et ses dérivés en médecine et pour les nanotechnologies.
Histoire
Dans les années 1960, Philip Eaton, chimiste à l'université de Chicago, synthétise le cubane puis, encouragé par l'armée, il rechercha un dérivé hautement explosif du cubane, l'octanitrocubane, de formule brute C8N8O16. Ce composé a la même structure que le cubane si ce n'est que chaque atome d'hydrogène est remplacé par un groupe nitro (NO2). Néanmoins, la synthèse de ce produit est épineuse et nécessite de très nombreuses étapes.
Eaton, ayant réalisé cette synthèse, a obtenu moins de 1 g de cette molécule. L'octanitrocubane est beaucoup plus puissant que le TNT, mais pour son créateur, impossible d'être plus précis. L'idée de base avait pour tâche de transformer l'armement explosif militaire : renfermer dans un petit volume à forte densité, un haut potentiel explosif. Cependant, l'octanitrocubane est trop compliqué à synthétiser pour espérer révolutionner, dans un futur proche, l'armement explosif militaire.
Synthèse
La synthèse originale de 1964 du cubane est classique et débute à partir de la 2-cyclopentènone (composé 1.1 dans le schéma 1)[7]:
 Schéma 1. Synthèse de la bromo cyclopentadiènone, précurseur du cubane
Schéma 1. Synthèse de la bromo cyclopentadiènone, précurseur du cubane
le N-bromosuccinimide (NBS) dans le tétrachlorométhane (CCl4) insère un atome de brome allylique sur 1.1 pour produire le composé 1.2, qui par poursuite de bromation avec du brome dans un mélange pentane/dichlorométhane donne le composé tribromé 1.3. Deux équivalents de bromure d'hydrogène (HBr) sont éliminés de ce composé par la diéthyl amine dans l'éther diéthylique pour former la 2-bromo cyclopentadiènone 1.4.
 Schéma 2. Synthèse du cubane
Schéma 2. Synthèse du cubane
Dans la seconde partie (schéma 2), la réaction de Diels-Alder spontanée de la 2-bromo cyclopentadiènone 2.1 à 2.2 est apparentée à la dimérisation du cyclopentadiène en dicyclopentadiène. Dans cette étape, seul l'isomère -endo se forme car les atomes de brome tendent à se placer le plus loin possible entre eux et des groupes carbonyl. De cette façon, les interactions dipolaires sont minimisées dans l'état de transition de la réaction.
Ensuite, les deux groupes carbonyl sont protégés par transformation en acétal (obtenu avec l'éthylène glycol et l'acide paratoluènesulfonique dans le benzène) et l'un entre eux est sélectivement déprotégé avec l'acide chlorhydrique pour obtenir 2.3.
Dans l'étape suivante, l'isomère -endo 2.3 avec deux groupes alcène proches, forme l'isomère pro-cubique 2.4 par une cycloaddition [2+2] photochimique. Le groupe bromocétone est converti en acide carboxylique, composé 2.5, par un réarrangement de Favorskii avec l'hydroxyde de potassium. Ensuite, la décarboxylation qui est obtenue via le chlorure d'acide (réaction avec le chlorure de thionyle) et le ter-butyl percarboxylate 2.6 (réaction avec le t-butyl hydroperoxide et la pyridine), donne le composé 2.7. Alors, le second acétal est éliminé (2.8), un autre réarrangement de Favorskii donne 2.9 et finalement, une autre décarboxylation via 2.10 donne 2.11, le cubane.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) le cubane sur www.ch.ic.ac.uk/.../b_muir
- « The Solid Cubane (C8H8) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Henning Hopf, Classics in Hydrocarbon Chemistry, Wiley VCH, 2000.
- Philip Eaton Home Page
- (en) Cubane sur www.ch.ic.ac.uk/.../wang
- The Cubane System Philip E. Eaton and Thomas W. Cole; J. Am. Chem. Soc.; 1964; 86(5) pp 962 - 964; DOI:10.1021/ja01059a072
- Courrier International n°871