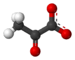
Acide pyruvique
L’acide pyruvique est un composé chimique de formule CH3-CO-COOH. Il s'agit d'un 2-oxoacide ou α-cétoacide, portant à la fois une fonction acide carboxylique et une fonction cétone. Sa base conjuguée est l'anion pyruvate CH3-CO-COO-, un métabolite clé situé au carrefour de plusieurs voies métaboliques majeures des cellules vivantes, telles que la glycolyse, le cycle de Krebs et la néoglucogenèse, et peut être converti en acide gras, en alanine ou encore en éthanol après décarboxylation oxydative en acétyl-coenzyme A.
| Acide pyruvique | |||
  Structure de l'acide pyruvique |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide 2-oxopropanoïque | ||
| Synonymes |
acide pyruvique |
||
| No CAS | |||
| No ECHA | 100.004.387 | ||
| No EC | 204-824-3 | ||
| PubChem | 1060 | ||
| FEMA | 2970 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore | ||
| Propriétés chimiques | |||
| Formule brute | C3H4O3 [Isomères] |
||
| Masse molaire[1] | 88,0621 ± 0,0036 g/mol C 40,92 %, H 4,58 %, O 54,5 %, |
||
| pKa | 2,4 | ||
| Propriétés physiques | |||
| T° fusion | 12 °C[2] | ||
| T° ébullition | 165 °C (décompostion) [2] | ||
| Solubilité | soluble dans l'éthanol et l'éther[2] | ||
| Miscibilité | miscible dans l'eau | ||
| Masse volumique | 1,27 g·cm-3 à 20 °C[2] | ||
| Point d’éclair | 82 °C [2] | ||
| Thermochimie | |||
| Cp | |||
| Précautions | |||
| SIMDUT[4] | |||
  B3, E, |
|||
| Directive 67/548/EEC | |||
 C Phrases R : 34, Phrases S : 26, 36/37/39, 45, |
|||
| Transport | |||
| Écotoxicologie | |||
| DL50 | souris, subdermal : 3 533 mg·kg-1 |
||
| Composés apparentés | |||
| Autres composés |
|
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Acide pyruvique
L'acide pyruvique se présente sous la forme d'un liquide incolore, d'odeur semblable à celle de l'acide acétique. Il est miscible dans l'eau, et soluble dans l'éthanol et l'éther.
En laboratoire, l'acide pyruvique peut être préparé en chauffant un mélange d'acide tartrique et de bisulfate de potassium[5], par oxydation du propylène glycol par un oxydant fort (par exemple du permanganate de potassium ou de l'hypochlorite de sodium), ou encore par hydrolyse du 2-oxopropiononitrile, formé par réaction du chlorure d'éthanoyle sur le cyanure de potassium :
- CH3COCl + KCN → CH3COCN.
- CH3COCN → CH3COCOOH.
Biochimie du pyruvate
Description
L'ion pyruvate est le produit final des voies de dégradation du glucose (la glycolyse, voie des pentoses phosphates, voie d'Entner-Doudoroff). Il est le substrat d'une fermentation en condition anaérobie (fermentation lactique, alcoolique), et du cycle de Krebs de façon indirecte en condition aérobie, après décarboxylation oxydative le convertissant en acétyl-coenzyme A.
Formation du pyruvate par la glycolyse
Le phosphoénolpyruvate (PEP) formé au cours de la glycolyse possède un groupe phosphate à haut potentiel de transfert — ΔG°' = −61,9 kJ mol−1, valeur la plus élevée mesurée chez les êtres vivants — permettant la phosphorylation d'une molécule d'ADP en ATP par la pyruvate kinase. Un cation Mg2+ est nécessaire à cette réaction comme cofacteur.
Devenir du pyruvate en anaérobiose
Les réactions suivantes ont lieu, en milieu anaérobie, dans le cytoplasme, dans le muscle, chez les bactéries lactiques (pour la fermentation lactique, par exemple chez lactobacillus), ou encore chez la levure (pour la fermentation alcoolique). D'autres fermentations sont possibles, par exemple chez les entérobactéries (cf. voies fermentaires des entérobactéries).
Fermentation lactique

+ NADH + H+ → NAD+ + 
Acide pyruvique Acide lactique L-lactate déshydrogénase – EC
Le lactate CH3-CHOH-COO- produit dans le muscle n'est pas responsable des courbatures, contrairement à une idée reçue[6], mais il intervient dans le phénomène des crampes[7]. Toutefois, il peut être transporté dans le sang puis dans les cellules hépatiques (cycle de Cory).
Fermentation alcoolique
Devenir du pyruvate en aérobiose
En milieu aérobie, le pyruvate est dégradé dans les mitochondries. Il y pénètre par la pyruvate translocase. Deux réactions sont possibles, qui génèrent les précurseurs du cycle de Krebs :
Décarboxylation oxydative en acétyl-CoA
Cette réaction est catalysée par un complexe multienzymatique, le complexe pyruvate déshydrogénase, faisant intervenir cinq coenzymes :
- trois coenzymes liées aux apoenzymes : la TPP, le lipoate et le FAD (ce sont des groupements prosthétiques) ;
- deux coenzymes libres et non liées au complexe : le NAD+ et la coenzyme A.

+ NAD+ + CoA-SH → CO2 + NADH + H+ + 
Acide pyruvique Acétyl-CoA Complexe pyruvate déshydrogénase :
pyruvate déshydrogénase (E1) – EC
dihydrolipoamide S-acétyltransférase (E2) – EC
dihydrolipoyl déshydrogénase (E3) – EC
Cette réaction a lieu au niveau de la paroi mitochondriale pour les eucaryotes et au niveau de la membrane pour les procaryotes.
Le NADH + H+ sera par la suite réoxydé par la chaîne respiratoire, synonyme de chaîne mitochondriale de transport d'électrons, pour produire de l'ATP en aérobiose.
Carboxylation en oxaloacétate
La réaction, catalysée en présence de biotine par la pyruvate carboxylase (synthétase), produit de l'oxaloacétate :
Il s'agit d'une réaction anaplérotique majeure.
Rendement énergétique comparé
À partir d'une molécule de glucose, qui donne deux molécules de pyruvate :
- les fermentations ont un rendement médiocre : elles ne libèrent que deux molécules d'ATP par molécule de glucose ;
- les dégradations aérobies sont bien plus rentables : chaque molécule de glucose permet la production de 14 molécules d'ATP via la décarboxylation oxydative, ou de 6 molécules d'ATP via la carboxylation, avant même la dégradation de l'acétyl-CoA par le cycle de Krebs qui libère encore davantage d'énergie.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 127-17-3 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 03/08/09 (JavaScript nécessaire)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- « Acide pyruvique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Organic Syntheses, Coll. Vol. 1, p. 475 (1941); Vol. 4, p. 63 (1925).
- Wienek, Biologie du sport, p. 256, Vigot
- (en) SANTELLI Maurice, Chimie bio-organique, Lavoisier, (ISBN 978-2-257-70526-6, lire en ligne), p. 121
Voir aussi
- La glycolyse
- La voie des pentoses phosphates
- La voie d'Entner-Doudoroff
- Le cycle de Krebs
- Liste d'acides
- Portail de la biochimie
- Portail de la chimie
- Portail de la biologie