Pseudomonas aeruginosa
Pseudomonas aeruginosa, autrement connu sous le nom de bacille pyocyanique, bacille du pus bleu ou pyo[1], est une bactérie gram-négative du genre Pseudomonas. Les bacilles sont fins, droits et très mobiles grâce à un flagelle polaire : ciliature monotriche, dépourvus de spores et de capsules. Ils apparaissent la plupart du temps isolés ou en diplobacilles.

au microscope électronique à balayage
| Règne | Bacteria |
|---|---|
| Division | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordre | Pseudomonadales |
| Famille | Pseudomonadaceae |
| Genre | Pseudomonas |
Nom binominal
(Schroeter, 1872) Migula, 1900
Elle peut, dans certaines conditions, être pathogène. Très résistante, elle est — avec d'autres bactéries à gram-négatif — de plus en plus souvent responsable d'infections nosocomiales. C'est l'une des bactéries les plus difficiles à traiter cliniquement. Le taux de mortalité atteint 50 % chez les patients vulnérables (immunodéprimés).
Germe ubiquitaire, vivant dans les sols et en milieu humide (nuages, robinets, bouchons), très résistant à de nombreux antiseptiques, fréquent en milieu hospitalier, entraînant l'apparition (du fait de sa résistance aux antibiotiques) de véritables souches d'hôpital. Elle peut survivre dans de l'eau distillée ou salée, voire se développer dans certaines solutions antiseptiques ou antibiotiques.
Elle fait partie des germes couramment recherchés lorsque l'on procède à une analyse microbiologique d'un échantillon d'eau.
On pense qu’elle se renouvelle dans les hôpitaux via les fruits, plantes et légumes qui y entrent, c'est une des raisons qui expliquent pourquoi fleurs et plantes vertes sont interdites dans les chambres d'hôpitaux.
Les formes de pathologie qu'elle engendre sont diverses : infection de l'œil, des plaies (surtout brûlures et plaies opératoires), des urines (surtout après sondages), gastro-intestinales et des poumons (par exemple après bronchoscopie), des méningites d'inoculation, des septicémies comme stade terminal d'infections graves ou complication chez des malades soumis à un traitement immunodépresseur, des leucémiques, etc. Elle induit facilement des infections systémiques chez les immunodéprimés (par une chimiothérapie ou par le sida) et chez les victimes de brûlures et de fibrose kystique (mucoviscidose).
Étymologie
Le mot est composé des mots grecs ψεῦδος (pseũdos), 'simili' ou 'imitation', et μόνας (mónas), 'unité'. On l'a employé dans les débuts de la microbiologie pour désigner les « germes ». Aeruginosa, qui veut dire vert-de-gris en latin (le résultat de la corrosion du cuivre), réfère à un pigment que cette bactérie contient.
Identification
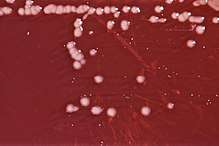
Comme d'autres Pseudomonas, P. aeruginosa sécrète un certain nombre de pigments : entre autres la pyocyanine (bleu-vert), la pyoverdine (jaune-vert fluorescent) et la pyorubine (brun-rouge). In vivo elle sécrète aussi un biofilm, principal agent de sa résistance. C'est une bactérie lactose négative, c'est-à-dire dépourvue d'enzymes dégradant le lactose, pourvue d'une odeur de seringa (fleur de la famille des Philadelphacées encore appelée "jasmin des poètes") in vitro. Une reconnaissance préliminaire en laboratoire identifie ses colonies sur les géloses de type MacConkey (géloses contenant entre autres du lactose) à leur apparence de perles beiges, alors que les colonies de bactéries lactose positives sont roses. Pour une identification assurée, on recherche la présence des enzymes de type oxydase (élastase et protéase parmi d'autres) que cette bactérie sécrète. La production des deux pigments pyocyanine et pyoverdine, et la température de croissance optimale de 42 °C confirme l'identification[2].
P. aeruginosa utilise des flagelles pour la mobilité, des systèmes introduisant des protéines effecteurs dans les cellules hôtes, et un lipopolysaccharide qui supprime les réponses immunitaires des hôtes en plus d'intervenir directement dans l'établissement d'infections persistantes[3]. Parmi les sécrétions de P. aeruginosa, on trouve donc des protéines (élastase et protéase) qui détruisent l'intégrité des tissus de l'hôte en dégradant leurs protéines telles que l'élastine, le collagène et les transférines[4],[5]. On trouve aussi des toxines de poids moléculaire faible comme la pyocyanine, affectant différents types de sites dans la cellule hôte[6],[7].
P. aeruginosa cause également de la corrosion microbienne dans le diesel et le carburant d'aviation (microorganismes utilisant l'hydrocarbone). Il crée des masses gélatineuses sombres parfois appelées à tort « algues ».
Chez les plantes, P. aeruginosa induit des symptômes de pourriture molle (soft rot) chez l'arabette des dames (Arabidopsis thaliana) et la laitue (Lactuca sativa) [8],[9]. C'est un agent pathogène puissant chez Arabidopsis[10] et chez certains animaux : Caenorhabditis elegans[11],[12], Drosophila[13] et Galleria mellonella[14]. Les associations de facteurs de virulence sont les mêmes pour les infections végétales et animales[15],[8].
Identification de la souche
Ce sont des bacilles Gram -, souvent isolés à ciliature polaire. Cette bactérie possède l'oxydase.
- Elle est de type respiratoire A.S.
- VAG oxydative.
- Elle est nitrate réductase +++.
- Glucose -.
- Elle ne produit pas d'H2S.
- Elle utilise le mannitol.[réf. nécessaire]
- Elle utilise l'ion citrate comme seule source de carbone.
- Elle est gélatinase +.
- ADH+, Uréase+, Indole-, TDA-.
Des milieux d'isolements comme Muller-Hinton ou Cetrimide, sont aussi utilisés. Sur Muller-Hinton, la production de fluorescéine (pigment coloré diffusible de couleur verte) par la bactérie est observable. Sur Cetrimide, la production de la pyocyanine (pigment coloré diffusible de couleur bleu) par la bactérie peut être vue, comme la résistance au cétrimide (antiseptique) et à l'acide nalidixique (antibiotique).
Des tests King A et King B peuvent être également pratiqués pour voir la production de pyocyanine et de fluorescéine respectivement.
Matrice d'identification des Pseudomonas aeruginosa et fluorescens
-1= négatif ou absence, caractère absent; 1= positif ou présence, caractère présent; 0 ou espace libre = caractère variable ou absence d'information
| Genre | Espèce | Sous-type / Observations | Oxydase | 42 °C (thermophile) | 4 °C (cryophile) | ng A (pour pyoverdine)i | ng B (pour pyocyanine)i | Autre pigment | Poly-Beta-Hydroxy-Butyrate | Mobilité | ADH = L-Arginin DeHydrogenase | NO3 Nitrate réductase (incolor) > Nitrites (rouge) | Gélatinase = Collagénase | Amylase = Amidon Hydrolase | Lécithinase = réaction au jaune d'œuf | Lipase (hydrolyse de Tween80) | NO2 > N2 | Cathécol ortho-clivage | Procathénuate ortho-clivage | Procathénuate méta-clivage | Lévane (méta-clivage) production à partir du saccharose | D-Glucose assimilation | D-Tréhalose assimilation | Saccharose assimilation | Propionate assimilation | Butyrate assimilation | D-Sorbitol assimilation | Adonitol assimilation | Méso-Inositol assimilation | Géraniol assimilation | L-Valine assimilation | D-Alanine assimilation | L-Arginine assimilation | Arginine | Bile-Esculin Hydrolyse = (beta-glucosidase) | Citrate (de Simmons) | Citrate trisodique assimilation | D-Glucose fermentation | D-Glucose assimilation |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pseudomonas | sp | 0,99 | 0,9 | -0,68 | -1 | -1 | -1 | -0,86 | |||||||||||||||||||||||||||||||
| Pseudomonas | aeruginosa | 0,97 | 0,9 | -1 | 0,9 | 0,9 | pyomélanine = brun noir ou acajou; pyorubine = aeruginosine A = rouge de nature phénazinique | -1 | 0,94 | 0,7 | 0,92 | 0,84 | -0,9 | -0,9 | 0,1 | 0,9 | 0,9 | 0,9 | -0,9 | -0,9 | 0,98 | -1 | -1 | 0,9 | 0,9 | -0,9 | -1 | -0,9 | 0,9 | 0,1 | 0,9 | 0,9 | -0,98 | 0,98 | -0,38 | 0,98 | |||
| Pseudomonas | fluorescens | I | 0,99 | -1 | 0,98 | 0,9 | -0,9 | -0,9 | -0,9 | 1 | 0,35 | -0,46 | 0,4 | -0,9 | 0,9 | 0,1 | 0,9 | 0,9 | 0,9 | -0,9 | 0,9 | 0,98 | 1 | 0,9 | 0,9 | -0,9 | 0,01 | 0,01 | 0,9 | -0,9 | 0,9 | 0,9 | 0,9 | -0,98 | 0,98 | -0,75 | 0,98 | ||
| Pseudomonas | fluorescens | II | 0,99 | -1 | 0,98 | 0,1 | -0,9 | -0,9 | -0,9 | 0,9 | 0,9 | -0,46 | 0,6 | -0,9 | 0,3 | -0,9 | 0,9 | 0,9 | 0,9 | -0,9 | 0,9 | 0,9 | 1 | 0,9 | 0,9 | 0,1 | 1 | -1 | 0,9 | -0,9 | 0,9 | 0,9 | 0,9 | -0,98 | 0,98 | -0,75 | 0,9 | ||
| Pseudomonas | fluorescens | III | 0,99 | -1 | 0,98 | 0,9 | -0,9 | -0,9 | -0,9 | 0,9 | 0,9 | -0,46 | -0,22 | -0,9 | 0,9 | 0,1 | 0,9 | 0,9 | 0,9 | -0,9 | -0,9 | 0,9 | 1 | -0,9 | 0,1 | 0,1 | 0,1 | 0,1 | 0,9 | -0,9 | 0,9 | 0,9 | 0,9 | -0,98 | 0,98 | -0,75 | 0,9 | ||
| Pseudomonas | fluorescens | IV | 0,99 | -1 | 0,98 | 0,9 | -0,9 | -0,9 | -0,9 | 0,9 | 0,9 | -0,46 | 0,9 | -0,89 | 0,9 | 0,1 | 0,9 | 0,9 | 0,9 | -0,9 | 0,9 | 0,9 | 1 | 0,9 | 0,9 | 0,9 | 0,9 | -0,9 | 0,9 | -0,9 | 1 | 1 | 1 | -0,98 | 0,98 | -0,75 | 0,9 | ||
| Pseudomonas | fluorescens | V | 0,99 | -1 | 0,5 | 0,1 | -0,9 | -0,9 | -0,9 | 0,9 | 0,9 | -0,46 | 0,9 | -0,9 | 0,1 | 0,1 | 0,9 | 0,9 | 0,9 | -0,9 | -0,9 | 0,98 | 1 | 0,1 | 0,9 | 0,1 | 0,1 | 0,2 | 0,9 | -0,9 | 0,9 | -0,9 | 0,9 | -0,98 | 0,98 | -0,75 | 0,98 |
Traitements
Antibiotiques et antibiorésistance
P. aeruginosa est une bactérie robuste, naturellement très résistante aux antibiotiques et s'adaptant rapidement aux attaques médicamenteuses.
Sans sélection ni renforcement par des antibiothérapies antérieures, elle ne sera souvent sensible qu'à quelques antibiotiques : ticarcilline avec acide clavulanique, gentamicine, ciprofloxacine, ceftazidime, et pipéracilline seule ou avec ajout de tazobactam et acide borique. En 2008, les fluoroquinolones, la gentamicine ou l'imipénem sont encore efficaces, mais uniquement sur quelques souches bactériennes[16].
Si le patient a récemment reçu plusieurs antibiotiques, la bactérie sera vraisemblablement encore plus résistante et d'autant plus dangereuse. Cette antibiorésistance a été partiellement attribuée à des « pompes d'efflux » dans son biofilm, expulsant activement les composants antimicrobiens[17],[18],[19]. P aeruginosa est également connue pour s'attaquer aux protéines duox[20],[21], composé de base du système de défense du poumon.
La Colistine est le médicament de dernier recours face à des germes multi-résistants aux antibiotiques tels que Pseudomonas aeruginosa.
Bactériophagiques
Dans les anciennes républiques soviétiques, ainsi qu'en Pologne, la phagothérapie est couramment utilisée contre Pseudomonas aeruginosa. Les bactériophagiques contre P. aeruginosa se présentent sous forme de cocktail liquide de phages propres à attaquer la bactérie. Pseudomonas aeruginosa est généralement une des cibles des cocktails de phages à large spectre bactérien disponibles dans ces pays (Pyobactériophage, Intestibactériophage). En Russie la société Microgen commercialise un bactériophagique spécifique à Pseudomonas aeruginosa[22].
Les bons résultats obtenus ont attiré l'attention des occidentaux et de nombreux projets de recherche sur l'utilisation des bactériophages contre Pseudomonas aeruginos sont en cours tant en Amérique qu'en Europe, dont le projet Phagoburn sur les grands brûlés[23],[24],[25] et le projet PneumoPhage pour les infections respiratoires[26].
Confrontés à des situations d'impasses thérapeutiques, des patients victimes d'infection par P. aeruginosa multi-résistante se regroupent pour faciliter l'accès aux traitements bactériophagiques étrangers[27],[28],[29].
Le premier bactériophagique contre P. aeruginosa à apparaître dans les sites de référencement des médicaments français est le P. aeruginosa PHAGE PP113 de Pherecydes Pharma, disponible uniquement sur ATUn[30].
Contagion
Cette bactérie semble pouvoir être facilement véhiculée par l'eau, par l'air et par des particules (poussières) ou surfaces contaminées (fomites). La facilité de la contagion s'explique par son caractère ubiquiste, et – en milieu hospitalier – par le fait qu'elle peut facilement transférer ou acquérir des gènes de « résistance antibiotique » à partir d'autres bactéries de souches proches, mais aussi d'espèces plus éloignées[31].
Son milieu de développement : le biofilm

P. aeruginosa, comme certaines autres bactéries gram-négatives, se développe sous forme d'agrégats structurés appelés biofilms[32], où ses cellules sont enrobées d'une matrice composée de polymères extracellulaires complexes. Ces biofilms forment une barrière physique contre l'entrée d'agents antimicrobiens[33],[32], et sont partiellement responsables des infections des poumons persistantes par P. aeruginosa chez les patients immunocompromis atteints de mucoviscidose[33],[34],[35],[36]. La formation du et par le biofilm est contrôlée par des signaux de cellule-à-cellule, et des mécanismes contrôlés par le quorum sensing[37],[34],[38],[39],[40] basés sur la notion de « perception du quota » (quorum sensing) et de « masse critique » : la nature et donc la fonction des molécules signalant les échanges de cellule-à-cellule changent à partir d'une concentration donnée des bactéries. Les bactéries présentes dans un biofilm sont moins actives métaboliquement donc moins réceptives aux agents antimicrobiens[41] et aux disruptions environnementales[32]. Le biofilm joue un rôle actif dans le processus de communication entre cellules bactériennes.
La lactoferrine, présente dans la muqueuse, diminue la formation de biofilm chez P. aeruginosa, ce qui peut protéger contre les infections persistantes[35]. Des recherches sont faites pour des traitements par la déstructuration des biofilms, l'inhibition des facteurs de virulence connus par la dégradation des enzymes messagers, et la régulation de gènes guidant les signaux intercellulaires et les mécanismes de quorum sensing[42],[43],[44],[45],[46].
P. aeruginosa et acide salicylique
L'acide salicylique est un métabolite phénolique produit par les plantes. Il joue un rôle notamment dans l'induction de réponse de défense des plantes contre des attaques pathogènes. Travaillant avec les plantes Arabidopsis thaliana et avec les animaux Caenorhabditis elegans, Cryz et al. (1984)[3] ont montré que des Arabidopsis t. génétiquement modifiées (lox2 et cpr5-2) pour produire plus d'acide salicylique, réduisent la formation et l'attachement du biofilm fait par P. aeruginosa PA14 sur leurs racines. Le même effet a été démontré avec des Arabidopsis sauvages amendées avec de l'acide salicylique (ce qui augmente la concentration interne de cet acide dans la plante).
L'acide salicylique affecte trois facteurs de virulence connus de PA14 : la pyocyanine, la protéase, et l'élastase. P. aeruginosa produit plus de pyocyanine lorsque l'hôte est manipulé génétiquement (lignée transgénique NahG) pour accumuler moins d'acide salicylique que la plante naturelle. L'acide salycilique inhibe donc la synthèse et la sécrétion de la pyocyanine in vivo.
Des cellules de P. aeruginosa développées dans une culture de peptone-tryptic soja montrent une réduction par 50 % de l'activité de l'élastase et de la protéase si on y ajoute de l'acide salicylique ou des dérivés : acide acétyl-salicylique, salicylamide, acide méthyl salicylique; ou encore de l'acide benzoïque, un précurseur métabolique de l'acide salicylique.
De l'acide salicylique ajouté à des pelouses infectées par P. aeruginosa a diminué de façon significative la capacité de ce dernier à tuer les vers, sans diminuer l'accumulation des bactéries dans l'intestin des nématodes. L'acide salicylique agirait donc directement sur P. aeruginosa, diminuant les facteurs de virulence de la bactérie.
Analysé par [microarray], on voit que l'acide salicylique affecte l'expression physiologique de 331 gènes chez P. aeruginosa, réprimant sélectivement la transcription d'exoprotéines et autres facteurs de virulence, diminuant ainsi sa virulence sans pour autant en affecter les gènes d'entretien. Ceci s'ajoute à son rôle connu comme molécule signal pour l'activation du système défensif de la plante.
Seuils ou valeurs limites

- L'arrêté[47] du 14 mars 2007 relatif aux critères de qualité des eaux conditionnées, aux traitements et mentions d'étiquetage particuliers des eaux minérales naturelles et de source conditionnées ainsi que de l'eau minérale naturelle distribuée en buvette publique impose pour Pseudomonas aeruginosa un nombre de zéro bactéries par 250 ml à l'émergence et au cours de la commercialisation (analyses à commencer au moins trois jours après le prélèvement au captage, le conditionnement, avec échantillons conservés à température) ambiante.
Infection à Pseudomonas aeruginosa
Il est possible de contracter une infection humaine à Pseudomonas aeruginosa. Il s'agit en général d'un germe hospitalier responsable d'infections nosocomiales, mais il se rencontre également en ambulatoire chez les patients atteints de mucoviscidose. Il peut aussi être isolé du conduit auditif externe lors d'otites externe.
Pseudomonas aeruginosa est résistant à un grand nombre d'antibiotiques. Il ne faut donc jamais les traiter en monothérapie. Les antibiotiques actifs contre P. aeruginosa[48] sont les carbapénèmes, certaines fluoroquinolones (la ciprofloxacine à forte dose en est un exemple), certaines pénicillines (piperacilline-tazobactam) ainsi que des céphalosporines de troisième génération (par exemple la ceftazidime)
.
Recherche
Un projet AEROPATH [49] vise à développer des antibiotiques efficaces contre les « superbactéries » antibiorésistantes aux traitement multi-médicamenteux entretenant des épidémies nosocomiales, et Pseudomonas aeruginosa est au centre de ce travail qui se fera en étudiant et modélisant aussi les points faibles du métabolisme et des protéines de P. aeruginosa et de souches nosocomiales de stenotrophomonas et d’acinetobacter, y compris via l’étude de leurs génomes.
D’autres cherchent des traitements alternatifs (ensemencement avec une souche microbienne peu dangereuse qui occuperait l’espace sans laisser la place aux pseudomonas, soit de l'écologie microbienne). Enfin, il existe d'autres approches du type de l'asticothérapie, etc.
Notes et références
- [PDF] S. Mans, Dr S. Canouet, « Pseudomonas aeruginosa : Une histoire d'eau », sur www.cclin-sudouest.com, Centre de coordination de la lutte contre les infections nosocomiales du Sud-Ouest, (consulté le 5 novembre 2013)
- Parfois le germe n'a pas de pyocyanine ni même de fluorescéine caractéristique du groupe fluorescent → ne pas se baser uniquement sur l'aspect de la culture ; pour la croissance à 42 °C, il faut toujours faire un bouillon témoin à 37 °C, car la souche peut être morte et, sans témoin, on pourrait croire que le test de croissance à 42 °C est négatif alors qu'en fait le germe est mort.
- , Cryz, S. J., Jr., T. L. Pitt, E. Furer, et R. Germanier, 1984, Role of lipopolysaccharide in virulence of Pseudomonas aeruginosa. Infect. Immun. 44:508-513
- Aumercier, M., D. M. Murray, et J. L. Rosner, 1990, Potentiation of susceptibility to aminoglycosides by salicylates in Escherichia coli. Antimicrob. Agents Chemother, 23:835-845
- Kawaharajo, K., J. Y. Homma, Y. Aoyama, K. Okada, K. Morihara, 1975, Effects of protease and elastase from Pseudomonas aeruginosa on skin. Jpn. J. Exp. Med. 45:79-88
- Lau, G. W., H. Ran, F. Kong, D. J. Hassett, et D. Mavrodi, 2004, Pseudomonas aeruginosa pyocyanin is critical for lung infection in mice. Infect. Immun. 72:4275-4278
- Ran, H., D. J. Hassett, et G. W. Lau, 2003, Human targets of Pseudomonas aeruginosa pyocyanin. Proc. Natl. Acad. Sci. USA 100:14315-14320
- Rahme, L., E. Stevens, S. Wolfort, J. Shao, R. Tompkins, et F. M. Ausubel. 1995. Common virulence factors for bacterial pathogenicity in plants and animals. Science 268:1899-1902
- Rahme, L. G., M-W. Tan, L. Le, S. M. Wong, R. G. Tompkins, S. B. Calderwood, et F. M. Ausubel, 1997, Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc. Natl. Acad. Sci. USA 94:13245-13250
- Walker, T. S., H. P. Bais, E. Déziel, H. P. Schweizer, L. G. Rahme, R. Fall, et J. M. Vivanco. 2004. Pseudomonas aeruginosa-plant root interactions. Pathogenicity, biofilm formation, and root exudation. Plant Physiol. 134:320-331
- Mahajan-Miklos, S., M. W. Tan, L. G. Rahme, et F. M. Ausubel. 1999. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabdititis elegans pathogenesis model. Cell 96:47-56
- Martinez, C., E. Pons, G. Prats, et J. Leon. 2004. Salicylic acid regulates flowering time and links defense responses and reproductive development. Plant J. 37:209-217
- D'Argenio, D. A., L. A. Gallagher, C. A. Berg, et C. Manoil. 2001. Drosophila as a model host for Pseudomonas aeruginosa infection. J. Bacteriol. 183:1466-1471
- Miyata, S., M. Casey, D. W. Frank, F. M. Ausubel, et E. Drenkard.,2003, Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect. Immun. 71:2404-2413
- Rahme, L. G., F. M. Ausubel, H. Cao, E. Drenkard, B. C. Goumnerov, G. W. Lau, S. Mahajan-Miklos, J. Plotnikova, M. W. Tan, J. Tsongalis, C. L. Walendziewicz, et R. G. Tompkins, 2000, Plants and animals share functionally common bacterial virulence factors. Proc. Natl. Acad. Sci. USA 97:8815-8821
- Communiqué Cordis, Europe, novembre 2008
- Aeschlimann, J. R. 2003, The role of multidrug efflux pumps in the antibiotic resistance of Pseudomonas aeruginosa and other Gram-negative bacteria: insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy 23:916-924
- De Kievit, T. R., M. D. Parkins, R. J. Gillis, R. Srikumar, H. Ceri, K. Poole, B. H. Iglewski, et D. G. Storey, 2001, Multidrug efflux pumps: expression patterns and contribution to antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob. Agents Chemother. 45:1761-1770
- Poole, K. 2001, Multidrug efflux pumps and antimicrobial resistance in Pseudomonas aeruginosa and related organisms. J. Mol. Microbiol. Biotechnol. 3:255-264
- Rada B, Lekstrom K, Damian S, Dupuy C, Leto TL. The Pseudomonas toxin pyocyanin inhibits the dual oxidase-based antimicrobial system as it imposes oxidative stress on airway epithelial cells. J Immunol. 2008 Oct 1;181(7):4883-93. http://www.jimmunol.org/cgi/reprint/181/7/4883
- Rada B, Leto TL. Redox warfare between airway epithelial cells and Pseudomonas: dual oxidase versus pyocyanin. Immunol. Res. 2008. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2776630/pdf/nihms-156213.pdf
- (ru) « Бактериофаг псевдомонас аеругиноза (синегнойный) », sur bacteriofag.ru
- Elaine M. Waters, Daniel R. Neill, Basak Kaman et Jaspreet S. Sahota, « Phage therapy is highly effective against chronic lung infections with Pseudomonas aeruginosa », Thorax, vol. 72, no 7, , p. 666–667 (ISSN 1468-3296, PMID 28265031, PMCID PMC5520275, DOI 10.1136/thoraxjnl-2016-209265, lire en ligne)
- Anne Jeanblanc, « Des bactériophages contre la résistance aux antibiotiques », Le Point, (lire en ligne)
- « European Commission : CORDIS : Projects and Results : Final Report Summary - PHAGOBURN (Evaluation of phage therapy for the treatment of Escherichia coli and Pseudomonas aeruginosa burn wound infections (Phase I-II clinical trial)) », sur cordis.europa.eu (consulté le 23 avril 2018)
- « http://www.pherecydes-pharma.com/pneumophage.html », sur www.pherecydes-pharma.com (consulté le 26 avril 2018)
- « Phages-Sans-Frontières – Ensemble nous pouvons tenter de changer le destin ! », sur phages-sans-frontieres.com (consulté le 24 avril 2018)
- « EuroPhages - Sauver les vies de milliers de Français grâce aux bactériophagiques », sur EuroPhages (consulté le 24 avril 2018)
- « Association PHAG ESPOIRS », sur Association PHAG ESPOIRS (consulté le 24 avril 2018)
- « P.AERUGINOSA PHAGE PP1131 Solution pour usage local », sur doctissimo.fr
- Pr Gunter Schneider, de l'institut Karolinska, dans le communiqué Cordis déjà cité de nov. 2008
- G.A. O'Toole, L.A. Pratt, P.I. Watnick, D.K. Newman, V.B. Weaver et R. Kolter, « Genetic approaches to study of biofilms », Methods Enzymol., vol. 310, , p. 91-109 (DOI 10.1016/S0076-6879(99)10008-9)
- Costerton, J. W., 2001, Cystic fibrosis pathogenesis and the role of biofilms in persistent infection. Trends Microbiol. 9:50-52
- Hall-Stoodley, L., J. W. Costerton, et P. Stoodley, 2004, Bacterial biofilms: from the natural environment to infectious diseases. Nat. Rev. Microbiol. 2:95-108
- Singh, P. K., M. R. Parsek, E. P. Greenberg, et M. J. Welsh, 2002, A component of innate immunity prevents bacterial biofilm development. Nature 417:552-555
- Singh, P. K., A. L. Schaefer, M. R. Parsek, T. O. Moninger, M. J. Welsh, et E. P. Greenberg. 2000. Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms. Nature 407:762-764
- Davies, D. G., M. R. Parsek, J. P. Pearson, B. H. Iglewski, J. W. Costerton, et E. P. Greenberg, 1998, The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science 280:295-298
- Mah, T.-F., B. Pitts, B. Pellock, G. C. Walker, P. S. Stewart, et G. A. O'Toole, 2003, A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature 426:306-310
- Parsek, M. R., et P. K. Singh, 2003, Bacterial biofilms: an emerging link to disease pathogenesis. Annu. Rev. Microbiol. 57:677-701
- Smith, R. S., et B. H. Iglewski, 2003, P. aeruginosa quorum sensing systems and virulence. Curr. Opin. Microbiol. 6:56-60
- Drenkard, E. 2003, Antimicrobial resistance of Pseudomonas aeruginosa biofilms. Microb. Infect. 5:1213-1219
- Hentzer, M., et M. Givskov, 2003, Pharmacological inhibition of quorum sensing for the treatment of chronic bacterial infections. J. Clin. Invest. 112:1300-1307
- Hentzer, M., L. Eberl, J. Nielsen, et M. Givskov. 2003. Quorum sensing: a novel target for the treatment of biofilm infections. BioDrugs 17:241-250
- Hentzer, M., M. Givskov, et L. Eberl. 2004. Quorum sensing in biofilms: gossip in slime city. Microb. Biofilms 1:118-140
- Hentzer, M., H. Wu, J. B. Andersen, K. Riedel, T. B. Rasmussen, N. Bagge, N. Kumar, M. A. Schembri, Z. Song, P. Kristoffersen, M. Manefield, J. W. Costerton, S. Molin, L. Eberl, P. Steinberg, S. Kjelleberg, N. Hoiby, et M. Givskov, 2003, Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors. EMBO J. 22:3803-3815
- Wu, H., Z. Song, M. Hentzer, J. B. Andersen, S. Molin, M. Givskov, et N. Hoiby. 2004. Synthetic furanones inhibit quorum-sensing and enhance bacterial clearance in Pseudomonas aeruginosa lung infection in mice. J. Antimicrob. Chemother. 53:1054-1061
- Arrêté du 14 mars 2007 relatif aux critères de qualité des eaux conditionnées, aux traitements et mentions d'étiquetage particuliers des eaux minérales naturelles et de source conditionnées, ainsi que de l'eau minérale naturelle distribuée en buvette publique, JO n° 81 du 5 avril 2007 page 6431
- PharmaWiki.ch
- Projet coordonné par l’université de Dundee (Royaume-Uni), avec des équipes allemandes, anglaises et suédoises, financé par l’UE à hauteur (en 2008) de 4,6 millions d'euros, via le septième programme-cadre (7e PC)
- Portail de la microbiologie
- Portail de la médecine