Biochimie
La biochimie est l'étude des réactions chimiques qui se déroulent au sein des êtres vivants, et notamment dans les cellules. La complexité des processus chimiques biologiques est contrôlée à travers la signalisation cellulaire et les transferts d'énergie au cours du métabolisme. Depuis un demi-siècle, la biochimie est parvenue à rendre compte d'un nombre considérable de processus biologiques, au point que pratiquement tous les domaines de la biologie, depuis la botanique jusqu'à la médecine, sont aujourd'hui engagés dans la recherche biochimique, voire biotechnologique. L'objectif principal de la biochimie de nos jours est de comprendre, en intégrant les données obtenues au niveau moléculaire, comment les biomolécules et leurs interactions génèrent les structures et les processus biologiques observés dans les cellules, ouvrant la voie à la compréhension des organismes dans leur ensemble. Dans ce cadre, la chimie supramoléculaire s'intéresse aux complexes moléculaires tels que les organites, qui constituent un niveau d'organisation de la matière vivante intermédiaire entre les molécules et les cellules.


La biochimie s'intéresse en particulier aux structures, aux fonctions et aux interactions des macromolécules biologiques telles que les glucides, les lipides, les protéines et les acides nucléiques, qui constituent les structures cellulaires et réalisent de nombreuses fonctions biologiques. La chimie cellulaire dépend également de molécules plus petites et d'ions. Ces derniers peuvent être inorganiques, par exemple l'ion hydronium H3O+, l'hydroxyle OH– ou des cations métalliques, ou bien organiques, comme les acides aminés qui constituent les protéines. Ces espèces chimiques sont essentiellement constituées d'hydrogène, de carbone, d'oxygène et d'azote ; les lipides et les acides nucléiques contiennent en plus du phosphore, tandis que les protéines contiennent du soufre et que les ions et certains cofacteurs sont constitués ou comprennent des oligoéléments tels que le fer, le cobalt, le cuivre, le zinc, le molybdène, l'iode, le brome et le sélénium.
Les résultats de la biochimie trouvent des applications dans de nombreux domaines tels que la médecine, la diététique ou encore l'agriculture ; en médecine, les biochimistes étudient les causes des maladies et les traitements susceptibles de les soigner ; les nutritionnistes utilisent les résultats de la biochimie pour concevoir des régimes alimentaires sains tandis que la compréhension des mécanismes biochimiques permet de comprendre les effets des carences alimentaires ; appliquée à l'agronomie, la biochimie permet de concevoir des engrais adaptés aux différents types de cultures et de sols ainsi que d'optimiser le rendement des cultures, le stockage des récoltes et l'élimination des parasites.
On prête à Carl Neuberg l'introduction de ce terme en 1903 à partir de racines grecques, mais ce terme circulait déjà en Europe depuis la fin du XIXe siècle. Avec la biologie moléculaire et la biologie cellulaire, la biochimie est l'une des disciplines qui étudient le fonctionnement du vivant. Elle recouvre elle-même plusieurs branches, telles que la bioénergétique, qui étudie les transferts d'énergie chimique au sein des êtres vivants, l'enzymologie, qui étudie les enzymes et les réactions qu'elles catalysent, ou encore la biologie structurale, qui s'intéresse aux relations entre les fonctions biochimiques des molécules et leur structure tridimensionnelle.
Éléments chimiques du vivant
Environ 25 éléments chimiques sur les 92 éléments naturels de la classification périodique sont nécessaires à différentes formes de vie. Les éléments présents à l'état de traces dans le milieu naturel ne sont généralement pas utilisés par les êtres vivants, à l'exception notable de l'iode et du sélénium, tandis que certains éléments abondants tels que l'aluminium ou le titane ne sont pas nécessaires à la vie. La plupart des organismes utilisent les mêmes éléments chimiques, mais il existe quelques différences chez les plantes et les animaux. Par exemple, certaines algues océaniques utilisent le brome tandis que les plantes terrestres et les animaux ne semblent pas en avoir besoin. Tous les animaux ont besoin de sodium, mais certaines plantes s'en dispensent. En revanche, les plantes ont besoin de bore et de silicium pour se développer, tandis que les animaux ne semblent pas en faire usage.
La masse du corps humain est constituée approximativement à 65 % d'oxygène et à 98,5 % de seulement six éléments chimiques[1],[2],[3],[4],[5],[6] : outre l'oxygène, ce sont environ 18 % de carbone, 10 % d'hydrogène, 3 % d'azote, 1,4 % de calcium et 1,1 % de phosphore. On compte également des quantités plus faibles de potassium, soufre, sodium, chlore, magnésium, fer, fluor, zinc, silicium et d'une douzaine d'autres éléments, qui ne sont pas tous nécessaires à la vie[7].
Biomolécules
Les quatre classes principales de molécules biochimiques, également appelées biomolécules, sont les glucides, les lipides, les protéines et les acides nucléiques. De nombreuses macromolécules biochimiques sont des polymères, constitués de l'assemblage d'unités plus petites appelées monomères ; ces monomères sont de petites molécules qu'il est possible de libérer du biopolymère par hydrolyse. Plusieurs de ces biomolécules sont susceptibles de former des complexes moléculaires de grande taille qui assurent souvent des fonctions biochimiques indispensables à la vie de la cellule.
Glucides

Les glucides sont constitués de monomères appelés oses. Le glucose, le fructose et le galactose sont des oses. Ces derniers sont classés en fonction du nombre de leurs atomes de carbone : trioses en C3, tétroses en C4, pentoses en C5, hexoses en C6, heptoses en C7.
D'un point de vue chimique, on distingue d'une part les aldoses, qui sont composés d'une chaîne d'alcools secondaires ayant à une extrémité un groupe aldéhyde, et d'autre part les cétoses, qui possèdent une fonction cétone dans leur chaîne carbonée, les autres atomes de carbone étant porteurs d'une fonction alcool primaire ou secondaire selon la position.
Les oses jouent un rôle majeur dans le métabolisme énergétique de la cellule, mais aussi dans la biosynthèse des acides nucléiques, des cérébrosides et des glycoprotéines. Ils peuvent également intervenir dans certains mécanismes de détoxication, par exemple à travers la glycuroconjugaison.
Deux oses peuvent s'unir à travers une liaison osidique pour former un diholoside : le saccharose est un diholoside constitué d'un résidu de glucose d'un résidu de fructose unis par une liaison osidique (1→2) ; le lactose en est un autre constitué d'un résidu de lactose et d'un résidu de glucose unis par une liaison osidique β(1→4). Au-delà de deux résidus, on parle d'oligosaccharides jusqu'à dix résidus et de polysaccharides au-delà : sont des biopolymères constitués plusieurs résidus osidiques d'oses qui interviennent dans le stockage de l'énergie (amidon, glycogène) et dans la rigidité de certains organismes (cellulose, chitine).
Chez les bactéries, les glucides constituent selon les cas l'essentiel du peptidoglycane ou du lipopolysaccharide de la paroi bactérienne. Ils sont responsables des réactions immunitaires de l'organisme exposé à ces bactéries. Ce sont également des déterminants antigéniques, ou épitopes, importants à la surface des cellules d'eucaryotes. Ils déterminent les groupes sanguins et sont une part importante du complexe majeur d'histocompatibilité, ou CMH.
Quelques exemples de glucides :
- le glycéraldéhyde est l'ose le plus simple dans la classe des aldoses, c'est un aldotriose (C3). De même pour la dihydroxyacétone dans la classe des cétoses (cétotriose). Le ribose est un aldopentose (C5) qui entre dans la composition des acides nucléiques ;
- le glucose (« gluco », du grec glukus, saveur sucrée) est un aldohexose de formule C6H12O6. On le trouve dans les fruits mûrs, le nectar des fleurs, la sève, le sang et certains sirops ;
- le fructose (du latin fructus, fruit) appelé aussi lévulose, est un cétohexose. On le rencontre dans les fruits, le miel, dans certaines boissons sucrées et dans les sécrétions séminales ;
- le saccharose (du grec sakkharon, sucre) de formule C12H22O11 est un disaccharide qui donne par hydrolyse du glucose et du fructose. On le trouve dans la plupart des végétaux et en particulier dans la betterave sucrière, la canne à sucre ;
- le maltose est un disaccharide qui donne par hydrolyse deux molécules de glucose ;
- le lactose est un disaccharide qui donne par hydrolyse un glucose et un β-galactose. On trouve le lactose notamment dans le lait et les produits laitiers.
- Formules cycliques du glucose, fructose et saccharose

 Fructose.
Fructose. Saccharose.
Saccharose.
Lipides

Définition
Les lipides, du grec « lipos » (« graisse »), constituent une classe assez hétérogène de molécules. Sont regroupées sous cette dénomination les molécules ayant un caractère hydrophobe marqué, c'est-à-dire très peu solubles dans l'eau mais solubles dans la plupart des solvants organiques, comme le chloroforme, par exemple. Nous trouvons aussi des lipides dans la cire de bougie, les graisses animales, l'huile d'olive et pratiquement tous les corps gras. La biochimie a complété cette définition en montrant que les lipides possédaient des voies de synthèse communes. Cependant, il n'existe pas encore de définition unique d'un lipide reconnue par l'ensemble de la communauté scientifique. Ceci tient probablement au fait que les lipides forment un ensemble de molécules aux structures et aux fonctions extrêmement variées dans le monde du vivant[8].
D'un point de vue métabolique, les lipides constituent des réserves énergétiques. Les sucres sont par exemple transformés en lipides et stockés dans les cellules adipeuses en cas de consommation supérieure à l'utilisation.
Les lipides, en particulier les phospholipides, constituent l'élément majeur des membranes cellulaires. Ils définissent une séparation entre le milieu intracellulaire et le milieu extracellulaire. Leur caractère hydrophobe rend impossible le passage de molécules polaires ou chargées, comme l'eau et les ions, car ils forment des groupes très compacts issus de liaisons covalentes faibles appelées interaction hydrophobe. Seules voies de passage possible : les protéines membranaires où, par exemple, les ions entrent et sortent de la cellule par le biais de canaux ioniques.
Plusieurs hormones sont des lipides, en général dérivées du cholestérol (progestérone, testostérone, etc.), ce qui permet d'agir comme filtre aux entrées des cellules. Les vitamines liposolubles peuvent aussi être classées parmi les lipides.
Contrairement aux acides nucléiques ou aux protéines, les lipides ne sont pas des macromolécules constituées d'une succession d'unités de base.
Structure et classification
Les lipides peuvent être classés selon la structure de leur squelette carboné (atomes de carbone chaînés, cycliques, présence d'insaturations, etc.)[9] :
- les acides gras : il s'agit d'acides carboxyliques à longue chaîne carbonée pouvant être saturée, insaturée, ramifiée, etc.. Des exemples bien connus sont les oméga-3 et -6, mais aussi les prostaglandines.
Les phospholipides : lipides qui constituent la membrane cellulaire permettant le passage de certains minéraux ;
- les glycérides et phosphoglycérides : ces lipides sont formés par estérification d'un glycérol et d'un à trois acides gras (ou mono-, di- et triglycérides). Dans le cas des phosphoglycérides, l'estérification se fait avec glycérol, un ou deux acides gras et un phosphate[10]. Le groupe phosphate peut à son tour subir une estérification par différents composés hydroxylés comme la choline ou la sérine, donnant respectivement de la phosphatidylcholine et de la phosphatidylsérine. Il est à noter que glycérides et phosphoglycérides sont appelés de façon plus exacte acylglycérols et glycérophospholipides respectivement ;
- les sphingolipides : ces lipides résultent de l'estérification puis de l'amidification de la sérine par deux acides gras. Une sous-classe bien connue de sphingolipides est celle des céramides ;
- les stérols : les stérols sont des lipides possédant une chaîne carbonée plusieurs fois cyclisée. Ils ne sont donc pas linéaires comme les acides gras. Des exemples bien connus de stérols sont le cholestérol, la vitamine D et les hormones stéroïdiennes (testostérone, œstrogènes, cortisone) ;
- les prénols : il s'agit de lipides dérivant de l'isoprène, par exemple les vitamines E et K ou le β-carotène ;
- les polykétides : ils forment une gamme très vaste de composés naturels dont sont dérivés de nombreux antibiotiques comme les macrolides ;
- les saccharolipides : ils résultent de l'estérification et/ou de l'amidification de sucres et d'acides gras. L'exemple le plus connu de saccharolipide est sans doute le lipopolysaccharide.
Pour des raisons pratiques et historiques, acylglycérols et phosphoglycérides sont souvent considérés comme deux catégories différentes, de même que phosphoglycérides et phosphosphingolipides peuvent être regroupés sous l'appellation de phospholipides[11].
- Quelques exemples de lipides
 Acide gras insaturé.
Acide gras insaturé. Triacylglycérol.
Triacylglycérol. Phosphoglycéride.
Phosphoglycéride. Céramide.
Céramide.


 Saccharolipide précurseur du lipopolysaccharide.
Saccharolipide précurseur du lipopolysaccharide.
Protéines (protides)

Les protéines (du grec prôtos, premier) sont des polymères composés d'une combinaison de quelque 20 acides aminés. La plupart des protéines sont formées de l'union de plus de 100 acides aminés (résidus) reliés entre eux par des liaisons peptidiques. Pour un nombre moins important de résidus on parle de peptides (< 50 résidus) et de polypeptides (≥ 50 résidus).
Acides aminés
Les acides aminés (« amin » du grec ammôniakos, ammoniac) sont des composés organiques azotés qui possèdent une formule générale du type :
L'atome de carbone central Cα (carbone alpha) est relié à un groupe amine (NH2-), à un groupe carboxyle acide (-COOH) et à une chaîne latérale R variable d'un acide aminé à un autre. Les chaînes latérales (R) peuvent avoir des propriétés différentes, certaines sont hydrophiles, d'autres hydrophobes. Certaines, en solution aqueuse, s'ionisent positivement (basiques) et d'autres négativement (acides) ou restent neutres. Les mammifères possèdent les enzymes nécessaires pour la synthèse de l'alanine, l'asparagine, l'aspartate, la cystéine, le glutamate, la glutamine, la glycine, la proline, la sérine, et la tyrosine. Quant à l'arginine et l'histidine, ils sont produits mais en quantité insuffisante surtout pour les jeunes individus. En revanche, l'isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane, et la valine ne peuvent pas être produits par notre organisme. Pour éviter tout carence, ils doivent être apportés régulièrement par l'alimentation dans les bonnes proportions : ce sont les acides aminés essentiels.
Structure des protéines
Les acides aminés peuvent se lier les uns aux autres par une liaison peptidique au cours de la biosynthèse des protéines dans les ribosomes. La liaison peptidique s'établit entre le carboxyle (COOH) d'un acide aminé et le groupe amine (NH2) de l'autre :
la réaction produit un dipeptide :
Dans la cellule, cette réaction est catalysée par la peptidyltransférase, elle nécessite l'hydrolyse d'ATP (source d'énergie) et la présence d'ions magnésium. Pour chaque liaison formée, une molécule d'eau est formée.
La séquence des acides aminés d'une protéine (l'arrangement et l'ordre des résidus) constitue la structure primaire. Par exemple, pour construire un peptide de 10 résidus à l'aide de la collection de 20 acides aminés, on dispose de 2010. En solution aqueuse, les radicaux possèdent des propriétés chimiques différentes. Certains radicaux peuvent former des liaisons chimiques plus ou moins fortes avec d'autres radicaux de la même chaîne peptidique. Certains se repoussent et d'autres se rapprochent et forment des liens chimiques. La chaîne d'acides aminés aura donc tendance à se replier sur elle-même pour adopter une structure tridimensionnelle précise. Et cette dernière dépend avant tout de la séquence des acides aminés formant la chaîne. En effet, quatre grands types d'interactions interviennent dans le repliement de la chaîne peptidique :
- l'effet hydrophile / hydrophobe ;
- les forces de van der Waals ;
- les liaisons ioniques ;
- les liaisons hydrogène.
Ces quatre premiers types d'interactions sont considérés comme étant faibles (forts lorsque nombreux cependant).
- Les ponts disulfure (liaison covalente entre les atomes de soufre qui relient deux cystéines éloignées l'une de l'autre sur la chaîne). Cela constitue une interaction forte.
Ainsi certaines parties de la chaîne peptidique adoptent une structure régulière appelée structure secondaire. On en reconnaît, selon les angles de torsion des liaisons, trois grands types :
- l'hélice α : la chaîne peptidique prend la forme d'une spirale. Les différentes spires sont stabilisées par des liaisons hydrogène tous les quatre résidus (liaisons hydrogène dites « intracaténaires ») ;
- le feuillet β : il se forme des liaisons hydrogène entre certains segments (brins β) de la chaîne peptidique disposés parallèlement les uns par rapport aux autres (les liaisons hydrogène sont dites « intercaténaires »). L'ensemble forme comme un feuillet plissé ;
- le coude ou « turn » : c'est une structure moins ordonnée qui forme généralement un lien court entre des structures ordonnées (hélice-hélice, feuillet-feuillet ou feuillet-hélice). Une boucle est un lien plus long.
La forme finale de la chaîne peptidique, c’est-à-dire la structure tridimensionnelle qu'adopte la chaîne d'acides aminés, constitue la structure tertiaire de la protéine (voir la figure de la myoglobine en 3D).
Certaines protéines, plus complexes, résultent de l'assemblage des différentes chaînes (monomères) ce qui constitue la structure quaternaire de la protéine. Par exemple, l'hémoglobine est formée de l'association de quatre chaînes peptidiques.
La structure de la protéine peut être dénaturée par plusieurs facteurs, notamment la température, les pH extrêmes et l'augmentation de la force ionique dans le milieu ou par des agents chimiques dénaturants (2-mercaptoéthanol). La dénaturation de la structure 3D d'une protéine a généralement pour conséquence la perte de sa fonction. On parle de « relation structure-fonction ».
Fonctions
Les protéines assurent plusieurs fonctions au sein des cellules et de l'organisme, qui sont à l'essence même de la vie. En voici une liste non exhaustive avec quelques exemples :
- structure et soutien : tubuline, élastine, collagène, kératine ;
- catalyse des réactions biologiques : enzymes ;
- transport et stockage : hémoglobine, ferritine ;
- signalisation et régulation : hormones peptidiques, cytokines ;
- réception et transduction des signaux : récepteurs biologiques ;
- mouvement et motricité : système actine / myosine ;
- identité et défense contre les agressions biologiques : anticorps ;
- protection contre le stress environnemental : les chaperons ;
- détoxification : cytochrome P450, peroxydases, superoxyde dismutase.
- Exemples de quelques protéines
 Immunoglobuline G (anticorps).
Immunoglobuline G (anticorps). Insuline (hormone).
Insuline (hormone). Hémoglobine (protéine respiratoire).
Hémoglobine (protéine respiratoire). Triose-phosphate isomérase (enzyme).
Triose-phosphate isomérase (enzyme).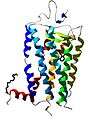 Rhodopsine (récepteur).
Rhodopsine (récepteur). G actine, monomérique.
G actine, monomérique. F actine, polymère (protéine de soutien/ protéine motrice).
F actine, polymère (protéine de soutien/ protéine motrice). Collagène (protéine de soutien).
Collagène (protéine de soutien).
Protéome
Pour un total d’environ 20 000 à 25 000 gènes (génome)[12], on estime à un million le nombre de protéines différentes qui peuvent être produites dans les cellules humaines (protéome)[réf. nécessaire]. Le nombre de protéines produites par le cerveau humain, dont le rôle est essentiel pour son fonctionnement, est estimé à environ 12 000[réf. nécessaire].
Acides nucléiques

Les acides nucléiques ont été isolés initialement des noyaux des cellules eucaryotes (du latin nucleus, noyau). Ce sont des macromolécules comportant des sous-unités appelées nucléotides. On peut en distinguer deux grands types : les acides désoxyribonucléiques (ADN) et les acides ribonucléiques (ARN). L'ADN est le support universel de l'information génétique (sauf pour certains virus). Grâce à deux fonctions catalytiques, cette molécule assure la transmission et l'expression de l'information qu'elle contient :
- la fonction autocatalytique : permet l'autoduplication de l'ADN et assure la transmission de l'information d'une génération à une autre ;
- la fonction hétérocatalytique : gouverne la synthèse protéique. Étant donné que les enzymes sont des protéines et que toutes les synthèses et réactions dépendent d'elles, l'ADN contrôle toute l'organisation et les processus biologiques des cellules et des organismes. Ainsi, l'ADN exprime l'information qu'il comprend.
Structure
Le nucléotide, unité de base des acides nucléiques, comporte trois composants : de l'acide phosphorique, un pentose et une base nucléique :
- l'acide phosphorique (H3PO4) possède trois fonctions acides. Deux de ces fonctions sont estérifiées par deux fonctions alcools portées par les carbones 3' et 5' du pentose. La troisième fonction acide est libre. (On numérote les carbones avec des chiffres accompagnés de l’indication (') pour éviter des confusions avec les numérotations des bases) ;
- le pentose (sucre en C5) : c'est le ribose, présent sous deux formes, le 2'-désoxyribose et le 2'-oxyribose, respectivement dans l'ADN et l'ARN. La liaison pentose-base est une liaison glycosidique. Elle se forme par élimination d'une molécule d'eau entre la base et l'OH semi-acétalique situé sur le carbone 1' de l'ose. L'association pentose-base est appelée nucléoside ;
- les bases nucléiques sont classées en bases pyrimidiques et en bases puriques. Les principales bases pyrimidiques sont : l'uracile (U), la cytosine (C) et la thymine (T). Les principales bases puriques sont : l'adénine (A) et la guanine (G). Les bases puriques et pyrimidiques présentent des formes chimiques interconvertibles appelées formes « tautomères ».

Dans l'ADN bicaténaire, les bases nucléiques des deux brins s'apparient suivant la règle de complémentarité : A apparié avec T, C apparié avec G. Cet appariement est maintenu grâce à des liaisons hydrogène et peut donc être affecté par la chaleur (dénaturation thermique). Par convention, la séquence d'un acide nucléique est orientée dans le sens de l’extrémité 5' (comportant un groupe phosphate) vers l’extrémité 3' qui possède un OH libre. Ainsi, dans l'ADN bicaténaire (double brin), les deux brins sont disposés dans deux sens opposés. Les extrémités 5' et 3' de l'un des brins correspondent aux extrémités 3' et 5' du brin parallèle complémentaire (anti-parallèles). Dans l’espace, les deux chaînes présentent une configuration hélicoïdale. Elles s’enroulent autour d’un axe imaginaire pour constituer une double hélice à rotation droite (dans les formes A et B de l’ADN) ou plus exceptionnellement à rotation gauche (dans la forme Z de l’ADN).
Information génétique
Classiquement, on considère que le gène est une région d'un brin d'ADN dont la séquence code l'information nécessaire à la synthèse d'une protéine. Trois types d'ADN différents constituent le génome (l'ensemble des gènes d'un individu ou d'une espèce) :
- l'ADN « domestique » : représentant environ 75 % du génome, est formé de gènes présents en un seul exemplaire ou en un nombre limité de copies. Toutefois, par extension, ce type d'ADN englobe également certains gènes spécifiques dits à multicopies, comme ceux des ARN ribosomiques ou bien ceux codant les histones. Ces derniers existent sous forme de larges amas de copies (50-10 000 copies) localisés sur un ou plusieurs chromosomes ;
- l'ADN « répétitif et dispersé » (minisatellites et microsatellites) : constitue 15 % du génome et est caractérisé par de courtes séquences nucléotidiques (supérieures à 100 pour les minis), répétées en tandem un très grand nombre de fois (105 - 106 fois), en de nombreuses régions du génome ;
- l'ADN « satellite » : (environ 10 % du génome) est constitué de séquences hautement répétitives, essentiellement localisées dans les régions des centromères et des télomères.
Le génome humain comprend environ 3 milliards de paires de bases représentant près de 30 000 gènes (en fait, dans les estimations récentes, c'est entre 20 000 et 25 000 gènes). Toutefois, il ne semble pas y avoir de relation systématique entre le nombre de paires de bases par génome et le degré de complexité d'un organisme. Ainsi, certaines plantes et organismes amphibiens possèdent un génome comptant plus de 100 milliards de paires de nucléotides, soit 30 fois plus qu'un génome humain. En effet, le génome des cellules eucaryotes semble contenir un large excès d'ADN. Chez les mammifères, moins de 10 % du génome serait utile à l'expression en protéines ou à la régulation de cette expression.
| La séquence complète du gène humain HSMG03 codant l'exon 3 de la myoglobine (taille : 1,2 kb), 3 milliards de ces 4 lettres forment le génome de l'espèce humaine (Homo sapiens). |
|---|
Origine
1 GGTCCTGGAA TAAAGAGAAG GTAGGAGGAC AACTGACTCC CATCTGGCCC CTGGCTTGTC
61 CCACCCTGGT GACCATTTTC TCTCCTCACC CTCCCTGCAG TTCATCTCGG AATGCATCAT
121 CCAGGTTCTG CAGAGCAAGC ATCCCGGGGA CTTTGGTGCT GATGCCCAGG GGGCCATGAA
181 CAAGGCCCTG GAGCTGTTCC GGAAGGACAT GGCCTCCAAC TACAAGGAGC TGGGCTTCCA
241 GGGCTAGGCC CCTGCCGCTC CCACCCCCAC CCATCTGGGC CCCGGGTTCA AGAGAGAGCG
301 GGGTCTGATC TCGTGTAGCC ATATAGAGTT TGCTTCTGAG TGTCTGCTTT GTTTAGTAGA
361 GGTGGGCAGG AGGAGCTGAG GGGCTGGGGC TGGGGTGTTG AAGTTGGCTT TGCATGCCCA
421 GCGATGCGCC TCCCTGTGGG ATGTCATCAC CCTGGGAACC GGGAGTGCCC TTGGCTCACT
481 GTGTTCTGCA TGGTTTGGAT CTGAATTAAT TGTCCTTTCT TCTAAATCCC AACCGAACTT
541 CTTCCAACCT CCAAACTGGC TGTAACCCCA AATCCAAGCC ATTAACTACA CCTGACAGTA
601 GCAATTGTCT GATTAATCAC TGGCCCCTTG AAGACAGCAG AATGTCCCTT TGCAATGAGG
661 AGGAGATCTG GGCTGGGCGG GCCAGCTGGG GAAGCATTTG ACTATCTGGA ACTTGTGTGT
721 GCCTCCTCAG GTATGGCAGT GACTCACCTG GTTTTAATAA AACAACCTGC AACATCTCAG
781 TTTCTGCCTG GCATTTTTCA TCTCCTAGAG TAAATGATGC CCCCACCAGC ACCAGCATCA
841 AGGAAGAAAT GGGAGGAAGG CAGACCCTGG GCTTGTGTGT GCAGAGAGCC TCAGGAAAGA
901 GGAGAAGGGG AGGAGGAAAG GCAGGAGGGT GAGAGGGACA GGAGCCCACC CTCCCTGGGC
961 CACCGCTCAG AGGCAGGCCC AGTGCAGGGC ATGGGGAAAT GGAAGGGACA GGCTTGGCCC
1021 CAGCCTTGGG AGCACCTTCT CTTCGGGGGA GGTGGGAGGC AGCGAACAGA CCTCTGCAAT
1081 ACGAGGAGAG AGTGACAGGT GCGCCAGGCT GTGGGAACCC AGAGGAGAGG GGAAGCCATC
1141 ATCATCATGG CTGCAATACC TTCAGTAACG TGGGAAGGTC ACCCTGCTAG TAAGTGGCAG
1201 AGCTGGGACT CAAACTATGG CCTGGA
(d'après Weller et al., 1984. EMBO J. 3(2); 439-446) |
La taille des gènes peut varier de quelques centaines à plusieurs dizaines de milliers de nucléotides. Cependant même les gènes les plus longs n'utilisent qu'une faible portion de leur séquence pour coder l'information nécessaire à l'expression en protéines. Ces régions codantes sont appelées exons et les séquences non codantes introns. D'une manière générale, plus l'organisme est complexe, plus la quantité et la taille des introns est importante. Ainsi la présence d'introns sur l'ADN d'organismes procaryotes est extrêmement rare. Certaines régions de l'ADN sont impliquées dans la régulation de l'expression des gènes. Ces séquences de régulation sont généralement localisées en amont (du côté 5') ou en aval (côté 3') d'un gène et plus rarement à l'intérieur d'introns ou d'exons.
Vitamines

Les vitamines (du latin vita, vie) sont des composés organiques essentiels à la vie, agissant à faibles quantités, pour le développement, l'entretien et le fonctionnement de l'organisme. Nos cellules sont incapables de les synthétiser et elles doivent être apportées par l'alimentation sous peine d'avitaminose ; l'excès de vitamines est la survitaminose. La vitamine B1 (thiamine) est la première vitamine à avoir été découverte par le japonais Umetaro Suzuki cherchant à soigner le béribéri (une maladie due au déficit en vitamine B1, caractérisée par des atteintes musculaires et neurologiques). Elle fut isolée par Kazimierz Funk (biochimiste américain d'origine polonaise) en 1912. Aujourd'hui, on connaît 13 vitamines différentes pour l'homme. C'est un ensemble hétérogène du point de vue chimique et physiologique (mode d'action).
Les vitamines se divisent en deux grandes catégories : les vitamines hydrosolubles (groupes B et C) et les vitamines liposolubles (les groupes A, D, E, et K). Les vitamines hydrosolubles ne peuvent pas franchir la membrane cellulaire et elle doivent se fixer à un récepteur pour pénétrer la cellule. Elles sont facilement éliminées par les reins et la sueur, l'alimentation doit les fournir quotidiennement. Les vitamines liposolubles peuvent facilement traverser la membrane cellulaire. Leurs récepteurs se trouvent dans la cellule, soit dans le cytosol, soit dans le noyau. Elles sont stockées dans le tissu adipeux et le foie (d'où le risque de surdosage, surtout pour les vitamines A et D). Certaines vitamines sont des cofacteurs nécessaires à l'activité d'enzymes (vitamines du groupe B), d'autres constituent une réserve de pouvoir réducteur (vitamine C, E). Les fonctions des autres vitamines restent à élucider.
Sous-disciplines
- Biochimie structurale
- Biochimie métabolique
- Biochimie génétique
- Biochimie fonctionnelle
- Biochimie médicale et clinique
Biochimie, une science multidisciplinaire

Pour mener à bien leurs études, les biochimistes font appel à des techniques et des connaissances issues de nombreuses disciplines scientifiques autres que la biologie, par exemple :
| Disciplines | Quelques applications |
|---|---|
| Chimie analytique |
Elle utilise notamment les méthodes :
|
| Chimio-synthèse |
|
| Cinétique chimique |
|
| Thermochimie | |
| Physique |
La biologie structurale qui a pour objet la détermination de structure des macromolécules utilise des techniques physiques :
|
| Informatique |
Appliquée à la biologie (également appelée la bio-informatique), pour l'analyse de séquences nucléotidiques ou d'acides aminés :
|
Histoire



L'idée que l'activité de la « matière vivante » provienne de réactions chimiques est relativement ancienne (Réaumur, Spallanzani, etc.). La synthèse de l'urée, réalisée en 1828 par le chimiste allemand Friedrich Wöhler, en sera une des confirmations les plus décisives réalisées au XIXe siècle. Avant cette date, on considérait que la substance présente dans les organismes présentait des particularités propres au vivant (théorie du vitalisme ou des humeurs héritée des Grecs anciens Aristote, Gallien ou Hippocrate).
Un autre Allemand, Justus von Liebig sera le promoteur d'une nouvelle science, la biochimie, qui sera un domaine d'illustration pour plusieurs de ses compatriotes jusqu'à la seconde guerre mondiale. Parmi les plus célèbres on retiendra Hermann Emil Fischer (la célèbre projection de Fischer des glucides), Eduard Buchner (biochimie de la fermentation) et Richard Willstätter (mécanisme des réactions enzymatiques).
Dès lors l'exploration de la cellule connaît un nouvel essor mais on s'intéressera plus particulièrement à ses constituants chimiques et à la façon dont ils réagissent entre eux afin de réaliser un métabolisme au niveau cellulaire. Après les travaux de Louis Pasteur, la recherche va se porter dans les substances intervenant dans les fermentations et les digestions (les ferments solubles). Antoine Béchamp les nommera en 1864 « zymases » mais on préfèrera utiliser le nom d'enzymes introduit dès 1878 par Wilhelm Kühne.
Les autres composants attirant l'attention sont des molécules « albuminoïdes » nommées protéines depuis 1838. Celles-ci sont considérées comme des agrégats de petites molécules à l'origine de l'état colloïdal du hyaloplasme de la cellule. Selon Friedrich Engels, elles sont la manifestation même de la vie (Dialectique de la nature, 1835) ; cela suscite dès lors une attitude vitaliste qui en France sera défendue par Émile Duclaux. Marcellin Berthelot permet une avancée majeure en décrivant le fonctionnement de l'invertase : dès 1860, il décrit la façon dont l'hydrolyse de liaisons glucidiques est catalysée par ce glucose hydrolase. Dès 1920, une autre interprétation s'impose avec la mise en évidence de la nature moléculaire des protéines par Hermann Staudinger. Ce nouveau statut est accompagné de caractéristiques structurales qui conduisent à de nouvelles interprétations fonctionnelles, certaines protéines pouvant être des enzymes, comme Victor Henri l'avait pressenti dès 1903.
Otto Warburg met en place la chimie cellulaire et met le microrespiromètre à la disposition des chercheurs. Cet appareil va aider le Hongrois Albert Szent-Györgyi puis l'Allemand Hans Adolf Krebs à élucider le mécanisme de la respiration cellulaire. Il est démontré alors que le gaz carbonique produit à cette occasion est le résultat d'une série de réactions biochimiques effectuées à l'aide d'enzymes spécifiques, le cycle de Krebs. On établit aussi que toutes les cellules tirent leur énergie d'une même molécule, l'adénosine triphosphate ou ATP, découverte en 1929 par Karl Lohmann.
Au début des années 1940, Albert Claude montre que la synthèse de l'ATP se déroule au niveau de la membrane interne des mitochondries. Dans le même temps, le Britannique Peter Mitchell explique le mécanisme de cette réaction, qui s'accompagne de formation d'eau.
L'étude des thylakoïdes dans les chloroplastes des végétaux chlorophylliens permet de comprendre progressivement le mécanisme de la photosynthèse. En 1932, Robert Emerson reconnaît une phase lumineuse et une phase obscure et en 1937 Archibald Vivian Hill démontre que la production d'oxygène caractéristique de la photosynthèse résulte de la photolyse (décomposition chimique par la lumière) de l'eau. Enfin à partir de 1947, Melvin Calvin décrit la fabrication des substances carbonées à partir du dioxyde de carbone absorbé, c'est le cycle de Calvin.
En 1951, Erwin Chargaff montre que la molécule d'ADN, connue depuis 1869, est essentiellement présente au niveau des chromosomes. On remarque aussi qu'il y a autant d'adénine que de thymine, de guanine que de cytosine. Le jeune James Dewey Watson et Francis Harry Compton Crick vont publier la structure en double hélice de l'ADN dans la revue Nature le 25 avril 1953. Ils se basent sur les images en diffraction des rayons X obtenues par Maurice Wilkins et Rosalind Elsie Franklin.
Toutes ces découvertes sont le prélude à une meilleure compréhension moléculaire de la vie et à de nombreuses autres avancées médicales et biologiques.
Apparition des techniques de biochimie
C'est en 1929 que Theodor Svedberg a l'idée de soumettre le matériel cellulaire à une centrifugation poussée (ultracentrifugation) afin d'isoler les différents constituants des cellules. En 1906, le botaniste Mikhaïl Tswett met au point la chromatographie, technique permettant de séparer les biomolécules. La technique d'électrophorèse a été développée en 1930 par Arne Wilhelm Tiselius, elle permet la séparation des biomolécules chargées sous l'effet d'un champ électrique. Le biochimiste britannique Frederick Sanger développa en 1955 une nouvelle méthode pour analyser la structure moléculaire des protéines (séquence d'acides aminés) et montra qu'une molécule d'insuline contenait deux chaînes peptidiques, reliées ensemble par deux ponts disulfure.
 Colonnes de chromatographie (1950).
Colonnes de chromatographie (1950). Électrophorèse sur gel (2004).
Électrophorèse sur gel (2004).
Notes et références
- (en) Thomas J. Glover, comp., Pocket Ref, 3e éd. (Littleton: Sequoia, 2003), p. 324 (LCCN 2002091021)
- (en) Geigy Scientific Tables, Ciba-Geigy Limited, Bâle, Suisse, 1984.
- Raymond Chang, Chemistry, Ninth Edition, McGraw-Hill, (ISBN 0-07-110595-6), p. 52.
- (en) Distribution of elements in the human body (by weight) Retrieved on 2007-12-06
- Frausto Da Silva et R. J. P Williams, The Biological Chemistry of the Elements: The Inorganic Chemistry of Life, (ISBN 9780198508489, lire en ligne).
- Steven S. et Susan A. Zumdahl, Chemistry, Fifth Edition, Houghton Mifflin Company, (ISBN 0-395-98581-1), p. 894.
- (en) Forrest H. Nielsen, Ultratrace minerals : dietary minerals, trace elements, Estimated Average Requirement, mineral metabolism, intestinal absorption, arsenic, pharmacology, structure-activity relationships, mechanism of action, nutrient deficiencies, toxicology, signs and symptoms (animals and humans), Baltimore, Williams & Wilkins, coll. « United States Department of Agriculture Digital Collections », (lire en ligne), p. 283-303.
- Le site LIPD MAPS, un site de ressource sur les lipides, comptait 8 259 entrées le 16 août 2006.
- (en) Fahy E., Subramaniam S., Brown H.A., Glass C.K., Merrill A.H. Jr., Murphy R.C., Raetz C.R., Russell D.W., Seyama Y., Shaw W., Shimizu T., Spener F., van Meer G., van Nieuwenhze M.S., White S.H., Witztum J.L., Dennis E.A. (2005), A comprehensive classification system for lipids, J. Lipid Res., vol. 46(5):839-861
- Cette molécule est appelée « acide phosphatidique ».
- Consulter l'entrée de l'IUPAC sur la nomenclature des lipides
- (en) Finishing the euchromatic sequence of the human genome, International Human Genome Consortium (2004), Nature, 431: 931-945
Voir aussi
Bibliographie
- Philippe de La Cotardière, Histoire des sciences de l'antiquité à nos jours, Tallandier, 2004 (ISBN 978-2-84734-052-5)
- Lubert Stryer, Jeremy Mark Berg, John L. Tymoczko (trad. Serge Weinman), Biochimie, éditions Flammarion, coll. « Médecine-Sciences », 2003, 5e éd. (ISBN 978-2-257-17116-0)
- Peter N. Campbell et Anthony D. Smith (trad. de l'anglais), Biochimie illustrée [« Biochemistry illustrated »], éditions Maloine, coll. « Sciences fondamentales », , 4e éd., 374 p. (ISBN 2224027133)
Articles connexes
- Biochimie clinique
- Biophysique
- Biochimies hypothétiques
- Liste d'abréviations de biologie cellulaire et moléculaire
- Portail de la biologie
- Portail de la chimie
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire