Xanthine oxydase
La xanthine oxydase ou XO, est une oxydoréductase qui catalyse l'oxydation de l'hypoxanthine en xanthine ainsi que l'oxydation de la xanthine en acide urique :
- Hypoxanthine + O2 + H2O xanthine + H2O2.
- Xanthine + O2 + H2O acide urique + H2O2.

| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | FAD, Fe-S, molybdoptérine |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Son poids moléculaire étant de 270 kDa, il s'agit d'une protéine de grande taille. Chaque unité enzymatique est liée à deux molécules de flavine (liée sous forme de FAD), deux atomes de molybdène (sous forme de cofacteur à molybdène), et huit atomes de fer (sous forme de clusters fer-soufre).
Chez l'Homme, la xanthine oxydase se retrouve normalement dans le foie et sous une forme non libre dans le sang. En cas d'atteinte hépatique grave, la xanthine oxydase est larguée dans le sang, si bien qu'une mesure sanguine de XO permet de déceler des dommages hépatiques. De plus, vu que la xanthine oxydase fait partie d'une voie métabolique de biosynthèse de l'acide urique, l'allopurinol, qui est un inhibiteur enzymatique de la xanthine oxydase, est utilisé dans le traitement de la goutte.
La xanthinurie est une maladie génétique rare au cours de laquelle le manque de xanthine oxydase entraîne une concentration élevée de xanthine dans le sang et peut provoquer des problèmes de santé tels une insuffisance rénale. Comme il n'y a pas de traitement spécifique, les médecins conseillent aux patients d'éviter les aliments riches en purines et de boire de l'eau en quantité suffisante.

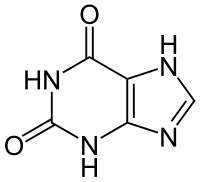 Xanthine
Xanthine
2 atomes d'oxygène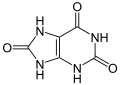 Acide urique
Acide urique
3 atomes d'oxygène
Notes et références
- (en) Cristofer Enroth, Bryan T. Eger, Ken Okamoto, Tomoko Nishino, Takeshi Nishino et Emil F. Pai, « Crystal structures of bovine milk xanthine dehydrogenase and xanthine oxidase: Structure-based mechanism of conversion », Proceedings of the National Academy of Sciences of the United States of America, vol. 97, no 20, , p. 10723-10728 (lire en ligne) DOI:10.1073/pnas.97.20.10723
Voir aussi
- Molybdate de sodium
- Liste de médicaments contre la maladie goutteuse
- Portail de la biochimie