Voie du shikimate
La voie du shikimate, ou voie de l'acide shikimique, est une voie métabolique aboutissant à la biosynthèse de certains acides aminés aromatiques. Elle est présente chez des bactéries, des mycètes, des algues, des protistes et des plantes, mais est absente chez les animaux. Pour cette raison, les acides aminés produits par ces réactions sont dits essentiels chez les animaux, c'est-à-dire que ces derniers doivent se les procurer à partir de leur alimentation car ils ne peuvent les produire eux-mêmes par leur métabolisme.
Il s'agit d'une série de réactions convertissant le phosphoénolpyruvate et l'érythrose-4-phosphate en chorismate, précurseur commun d'acides aminés aromatiques tels que la phénylalanine, le tryptophane et la tyrosine. Si les grandes lignes de cette voie métabolique sont communes aux organismes qui l'utilisent, chacun d'entre eux la met en œuvre d'une manière qui lui est propre, de sorte qu'il en existe de nombreuses variantes.
Formation du chorismate
On retient généralement sept enzymes structurantes pour la voie du shikimate chez Escherichia coli[1] :
- EC : DAHP synthase ;
- EC : 3-déshydroquinate synthase ;
- EC : 3-déshydroquinate déshydratase ;
- EC shikimate désydrogénase ;
- EC : shikimate kinase ;
- EC : EPSP synthase ;
- EC : chorismate synthase.
Condensation du phosphoénolpyruvate et de l'érythrose-4-phosphate en DAHP
La voie du shikimate commence par la condensation du phosphoénolpyruvate avec l'érythrose-4-phosphate sous l'action d'une 3-désoxy-7-phosphoheptulonate synthase (DAHP synthase) pour former du 3-désoxy-D-arabinoheptulosonate-7-phosphate avec élimination d'une molécule de phosphate :
Conversion du DAHP en 3-déshydroquinate
Le DAHP est déphosphorylé par la 3-déshydroquinate synthase pour former du 3-déshydroquinate.
Conversion du 3-déshydroquinate en 3-déshydroshikimate puis en shikimate
Le 3-déshydroquinate est déshydraté par la 3-déshydroquinate déshydratase pour donner du 3-déshydroshikimate, qui est ensuite réduit en shikimate par du NADPH sous l'action d'une shikimate désydrogénase.
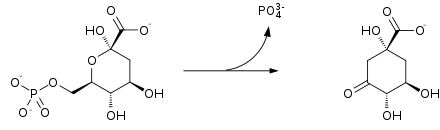
Conversion du shikimate en 3-phosphoshikimate puis en 5-O-(1-carboxyvinyl)-3-phosphoshikimate
Le shikimate est phosphorylé par la shikimate kinase pour donner du 3-phosphoshikimate[2], qui est alors condensé avec le phosphoénolpyruvate sous l'action de l'EPSP synthase pour donner du 5-O-(1-carboxyvinyl)-3-phosphoshikimate, ou 5-énolpyruvyl-3-phosphoshikimate.
Conversion du 5-énolpyruvyl-3-phosphoshikimate en chorismate
Le 5-énolpyruvyl-3-phosphoshikimate est déphosphorylé par la chorismate synthase pour donner du chorismate.
Conversion du chorismate en acides aminés aromatiques
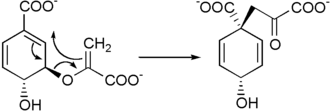
Formation du préphénate
Un réarrangement de Claisen du chorismate sous l'action de la chorismate mutase conduit à l'acide préphénique[3],[4].
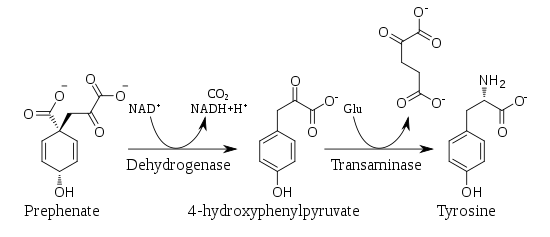
Conversion du préphénate en phénylalanine
Le préphénate peut subir une décarboxylation oxydative éliminant également le groupe hydroxyle pour donner du phénylpyruvate, qui peut donner de la phénylalanine par transamination à partir de glutamate, converti pour sa part en α-cétoglutarate.
Conversion du préphénate en tyrosine
Le préphénate peut également subir une décarboxylation oxydative conservant le groupe hydroxyle, ce qui donne 4-hydroxyphénylpyruvate, lequel peut ensuite donner de la tyrosine par transamination à partir de glutamate.
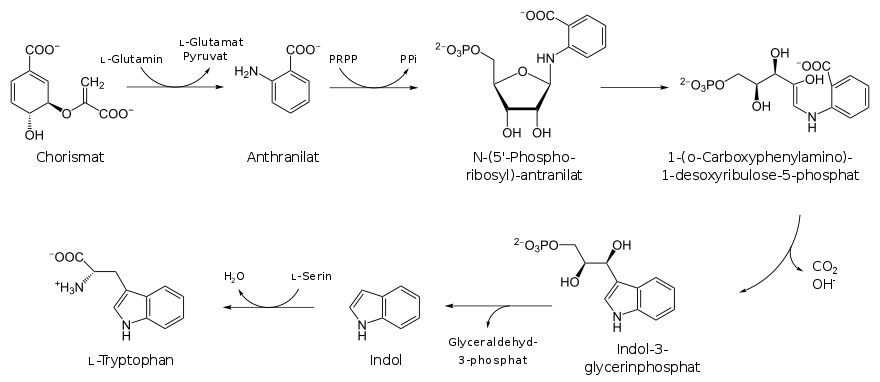
Conversion du chorismate en tryptophane
La biosynthèse du tryptophane est plus complexe, et se déroule, à partir du chorismate, en six étapes.
Notes et références
- (en) D. E. Metzler, Biochemistry. The Chemical Reactions of Living Cells, vol. 2, Elsevier Science, (ISBN 0-12-492541-3), p. 1420–1471
- (en) Klaus M. Herrmann, « The Shikimate Pathway », Annual Review of Plant Physiology and Plant Molecular Biology, vol. 50, , p. 473-503 (PMID 15012217, DOI 10.1146/annurev.arplant.50.1.473, lire en ligne)
- (en) Helmut Goerisch, « On the mechanism of the chorismate mutase reaction », Biochemistry, vol. 17, no 18, , p. 3700-3705 (PMID 100134, DOI 10.1021/bi00611a004, lire en ligne)
- (en) Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk et Robert N. Goldberg, « Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions », Journal of Physical Chemistry, vol. 101, no 50, , p. 10976-10982 (DOI 10.1021/jp972501l, lire en ligne)
Bibliographie
- (en) Stewart A. Brown et A. C. Neish, « Shikimic Acid as a Precursor in Lignin Biosynthesis », Nature, vol. 175, no 4459, , p. 688–689 (ISSN 0028-0836, DOI 10.1038/175688a0)
- (en) L. H. Weinstein, C. A. Porter et H. J. Laurencot, « Role of the Shikimic Acid Pathway in the Formation of Tryptophan in Higher Plants : Evidence for an Alternative Pathway in the Bean », Nature, vol. 194, no 4824, , p. 205–206 (ISSN 0028-0836, DOI 10.1038/194205a0)
- (en) D J Wilson, S Patton, G Florova, V Hale et K A Reynolds, « The shikimic acid pathway and polyketide biosynthesis », Journal of Industrial Microbiology and Biotechnology, vol. 20, no 5, , p. 299–303 (ISSN 1367-5435, DOI 10.1038/sj.jim.2900527)
- Portail de la biochimie