Pyrrolysine
La pyrrolysine (abréviations IUPAC-IUBMB : Pyl et O) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par le codon-stop ambre UAG en présence d'une séquence d'insertion appelée élément PYLIS. Il n'a été identifié que chez des archées méthanogènes, dans des enzymes spécifiques à leur métabolisme particulier.
| Pyrrolysine | ||
| ||
 | ||
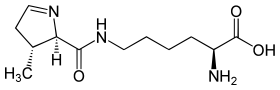
| Structure de la pyrrolysine. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | N6-[(2R,3R)-3-méthyl-3,4-dihydro-2H-pyrrol-2-ylcarbonyl]-L-lysine | |
| Synonymes |
O (Pyl) |
|
| No CAS | ||
| PubChem | 5460671 | |
| SMILES | ||
| Propriétés chimiques | ||
| Formule | C12H21N3O3 |
|
| Masse molaire[1] | 255,3134 ± 0,0126 g/mol C 56,45 %, H 8,29 %, N 16,46 %, O 18,8 %, |
|
| Propriétés biochimiques | ||
| Codons | Codon-stop ambre UAG avec élément PYLIS | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Expression génétique de la pyrrolysine
Ce dérivé de la lysine est codé par le codon UAG (codon-STOP « Ambre » chez la majorité des autres organismes). Ce codon est probablement modifié par la présence d'une séquence spécifique en aval, nommée élément PYLIS[2] (de l'anglais pyrrolysine insertion sequence), qui forme une structure en épingle à cheveux (ou « tige-boucle ») dans l'ARNm, forçant l'incorporation d'un résidu pyrrolysine au lieu de terminer la traduction.
Également, le codon-STOP UAG semble être utilisé beaucoup moins souvent que les autres codons-STOP et, lorsqu'il est rencontré dans une structure ouverte en lecture, il est toujours suivi peu après par un ou plusieurs des deux autres codons-STOP.
Proche d'un groupe (cluster) de gènes de la méthyltransférase de Methanosarcina barkeri (en) se trouve le gène pylT, qui code un ARN de transfert (ARNt) inhabituel avec un anticodon CUA. Le gène pylS adjacent encode une aminoacyl-ARNt synthétase de classe II qui charge l'ARNt dérivé du pylT avec la pyrrolysine[3].
L'opéron contenant pylT et pylS se trouve également dans le génome séquencé d'autres membres de la famille des Methanosarcinaceae. Des homologues de pylS and pylT ont été décrits dans la bactérie à Gram positif Desulfitobacterium hafniense (en)[4]. La fonction de ces gènes putatifs dans ces organismes demeure inconnue. Il a été démontré à l'origine que l'ARNt (CUA) codé par pylT peut se charger de la lysine par PylS. Plus récemment, il a été montré que l'ARNt (CUA) peut être chargé avec la lysine in vitro avec l'action concertée des Lysyl-ARNt synthétases de classe I et de classe II de M. barkeri (en). Le chargement d'un ARNt (CUA) avec la lysine est l'hypothèse originelle de la première étape dans la traduction des codons UAG (ambre) en pyrrolysine chez certains méthanogènes. Le modèle actuel fondé sur des données in vitro et in vivo est en faveur de l'hypothèse du chargement direct de la pyrrolysine sur l'ARNt (CUA) par la protéine produite par le gène pylS. Ceci fait de la pyrrolysine le 22e acide aminé naturel codé génétiquement[5].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
-
(en) Anne Théobald-Dietrich, Richard Giegé et Joëlle Rudinger-Thirion, « Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins », Biochimie, vol. 87, nos 9-10, , p. 813-817 (lire en ligne)
DOI:10.1016/j.biochi.2005.03.006 - Michael Rother et Joseph A. Krzycki, « Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea », Archaea (Vancouver, B.C.), vol. 2010, (ISSN 1472-3654, PMID 20847933, PMCID PMC2933860, DOI 10.1155/2010/453642, lire en ligne, consulté le )
- Yan Zhang et Vadim N. Gladyshev, « High content of proteins containing 21st and 22nd amino acids, selenocysteine and pyrrolysine, in a symbiotic deltaproteobacterium of gutless worm Olavius algarvensis », Nucleic Acids Research, vol. 35, no 15, , p. 4952–4963 (ISSN 1362-4962, PMID 17626042, PMCID PMC1976440, DOI 10.1093/nar/gkm514, lire en ligne, consulté le )
- Bing Hao, Weimin Gong, Tsuneo K. Ferguson et Carey M. James, « A new UAG-encoded residue in the structure of a methanogen methyltransferase », Science (New York, N.Y.), vol. 296, no 5572, , p. 1462–1466 (ISSN 1095-9203, PMID 12029132, DOI 10.1126/science.1069556, lire en ligne, consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pyrrolysine » (voir la liste des auteurs).
Articles connexes
Liens externes
- Portail de la chimie
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la pharmacie
- Portail de la médecine