Periodinane
Un periodinane (calque franglais) ou periodane est un composé chimique contenant au moins un atome d'iode hypervalent, c'est-à-dire ayant plus de huit électrons dans sa couche de valence, ce qui contrevient à la règle de l'octet.
Vocabulaire
Lorsqu'un atome d'iode est complexé par des ligand électronégatif monodentate tel que des ions chlorures, il peut se retrouver dans l'état d'oxydation +3 (iode(III)), on parle pour ces composés d'iodane λ3, ou à l'état d'oxydation +5 (iode(V)) et on parle alors d'iodane λ5. L'iode en lui-même possède sept électrons de valence ; trois électrons supplémentaire lui sont donnés par les trois ligands dans les iodanes λ3, lui donnant une structure de décet (10 électrons partagés), cinq électrons supplémentaires lui sont donnés par les cinq ligands dans les iodanes λ5, lui donnant une structure de dodécet (12 électrons partagés). Ceci est possible car dans l'atome d'iode, les orbitales atomiques, 4d sont proches en énergie des orbitales HOMO des ligands et certaines possèdent la bonne symétrie pour se combiner avec.
Dans les composés ordinaire de l'iode, tel que l'iodobenzène, l'iode suit la règle de l'octet et possède huit électrons de valence, seule une combinaison des OA 5s et 5pz de l'iode est engagée dans la liaison. Dans le modèle de l'iode hypervalent, on peut considérer que l'iode est oxydé et perd dans un premier temps trois électrons, puis deux supplémentaires pour les iodanes λ5. En retour, les ligands l'entourant partagent leurs paires d'électrons et forment des liaisons covalentes de coordination, redonnant ainsi à l'iode 6 ou 10 électrons.
Pour décrire et classer les periodanes, on utilise parfois la « notation N-I-L » (notation N-X-L des molécules hypervalentes avec X=I (iode), N le nombre de ligands et L le nombre d'électrons de valence et dans les doublets libres autour de l'atome d'iode).
Historique
Le concept d'iode hypervalent a été développé en 1969 par J.J. Musher. Afin de s'accommoder de l'excès en électrons des composés hypervalents, on a introduit le concept de Liaison à trois centres et quatre électrons par analogie avec le modèle de la Liaison à trois centres et deux électrons utilisé pour les composés en déficit d'électron. Un telle liaison existe dans les composés de l'iode(III), deux dans les composés de l'iode(V).
Le premier periodinane, le dichlorure d'iodobenzène (C6H5Cl2I) fut préparé en 1886 par le chimiste allemand Conrad Willgerodt[1], en faisant buller du dichlore dans une solution froide de chloroforme de l'iodobenzène.
- C6H5I + Cl2 → C6H5ICl2
Géométrie
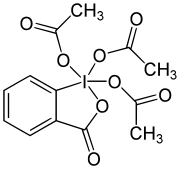
Les iodanes λ3 tels que les diarylchloroiodanes ont une géométrie moléculaire bipyramidale pseudotrigonale présentant une apicophilicité avec les groupes phényle et chlore en position apique et d'autres groupes phényle avec deux doublets non liants en position équatoriale[pas clair]. Ces composés de l'iode (III) peuvent aussi présenter une géométrie en T, même en l'absence de liaison multiple, comme pour le diacétate, C6H5I(OCOCH3)2[2].
Les iodanes λ5 tels que le periodinane de Dess-Martin ont une géométrie moléculaire pyramidale à base carrée, avec quatre hétéroatomes en position basale et un groupe phényle apique.
Exemples
Iodanes λ3
Outre le dichlorure d'iodobenzène, on peut citer l'iodosobenzène et le diacétate d'iodobenzène (ou PIDA), un réactif organique utilisé comme oxydant. De nombreuses procédures organiques classiques existent pour préparer ce dernier à partir de l'iodobenzène, de l'acide peracétique et de l'acide acétique[3].
- C6H5I + CH3COOOH + CH3COOH → C6H5I(OCOCH3)2 + H2O
On peut citer également le (bis(trifluoroacétoxy)iodo)benzène, aussi appelé bis(trifluoroacétate) de phényliode ou PIFA, un dérivé de l'acide trifluoroacétique et de l'iodobenzène, ou encore l'acide 2-iodoxybenzoïque (IBX), un oxydant doux très utile mis qui présente l'inconvénient d'être insoluble dans de nombreux solvants organiques courants.
Iodanes λ5
Le periodinane de Dess-Martin est l'un des iodanes λ5 le plus connu. Préparé pour la première fois en 1983, cet oxydant doux peut être vu comme une amélioration de l'IBX, celui-ci étant soluble dans la plupart des solvants organiques courants.
Utilisation
Les periodanes sont principalement utilisés comme oxydants, remplaçant ainsi des composés beaucoup plus toxiques à base de métaux lourds[4].
Ainsi, un iodane λ3 a longtemps été utilisé comme oxydant, en association avec l'acétate d'ammonium et une source en azote, pour produire à partir d'une solution aqueuse d'acétonitrile le 2-furonitrile, un intermédiaire pharmaceutique et potentiellement un édulcorant[5]. Cette réacton se déroule à 80 °C et a un rendement de 90%.
Les recherches actuelles se concentrent sur leur utilisation dans les réactions de formation de liaisons carbone-carbone et carbone-hétéroatome. On peut citer une étude sur un couplage C-N intramoléculaire d'une alkoxyhydroxylamine avec son groupe anisole, accompli avec une quantité catalytique d'un iodure d'aryle dans le trifluoroéthanol[6] :

Dans cette réaction, le periodane (intermédiaire A, en bleu) est formé par oxydation de l'iodométhylebenzène par le catalyseur sacrificiel mCPBA, qui, à son tour convertit le groupe hydroxylamine en ion nitrénium (B). Cet ion est l'électrophile d'un addition ipso sur le cycle aromatique, formant un lactame avec le groupe énone.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Periodinane » (voir la liste des auteurs).
- C. Willgerodt, Tageblatt der 58. Vers. deutscher Naturforscher u. Aertzte, Strassburg 1885.
- Claire J. Carmalt, John G. Crossley, Julian G. Knight, Philip Lightfoot, Antonio Martín, Mark P. Muldowney, Nicholas C. Norman et A. Guy Orpen, An examination of the structures of iodosylbenzene (PhIO) and the related imido compound, PhINSO2-4-Me-C6H4, by X-ray powder diffraction and EXAFS (extended X-ray absorption fine structure) spectroscopy, Journal of the Chemical Society, Chemical Communications, 1994, n° 20, pp. 2367-2368. DOI:10.1039/C39940002367, (lire en ligne).
- Hypervalent iodine(V) reagents in organic synthesis Uladzimir Ladziata and Viktor V. Zhdankin Arkivoc 05-1784CR pp 26-58 2006 Article
- Chenjie Zhu, Chengguo Sun et Yunyang Wei, « Direct oxidative conversion of alcohols, aldehydes and amines into nitriles using hypervalent iodine(III) reagent », Synthesis, vol. 24, , p. 4235–4241
- (en) Toshifumi Dohi, Akinobu Maruyama, Yutaka Minamitsuji, Naoko Takenagaa et Yasuyuki Kita, « First hypervalent iodine(III)-catalyzed C–N bond forming reaction: catalytic spirocyclization of amides to N-fused spirolactams », Chem. Commun., , p. 1224-1226 (DOI 10.1039/b616510a, lire en ligne, consulté le )
- Portail de la chimie