Microcystis
Microcystis est un genre de cyanobactéries d'eau douce (anciennement appelées algues bleues - vertes), de l'ordre des Chroococcales.
_contrast%C3%A9.jpg.webp)
_(17762186460).jpg.webp)

| Règne | Bacteria |
|---|---|
| Règne | Eubacteria |
| Division | Cyanobacteria |
| Classe | Cyanophyceae |
| Ordre | Chroococcales |
| Famille | Microcystaceae |
Ce genre de cyanobactéries est capable de produire deux grands types de toxines (neurotoxines et hépatotoxines[3],[4] peptidiques telles que la microcystine et la cyanopeptoline[5],[6]). L'espèce la plus connue est sans doute Microcystis aeruginosa[7].
D'autres toxines[8] sont produites par certaines espèces (ex : l'heptapeptide Cyanoginosine-LA[9]) produite par M. aeruginosa. Certaines espèces et certaines souches sont beaucoup plus "toxiques" que les autres[10].
Les efflorescences (blooms) de Microcystis semblent croître en termes de fréquence et d'intensité à l'image de la tendance observée pour les efflorescences de cyanobactéries[11]. Ce phénomène pourrait être expliqué par deux facteurs : le changement climatique et la mise en place de programmes de surveillance et de veille sanitaire à travers le monde. La toxine produite par ces bactéries (la microcystine) était dans les années 2010-2012 présente en quantité significative dans tous les lacs du Canada[12].
Enjeux écologiques et sanitaires
Ce genre bactérien fait l'objet d'un suivi particulier car :
- il est de plus en plus souvent responsable de blooms planctoniques (souvent en été et début d'automne) interagissant négativement avec la biodiversité (mais aussi le tourisme et l'économie locale) ; Ces blooms semblent constituer un phénomène émergeant[13] (en ce qu'ils sont de plus en plus fréquents et intenses, partout dans le monde).
- c'est l'un des critères de fermeture de plages et d'interdiction de baignades ou d'autres activités nautiques ou de bord d'eau ;
- il pose des problèmes écoépidémiologiques et épidémiologiques ou de santé publique, en raison de la capacité de ces espèces à naturellement biosynthétiser et répandre dans l'environnement (quand elles meurent ou quand elles sont stressées) de puissantes toxines (hépatotoxines) dont notamment les microcystines). Ces toxines peuvent nuire (mortellement parfois) à la vie des humains, de nombreux animaux terrestres qui vont boire de l'eau contaminée, et à vie aquatique [13].
Étymologie
Le mot Microcystis derive du grec ancien[14] : mikros ("petit") et kystis ("vessie")
Caractéristiques
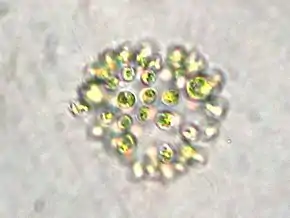
Les cellules sont petites (quelques micromètres de diamètres ; il faut 50 cellules les unes contre les autres pour obtenir l'équivalent de l'épaisseur d'un cheveux), dépourvues de vraies parois individuelles et possèdent des vésicules remplies de gaz qui leur permettent de remonter en surface.
Ces cellules sont le plus souvent agrégées en colonies macroscopiques (c'est-à-dire visibles à l'œil nu). Si l'eau n'est pas agitée, ces colonies forment d'abord des amas sphériques puis vont perdre leur cohérence pour se perforer, prendre des formes plus irrégulières et se déliter au fil du temps, ce qui est un moyen de produire des propagules de nouvelles colonies pouvant être emportées par le courant, le vent ou se faire transporter par des oiseaux d'eau (ou des eaux de ballast de péniches, etc.).
La cohérence de ces colonies est permise par un épais mucilage collectivement sécrété par la colonie de cyanobactéries au fur et à mesure de sa croissance. Ce mucilage est constitué d'un complexe de polysaccharides (xylose, mannose, glucose, fucose, galactose, rhamnose entre autres[15]).
Les protoplastes observés au microscope ont une couleur bleu-vert clair, mais apparaissent aux observateurs brun à verdâtre foncé en raison d'un effet d'optique induit par leur accumulation et également dû aux vésicules remplies de gaz ; c'est l'un des critères de détermination.
Écologie
Les espèces du genre Microcystis sont responsables d'importantes efflorescences à travers le monde. Ces derniers apparaissent rapidement grâce à une croissance très rapide des colonies et grâce à une flottabilité permise par leurs vésicules remplies de gaz.
Leur capacité d'exploiter à la fois des nutriments d'origine minérale et organique notamment dans des eaux eutrophes à dystrophes (selon ce qui est le plus disponible dans leur environnement) semble être l'une des clés de leur domination dans un nombre croissant de milieux naturels ou artificiels (lacs-réservoirs, bassins urbains, etc.)[13]. Une autre clé est leur capacité à réguler leur flottabilité ; elle leur permet de se positionner optimalement dans la zone photique et stable de la colonne d'eau où elles profiteront au mieux à la fois de la lumière et des nutriments. En colonisant la surface de l'eau, ces blooms concurrencent (pour les nutriments et surtout pour la lumière et l'oxygène la nuit) beaucoup d'autres espèces (planctoniques mais aussi végétales). Ces bactéries sont très résistantes aux UV solaires et empêchent ces derniers de pénétrer la masse d'eau, au profit d'autres pullulations microbiennes (les UV solaires ont des vertus désinfectantes).
Microcystis est capable d'exploiter le dioxyde de carbone de l'eau et de l'air, mais aussi d'exploiter le phosphore (phosphates) et l'azote (nitrates) dissous dans l'eau. Les grandes colonies et blooms de Microcystis sont soupçonnés de pouvoir influencer fortement sur les taux d'azote et de phosphore disponibles et de modifier le rapport C/N ou N/P[16].
On sait depuis plusieurs décennies que les engrais peuvent déclencher ou favoriser ou exacerber des blooms de cyanobactéries toxiques (en eau douce et en mer, et dans le monde entier), mais une étude récente, multi-institution publiée dans la revue Ecosphere montre que dans les masses d'eau relativement fermées (lacs, typiquement) ces cyanobactéries une fois massivement présentes peuvent ensuite elles-mêmes modifier le cycle biogéochimique naturel et en quelque sorte "autoentretenir" des conditions les favorisant, en exploitant à leur profit des réserves d'azote et de phosphore inaccessibles aux autres formes de plancton et à de nombreuses autres espèces, grâce à des boucles de rétroaction positive qui amplifient les effets des polluants et ceux du dérèglement climatique, en rendant les conditions subaquatiques toujours plus favorables aux pullulations planctoniques. En particulier les cyanobactéries sont souvent capables de fixer l'azote gazeux (comme certaines bactéries terrestres symbiotes de plantes). Certaines espèces sont capables de (re)mobiliser du phosphore que l'on avait jusqu'alors considéré comme piégé dans les sédiments et les eaux froides du bas de la colonne d'eau. Après la mort des bactéries ou d'autres organismes qu'elles tuent par leurs toxines ou en les privant de lumière ou de nutriments, une grande quantité d'azote et de phosphore est à nouveau libérée dans l'eau, ce qui permet une nouvelle pullulation phytoplanctonique et microbienne, et ainsi de suite[17]. En outre les moules zébrées semblent encore améliorer ces processus (voir plus bas).
Microcystis et la pollution lumineuse
À l'Université de Sherbrooke (Canada), les réactions écophysiologiques de Microcystis aeruginosa face à l'éclairage nocturne artificiel ont été étudiées en laboratoire (en turbidostat, en absence et en présence d'éclairage nocturne, aux intensités lumineuses équivalentes à celle qu'on observe en ville en bordure de lac ou cours d'eau)[18]. Résultats : certaines fonctions physiologiques sont affectées par la pollution lumineuse (ex : rendement quantique de photosynthèse, quantité de chlorophylle a et de protéines photosynthétiques par cellule) ; alors que d'autres ne l'ont pas été (c'est le cas de la production de certaines protéines photosynthétiques, l'efficacité photosynthétique et la biosynthèse de microcystine intracellulaire[18].
Relations symbiotiques avec la moule zébrée ?
Depuis les années 1980 au fur et à mesure de l'avancée géographique de la moule zébrée (espèce de moule d'eau douce très invasive en Europe et aux États-Unis), les scientifiques notent dans les plans d'eau une coïncidence troublante entre l'arrivée de cette moule et des pullulations de plus en plus importantes et fréquentes de Microcystis.
On a récemment démontré que cette moule, à la différence des grandes moules d'eau douce supporte très bien les toxines libérées dans le milieu par Micocystis[19]. Selon Vanderploeg & al (2001), sa capacité à sélectivement filtrer l'eau favorise les blooms de Microcystis[20].
Génétique
Le génome d'une cyanobactérie (Microcystis aeruginosa) appartenant à ce genre et utilisée comme organisme modèle fait l'objet de diverses études, notamment pour mieux comprendre la capacité de cet organisme à exploiter l'Azote et le Phosphore en solution dans l'eau et les conditions qui lui font produire des toxines[21]. Le génome de cet organisme a été pour la première fois séquencé et publié en 2007[22].
On cherche aussi par la génétique à mieux comprendre les relations qui unissent les espèces produisant des toxines et celles qui n'en produisent pas au sein des Microcystis[23].
L'étude des génomes vise aussi à identifier des amorces utiles pour des tests de détection de cyanobactéries "à risque" (c'est-à-dire capable de sécréter des toxines), notamment dans les réservoirs d'eau potable et les zones de baignade.
Moyens de contrôler les pullulations de ces espèces
Selon les données accumulées depuis les années 1980, le traitement algicide est inutile ou contreproductif (les algues mortes vont libérer des nutriments qui permettront une nouvelle pullulation, peut-être encore plus importante, et en mourant les cyanophycées libèrent massivement dans l'eau (et en moindre quantité dans l'air) des cyanotoxines)[24].
Limiter à la fois la pollution azotée et les excès de phosphore dans les masses d'eau semble la première des étapes nécessaires pour contrôler ces espèces.
Les stations d'épuration ont dans de nombreux pays fait fortement chuter les apports de phosphore, mais la pollution automobile, industrielle, urbaine, et par les chauffages domestiques, la marine marchande et les péniches, en se combinant à la pollution par l'ozone (oxydation des NOx par l'ozone) produisent des nitrates très solubles dans les pluies et les eaux superficielles. Ces nitrates s'ajoutent à ceux épandus sur les sols ou pulvérisés en tant qu'engrais azoté agricole, dont une partie aboutit également dans les masses d'eau superficielles.
Il a été montré que quand ces bactéries manquent d'azote elles désactivent ceux de leurs gènes qui codent la production de toxines, et la teneur des cellules en toxine diminue alors.
Concernant la production de cyanotoxines, la disponibilité en nitrates et phosphates ne semble pas être un facteur déterminant selon Utkilen & Gjølme (1995)[25], alors que la disponibilité en fer semble nécessaire pour la production de toxines par M. aeruginosa[25].
On sait depuis le milieu du XXe siècle que les plantes aquatiques submergées (macrophytes) doivent se protéger des biofilms bactériens et des algues. Elles le font par simple compétition pour certains nutriments en solution, mais aussi parfois en libérant des substances inhibitrices[26]. Une plante aquatique au moins (Myriophyllum spicatum) libère dans l'eau quatre composés polyphénoliques allélopathiques (qui inhibent le développement de Microcystis aeruginosa)[27]. Les deux plus efficaces, en laboratoire sont l'acide gallique et l'acide pyrogallique, mais ces quatre molécules semblent agir synergiquement plus efficacement encore.
Taxonomie : diversité des espèces et identification
Dans le milieu naturel, les efflorescences de Microcystis sp. se composent de cellules rassemblées sous formes de colonies. Ces colonies présentent une diversité de formes et de structure non négligeable. C'est ainsi que les premières tentatives d'identification des espèces ont été réalisées à partir de critères morphologiques sur la base d'observation au microscope optique puis électronique. Il est important de noter que lorsqu'une souche de Microcystis est maintenue en culture, elle peut perdre son organisation coloniale et se présenter sous la forme de cellule isolée ne permettant plus son identification. De plus, l'identification des différentes espèces de Microcystis sur des critères morphologiques et aujourd'hui remise en cause par les données génétiques. C'est pourquoi l'identification et la taxonomie du genre Microcystis et des espèces qui le composent est en constante évolution. Parmi les espèces décrites à ce jour et répertoriée dans la littérature scientifique figurent[28] :
- Microcystis aeruginosa
- Microcystis argentea
- Microcystis botrys
- Microcystis elongata
- Microcystis flos-aquae
- Microcystis holsatica
- Microcystis lutescens
- Microcystis marina
- Microcystis pallida
- Microcystis panniformis
- Microcystis salina
- Microcystis thermalis
- Microcystis viridis
- Microcystis wesenbergii
Notes et références
- Taxonomy Browser Genus: Microcystis. AlgaeBase. consulté 28 mars 2018.
- Dervaux J, Mejean A, Brunet P (2015). "Irreversible collective Migration of Cyanobacteria in Eutrophic Conditions". PLOS ONE. DOI:10.1371/journal.pone.0120906. . PMC: 4370732.
- Falconer, I. R., Beresford, A. M., & Runnegar, M. T. (1983). Evidence of liver damage by toxin from a bloom of the blue-green alga, Microcystis aeruginosa. The Medical Journal of Australia, 1(11), 511-514 (résumé).
- Yoshizawa, S., Matsushima, R., Watanabe, M. F., Harada, K. I., Ichihara, A., Carmichael, W. W., & Fujiki, H. (1990). Inhibition of protein phosphatases by microcystis and nodularin associated with hepatotoxicity. Journal of cancer research and clinical oncology, 116(6), 609-614 (résumé).
- (en) « On the Evolution of Nonribosomal Peptide Synthetase Gene Clusters in Cyanobacteria », University of Oslo,
- (en) Karl Gademann, Cyril Portmann, Judith F. Blom, Michael Zeder et Friedrich Jüttner, « Multiple Toxin Production in the Cyanobacterium Microcystis: Isolation of the Toxic Protease Inhibitor Cyanopeptolin 1020 », J. Nat. Prod., vol. 73, , p. 980–984 (DOI 10.1021/np900818c, lire en ligne)
- (en) PJ Oberholster, « Microcystis aeruginosa: source of toxic microcystins in drinking water », African Journal of Biotechnology March 2004 Volume 3 pp 159-168 (consulté le )
- Botes D.P, Kruger H & Viljoen C.C (1982) Isolation and characterization of four toxins from the blue-green alga, Microcystis aeruginosa. Toxicon, 20(6), 945-954 (résumé).
- Botes, D. P., Tuinman, A. A., Wessels, P. L., Viljoen, C. C., Kruger, H., Williams, D. H., ... & Hammond, S. J. (1984). The structure of cyanoginosin-LA, a cyclic heptapeptide toxin from the cyanobacterium Microcystis aeruginosa. Journal of the Chemical Society, Perkin Transactions 1, 2311-2318.
- Watanab, M.F and S. Oishi (1983) . A highly toxic strain ofblue-green alga Microcystis aeruginosa isolated from Lake Suwa. Bull. Jpn. Soc. Sci. Fish. 49:1759.
- (en) Jef Huisman, Geoffrey A. Codd, Hans W. Paerl et Bas W. Ibelings, « Cyanobacterial blooms », Nature Reviews Microbiology, vol. 16, no 8, , p. 471–483 (ISSN 1740-1534, DOI 10.1038/s41579-018-0040-1, lire en ligne, consulté le )
- Potent human toxins prevalent in Canada's freshwaters ; Canadian Science Publishing (NRC Research Press), ScienceDaily, 2012
- Stony Brook University. "Cracking the blue-green code: Study of gene expression in blue-green algae reveals what makes it bloom, toxic" ScienceDaily. ScienceDaily, 24 July 2013. www.sciencedaily.com/releases/2013/07/130724101549.htm
- "Cyanobacteria: Microcystis". The Silica Secchi Disk. Connecticut College : The Silica Secchi Disk. Archived from the original 26 mars 2008. Consulté 24 juin 2011
- (en) Thomas Rohrlack, Manfred Henning et Johannes-Günter Kohl, « Mechanisms of the inhibitory effect of the cyanobacterium Microcystis aeruginosa on Daphnia galeata's ingestion rate », Journal of Plankton Research, vol. 73, , p. 980–984 (DOI 10.1021/np900818c, lire en ligne)
- (en) « The low TN:TP ratio, a cause or a result of Microcystis blooms? », Water Research, vol. 37, , p. 2073–2080 (DOI 10.1016/S0043-1354(02)00532-8)
- Dartmouth College. "[Algae blooms create their own favorable conditions]." ScienceDaily, 8 janvier 2015. www.sciencedaily.com/releases/2015/01/150108084849.htm.
- Poulin C (2012) Effets de la pollution lumineuse sur l'écophysiologie de Microcytis aeruginosa (Doctoral dissertation, Université de Sherbrooke).
- Michigan State University. "Scientists Study Link Between Zebra Mussels And Algae Blooms." ScienceDaily. ScienceDaily, 22 September 1998. <www.sciencedaily.com/releases/1998/09/980919115852.htm>.
- Vanderploeg, H. A., Liebig, J. R., Carmichael, W. W., Agy, M. A., Johengen, T. H., Fahnenstiel, G. L., & Nalepa, T. F. (2001). Zebra mussel (Dreissena polymorpha) selective filtration promoted toxic Microcystis blooms in Saginaw Bay (Lake Huron) and Lake Erie. Canadian Journal of Fisheries and Aquatic Sciences, 58(6), 1208-1221.
- Matthew J. Harke, Christopher J. Gobler (2013). Global Transcriptional Responses of the Toxic Cyanobacterium, Microcystis aeruginosa, to Nitrogen Stress, Phosphorus Stress, and Growth on Organic Matter. PLoS ONE, 2013; 8 (7): e69834 DOI: 10.1371/journal.pone.0069834
- (en) Makoto M. Watanabe, Satoshi Tabata, Manabu Yamada et Shinobu Nakayama, « Complete Genomic Structure of the Bloom-forming Toxic Cyanobacterium Microcystis aeruginosa NIES-843 », DNA Research, vol. 14, no 6, , p. 247–256 (ISSN 1340-2838, PMID 18192279, PMCID PMC2779907, DOI 10.1093/dnares/dsm026, lire en ligne, consulté le )
- Neilan, B. A., Jacobs, D., Blackall, L. L., Hawkins, P. R., Cox, P. T., & Goodman, A. E. (1997). rRNA sequences and evolutionary relationships among toxic and nontoxic cyanobacteria of the genus Microcystis. International Journal of Systematic and Evolutionary Microbiology, 47(3), 693-697
- Jones, G. J., & Orr, P. T. (1994). Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water research, 28(4), 871-876. (résumé)
- Utkilen, H., & Gjølme N (1995). Iron-stimulated toxin production in Microcystis aeruginosa. Applied and Environmental microbiology, 61(2), 797-800 (résumé).
- (Hasler and Jones., 1949)
- Nakai, S., Inoue, Y., Hosomi, M., & Murakami, A. (2000). Myriophyllum spicatum-released allelopathic polyphenols inhibiting growth of blue-green algae Microcystis aeruginosa. Water Research, 34(11), 3026-3032 (PDF, 7 pp)
- (en) « Taxonomy Browser Genus: Microcystis », Taxonomy Browser Genus: Microcystis, AlgaeBase (consulté le )
Voir aussi
Articles connexes
Liens externes
- (fr+en) Référence ITIS : Microcystis Lemmermann, 1907
- (en) Référence BioLib : Microcystis Kützing ex Lemmerman, 1907
Bibliographie
- Chen, Y., Qin, B., Teubner, K., & Dokulil, M. T. (2003). Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China. Journal of Plankton Research, 25(4), 445-453.
- Dittmann, E., Neilan, B. A., Erhard, M., Von Döhren, H., & Börner, T. (1997). Insertional mutagenesis of a peptide synthetase gene that is responsible for hepatotoxin production in the cyanobacterium Microcystis aeruginosa PCC 7806. Molecular microbiology, 26(4), 779-787.
- Hughes, E. O., Gorham, P. R., & Zehnder, A. (1958). Toxicity of a unialgal culture of Microcystis aeruginosa. Canadian Journal of Microbiology, 4(3), 225-236.
- ScienceDaily (2015) Tracking the toxicity of Lake Erie cyanobacterial blooms University of Michigan (Lien vers l'article (payant))
- Tillett, D., Dittmann, E., Erhard, M., von Döhren, H., Börner, T., & Neilan, B. A. (2000). Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806: an integrated peptide–polyketide synthetase system. Chemistry & biology, 7(10), 753-764.
- Watanabe M.F & Oishi S (1985) Effects of environmental factors on toxicity of a cyanobacterium (Microcystis aeruginosa) under culture conditions. Applied and Environmental microbiology, 49(5), 1342-1344.
- Zehnder A &Gorham P.R (1960) Factors influencing the growth of Microcystis aeruginosa Kutz Emend. Can. J. Microbiol. 6 , 645±660.
- Portail de la microbiologie
- Portail de la phycologie