Méthylmercure
Le méthylmercure est un nom générique pour désigner un cation organomercuriel regroupant un cation mercure Hg2+ et un ou plusieurs anions méthyl CH3. Il s'agit de la forme organique la plus toxique du mercure.
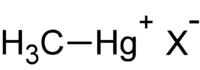

Certains microbes peuvent (en situation anoxique) méthyler le mercure, alors que d'autres (quand l'eau ou le substrat contaminé sont oxygénés) peuvent le déméthyler, ce qui explique qu'il soit plus présent dans les environnement lotiques, lacustres[1] et sédimentaires[2]. Ceci explique aussi des changements saisonniers dans la proportion de mercure méthylé/non méthylé.
On a montré grâce à des zones inondables et réservoirs expérimentaux que quand un milieu riche en matière organique (ex : forêt ou prairie) et contenant du mercure est inondé, dès les premières semaines et éventuellement durant plusieurs mois ou années, du mercure est méthylé et dispersé dans l'environnement[3],[4],[5],[6], mais après un certain temps, un équilibre est atteint. Ce phénomène se produit aussi dans les lacs de barrages inondant un paysage qui n'a pas été débarrassé de ses arbres et de sa terre végétale (ex Barrage de Petit-Saut en Guyane) ou dans lequel beaucoup de débris et matières organiques sédimentent. Ce mercure peut être à l'origine de contamination de grenouilles (grenouille verte par exemple[7]) ou d'alevins de jeunes brochets par exemple.
Les différentes formes du méthylmercure
Le mercure est plus couramment trouvé et connu sous sa forme élémentaire ou sous sa forme inorganique (sous forme de composés tels qu'oxydes, chlorures, sulfures ou hydroxydes de mercure).
Les formes organiques du mercure, de loin les plus toxiques et dangereuses, se composent de deux groupes principaux :
- les composés R-Hg-X qui comprennent tous les composés monométhylmercure de formule CH3Hg+. C'est un acide mou dont le comportement peut s'expliquer dans le cadre du principe HSAB.
- les composés R-Hg-R ; le plus souvent il s'agit de diméthylmercure.
où R est l'espèce organique (dont méthyle (-CH3)), et X un anion inorganique (chlorure, nitrate ou hydroxyde).
Le mot méthylmercure employé seul désigne souvent le monométhylmercure.
Ce contaminant, selon les scientifiques, est converti du Hg2+, notamment issu de la pollution atmosphérique[8], en méthylmercure grâce aux bactéries sulfato-réductrices produisant du méthane[9]. Le mercure, avant de se transformer en méthylmercure, provient de différentes sources de pollutions. Il peut provenir de centrales thermiques alimentées au charbon, incinérateurs de déchets municipaux, combustion de charbon[10], fonderies, régions extrayant du minerai de mercure (principalement le cinabre), etc. De plus, c’est une substance facilement bioaccumulable dans la chair des poissons[11] et mammifères marins, d’où la nécessité de connaître quels poissons en contiennent davantage pour en réduire leur consommation (le requin, le cachalot et le dauphin, localement encore consommés par l'Homme, peuvent en bioaccumuler d'importantes quantités).
Cycle biogéochimique
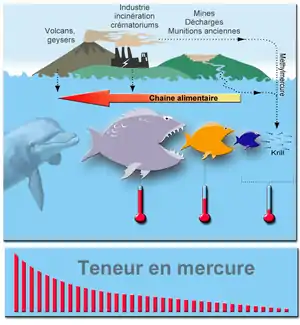
Le mercure étant toxique pour le développement, des limites ont été recommandées (ici symbolisées par les thermomètres) ou imposées par l'EPA et d'autres autorités, pour protéger les embryons fœtus et enfants jusqu'à 12 ans.
Les phoques en contiennent aussi. Les cétacés, des dauphins, bélugas et marsouins aux cachalots en passant par les orques peuvent fortement « Biomagnifier » le mercure méthylé. Les cétacés ne sont habituellement plus consommés par l'Homme, mais il existe quelques exceptions (Japon, Norvège...)

Le flacon de gauche est l'échantillon témoin (alevins s'étant normalement développé dans une eau normale non contaminée), les trois autres flacons contiennent des alevins ayant également vécu durant 30 jours, mais dans une eau contaminée par de très faibles doses de mercure, avec respectivement 0,6 1.26 et 2.5 ppM (parties par milliards / Parts per billion pour les anglophones) de méthylmercure
Avant d'être converti en méthylmercure, le mercure doit provenir de différentes sources (naturelles ou humaines). Il est présent dans la croûte terrestre sous forme de cinabre. Avec l’érosion naturelle, du mercure (seul métal volatil à température ambiante) est lentement relâché dans l’air par le phénomène de sublimation.
Les autres sources significatives de mercure dans l'air sont les éruptions volcaniques, certains geysers et les feux de forêts. Ces causes ne sont responsables que de 2 à 3 % du relâchement du mercure dans l'atmosphère [réf. souhaitée].
Le reste a l’activité humaine comme origine, avec notamment traitement en raffineries et la combustion de pétrole, gaz et charbon dans les centrales thermiques, les chaudières et moteurs. l'EPA a ainsi évalué que la production pétrolière annuelle normale des raffineries des États-Unis pouvait émettre jusqu'à 10 000 t environ/an de mercure dans l'environnement[12].
Les incinérateurs de déchets municipaux, industriels ou hospitaliers, les crématoriums (cf. mercure des amalgames dentaires, et mercure bioaccumulé durant la vie des personnes incinérées), ainsi que les activités agricoles sous formes de fongicides organimercuriels et bactéricides en sont d'autres sources[13].
Le mercure est le seul métal volatil à température ambiante. Le mercure élémentaire relâché dans l'atmosphère est d'autant plus facilement transporté par les vents sur toute la planète. Il peut se trouver dans l’atmosphère pour une période d'un an et même plus. Sous l’action de phénomènes photochimiques, le mercure élémentaire s'oxyde en Hg2+[14]. Le mercure oxydé est moins volatil et soluble dans l'eau. Il peut donc réagir avec l’eau, la neige, les brumes et rosées ou être adsorbé par certaines particules pour être déposé dans l’environnement.
Les bactéries méthanogènes dans les lacs et étangs, ou dans les sédiments de zones humides (notamment en zone boréale sous la glace en hiver)[15], peuvent convertir le Hg2+ en MeHg+[16].
Toxicité, écotoxicité
Toxicologie
C'est un polluant pouvant, même à très faible dose, et notamment en cas d'exposition prénatale (in utero) ou via l'allaitement freiner et limiter le développement du cerveau du fœtus et du jeune enfant[17]. Or, c'est la forme la plus courante de mercure organique dans l'environnement et dans l'alimentation.
Il peut être absorbé par inhalation, par la peau et via l'intestin[18],[19]. Il s'accumule dans les graisses et la chair de certains animaux aquatiques[20], comme les ailerons de requin qui peuvent contenir de fort taux toxique de methylmercure mais aussi le plancton, les animaux filtreur, les poissons (thon, marlin, espadon...) et les cétacés du bout de la chaîne alimentaire. Ces graisses représentent un danger pour les hommes qui consomment ces animaux.
Selon l’OMS, la dose à ne pas dépasser serait de 100 μg par semaine[21], les personnes ingérant approximativement 2,4 μg de méthylmercure quotidiennement[22].
Le méthylmercure ingéré ou absorbé par un organisme animal attaque le système nerveux central. Il cause des troubles du développement fœtal et du nouveau-né par le biais de l’alimentation maternelle puis de l'allaitement. Au-delà d'un certain seuil, il provoque des convulsions, paralysies spastiques, cécité, surdité et un retard de développement du cerveau retard mental.
Ecotoxicologie
Une grande partie du méthylmercure provient non pas du mercure géologique, mais des retombées atmosphériques (d'origine volcanique, érosive et humaines). Les variations du taux de méthylmercure trouvé dans les poissons semble assez bien refléter les variations de retombées de mercure atmosphérique.
Le méthylmercure est facilement bioconcentré dans le réseau trophique, ce qui explique qu'on le retrouve dans la chair de requin, espadon, maquereau roi qui peuvent contenir des taux élevés de mercure alors que (selon la FDA) les crevettes, le saumon, le poisson-chat, le lieu jaune en contiennent le moins[23].
Le riz est ainsi une source importante de méthylmercure dans les régions industrielles ou contaminées par du mercure[24], notamment s'il est cultivé dans une vase fine et anoxique favorisant la méthylation du mercure, et plus encore avec un amendement à base de paille fraîche (le taux de Méthylmercure peut alors augmenter de +11 à +1043 % dans la plante et jusqu'à 95% dans le grain selon une étude chinoise récente qui a aussi montré que dans la vase, les racines sont en outre plus longues (+ 35 à +41%) et de leur nombre de pointes (+ 60 à +105%), ce qui aggrave l'absorption et le transfert vers le grain de mercure méthylé. La culture sur milieu sableux et le compostage préalable de la paille pourraient diminuer la teneur du riz en mercure[25].
Synergies : Il en existe. Par exemple, plus encore que le mercure métallique, le méthylmercure est un cofacteur exacerbant la bioaccumulation d'autres toxiques (comme le sélénium chez les moules par exemple[26])
Taux sanguin moyen de méthylmercure dans la population
Dans la population générale des pays occidentaux, le mercure organique (méthylmercure essentiellement) représente de 14 % à 26 % du mercure présent dans le sang[27] ,[28]. Un Canadien moyen présente des taux de mercure et méthylmercure proche ou légèrement supérieur à ceux mesurés chez les Allemands[29],[30], chez les femmes de 16 à 49 ans aux États-Unis[31] et au sein de populations-témoins non particulièrement exposées en milieu de travail dans la région de Québec[32].
Catastrophes épidémiologiques humaine reliée au méthylmercure
- Le méthylmercure a été, au Japon, au centre d’une catastrophe humaine entre les années 1932-1966. L'usine de la compagnie Chisso déversait dans la baie de Minamata des produits chimiques lors de sa production d’acétaldéhyde et de PVC par un procédé utilisant du mercure inorganique. Une fois les déchets toxiques dans l’eau, il y avait une réaction entre l’acétylène et l'eau formant du méthylmercure. Cette catastrophe a eu de graves conséquences sanitaires, sur plusieurs générations ; il y eut près de 1700 personnes décédées à ce jour[33]. Cette maladie porte désormais le nom de maladie de Minamata, et on parle de la Catastrophe de Minamata.
- Plus récemment (1972) une épidémie catastrophique d'empoisonnement au méthylmercure a touché plusieurs zones rurales d'Irak[34]. Elle a été reliée à la consommation de pain domestique fabriqué à partir de farine de blé traitée avec un fongicide mercuriel contenant du méthylmercure[34]. Dans de nombreux cas, les embryons ont été contaminés in utero durant la grossesse, comme l'ont montré les analyses de sang des mères et des nouveau-nés. Le lait maternel était en outre également contaminé jusque sept mois après qu'on eut cessé d'utiliser cette farine[34]. Dans tous les cas étudiés sauf un, le taux de mercure sanguins des nourrissons dépassaient ceux de leurs mères durant les quatre premiers mois après la naissance, ce qui confirme le passage du méthylmercure au travers de la barrière placentaire, et sa bioaccumulation chez le jeune enfant allaité.
Des signes cliniques d'empoisonnement méthylmercuriel étaient manifestes chez près de la moitié des 15 mères et des nourrissons suivis. Cinq nourrissons gravement atteints ont subi un retard mental et moteur grave[34]. Un suivi attentif de ces études et d'autres enfants irakiens a déterminé où les signes et symptômes de l'empoisonnement au méthylmercure apparaissent durant le développement de ces enfants. Les études conduites sur ces derniers et d'autres paires mère-enfant peuvent permettre la détermination de la période prénatale où le fœtus présente une plus grande sensibilité à l'empoisonnement au méthylmercure[34]. Dans un seul couple mère-enfant, l'enfant était affecté et non la mère (à la différence de ce qui avait été observé à Minamata où la source d'empoisonnement était le poisson)[34].
- Les populations autochtones amérindiennes du bassin amazonien, notamment celles où la consommation de poisson est importante sont souvent victimes d'une contamination chronique par le mercure, dont au Surinam, au Brésil et en Guyane. Selon une étude récente faite en Guyane, la présence de l'orpaillage et/ou de zones d'anoxie de l'eau sont les deux principaux facteurs de risques pour ce type de contamination[35]. Le poisson Aimara est couramment utilisé comme bioindicateur de ce type de contamination mercurielle (pour le Réseau trophique ou l'alimentation humaine)[35].
- Le méthylmercure[36] (tout comme le plomb dès 1,6 μg/dl de sang[37]), et plus encore quand il est associé au plomb qui a des effets neurotoxiques partiellement similaires[38] peut aussi contribuer à une « hyperactivité » et à un syndrome de trouble du déficit de l'attention chez l'enfant[38]. Le méthylmercure induit des effets de type TDAH[39] ; ainsi, les enfants inuits se sont montrés plus enclins aux TDAH que la moyenne. Une analyse du sang de cordon de 279 enfants inuits du Nunavik a montré que les embryons et fœtus, dans cette région sont exposés in utero ou via le lait maternel à un taux excessif de mercure[39]. Un suivi épidémiologique de ces enfants a montré chez eux un triplement du risque de troubles de déficit de l’attention avec hyperactivité (TDAH). L’hypothèse explicative la plus plausible serait une perturbation du système dopaminergique induite par le mercure. Dans ces cas, la quantité de mercure dans le sang de cordon dépassait souvent le seuil critique de 11,4 microgrammes (μg), alors que ce seuil est rarement dépassé chez les humains du Canada ou des États-Unis[39].
Techniques de détermination du méthylmercure dans les tissus de poissons
La détermination du méthylmercure varie selon le type d’échantillon à analyser et dans le cas d’analyses dans les tissus de poissons, les étapes les plus souvent utilisées par les scientifiques sont les suivantes : extraction, dérivatisation, séparation et détection. L’extraction est une étape très importante car elle permet d’extraire le méthylmercure de sa matrice naturelle qui est le tissu de poisson. Une technique souvent utilisée est la digestion avec des acides (D. S. Forsyth et al.[40] ou bases fortes (F. Ubillus et al.)[41]. Cela permet de décomposer les tissus efficacement et peut même être accéléré en chauffant ou en utilisant une sonication (L. Abranko et al.)[42]. Afin de digérer les tissus de poissons, le KOH-méthanol[43] est fréquemment utilisé car il procure un bon recouvrement et les acides gras qui se retrouvent dans les tissus sont saponifiés et ne sont donc pas extraits en phase organique, ce qui a pour avantage que la matrice du méthylmercure extrait est moins contaminée.
La seconde étape qui est réalisée est la dérivatisation afin de rendre le méthylmercure plus volatil. Il existe plusieurs agents de dérivatisation qu’il est possible d’utiliser. L’un d’entre eux est celui du tétraéthylborate de sodium (NaBEt4). La réaction de dérivatisation avec le méthylmercure est la suivante[44] :
MeHg+ + NaBEt4 → MeEtHg + BEt3 + Na+ (1) Hg2+ + 2NaBEt4 → Et2Hg + 2BEt3 + 2Na+ (2)
Lors d’une analyse par chromatographie en phase gazeuse (CPG) par exemple, le produit qui sera détecté sera le MeEtHg qui est en fait associé au méthylmercure étant donné que ce dernier ne peut être analysé par CPG. Il peut également y avoir du mercure oxydé présent dans les tissus qui peut réagir avec le tétraéthylborate de sodium pour donner du diéthylmercure.
Une fois l’échantillon dérivé, ce dernier doit souvent être à nouveau extrait dans un solvant organique, soit par une extraction liquide-liquide en utilisant un solvant organique tel que l’hexane ou le dichlorométhane ou avec une technique de microextraction sur phase solide (SPME). L’avantage de la SPME est qu’elle permet de faire l’extraction et la dérivatisation simultanément (Y. Cai et al.)[45], ce qui diminue le temps de la préparation de l’échantillon à analyser. Plusieurs techniques de séparation peuvent être utilisées mais celle qui domine présentement et que la plupart des articles citent est la chromatographie gazeuse. C’est une technique rapide et qui offre une bonne sensibilité.
Différents détecteurs sont utilisés pour la détection du méthylmercure couplé avec la CPG. Entre autres, il y a le détecteur d’émission atomique (AED), le détecteur à décharge pulsée (PDD) ou encore la spectrométrie de masse (MS). L’AED, utilisé par T. Kubella et al., est une technique utilisant un plasma alimenté par les micro-ondes pour atomiser l’éluant sortant de la CPG pour ensuite l’amener sur une photodiode. Quant au PDD, utilisé par D. S. Forsyth et al., cette technique utilise une décharge pulsée dans l’hélium comme source d’ionisation. L’éluant est ionisé par des photons issus de la décharge d’hélium et les électrons émis sont dirigés sur une électrode qui mesure la différence de courant généré. La spectrométrie de masse est la plus puissante des techniques mais elle est très chère d’utilisation.
Les résultats obtenus pour D. S. Forsyth et al. pour la quantité de méthylmercure dans des poissons prédateurs au Canada tels que le merlin (486 ngHg g−1), requins (849 ngHg g−1), espadon (1 080 ngHg g−1) et thon (25−662 ngHg g−1) varient énormément selon les spécimens, de 25 à 1 081 ngHg g−1. Les plus grosses espèces et individus ont une plus grande concentration, ce qui est normal étant donné que la bioaccumulation est plus élevée chez les plus grosses espèces qui vivent plus longtemps (une quarantaine d'années pour un grand thon rouge). Les pourcentages de recouvrements sont autour de 97 %. Dans le cas de T. Kubella et al., les poissons analysés sont de plus petites tailles et les concentrations varient entre 7 et 143 ngHg g−1 en utilisant la chromatographie gazeuse à détecteur à émission atomique (GC-AED). Le recouvrement est également élevé, supérieur à 90 %.
Des analyses faites au début des années 1970 sur sept spécimens anciens (62 à 93 ans) de thons (et d'espadons de 25 ans) échantillonnés dans les musées laissent penser que ce phénomène n'a pas beaucoup évolué depuis plusieurs décennies[46] (Résumé, en anglais).
Résumé des différentes techniques utilisables
| Technique | Description | Remarque |
| IE-AAS | Lixiviation avec HCl, détection avec échange d'ions et AAS | Applicable seulement dans la détermination du mercure organique |
| GC-ECD | Lixiviation avec acide, extraction avec toluène, GC et détection ECD | En accord avec les autres techniques |
| ETAAS | Lixiviation avec HCl, extraction avec benzène, mercure organique déterminé par ETAAS | Valide seulement si une confirmation GC est effectuée |
| GC-FTIR | Lixiviation avec HCl, extraction avec toluène, GC d'une détection par FTIR | En accord avec les autres techniques |
| GC-MIP-AES | Lixiviation avec HCl, extraction avec toluène, butylation, GC suivie d'une détection par MIP-AES | En accord avec les autres techniques |
| SFE-GC-MIP-AES | Extraction par un fluide supercritique, le CO2 supercritique, élution avec toluène, butylation, GC suivie d'une détection MIP-AES | Recouvrement d'extraction faible |
| GLC-CVAFS | Distillation, éthylation, piège cryogénique, séparation GLC et détection par CVAFS | Faible reproductibilité |
| GC-CVAAS | Lixiviation avec H2SO4, extraction avec toluène, génération d'hydrure, GC et détection avec CVAAS | En accord avec les autres techniques |
| GC-QFAAS | Extraction micro-ondes, éthylation, piégeage cryogénique et détection par QFAAS | En accord avec les autres techniques |
| HPLC-CVAAS | Distillation et complexation, séparation HPLC et détection CVAAS | En accord avec les autres techniques |
| HPLC-CVAFS | Lixiviation avec HCL, extraction avec toluène, complexation, séparation HPLC, réduction avec SnCl2 et détection avec CVAFS | Difficultés avec la complexation du mercaptoéthanol |
| HPLC-ICPMS | Distillation, complexation, oxydation UV, réduction avec NaBH4 et détection avec ICPMS | En accord avec les autres techniques |
- IE-AAS : spectroscopie d’absorption atomique à échangeuse d’ions ;
- GC-ECD : chromatographie gazeuse à détecteur de capture d’électron ;
- ETAAS : spectroscopie d’absorption atomique électrothermique ;
- GC-FTIR : chromatographie gazeuse à infrarouge à transformée de Fourier ;
- GC-MIP-AES : chromatographie gazeuse à plasma induit par micro-ondes et détecteur atomique à émission ;
- SFE-GC-MIP-AES : chromatographie gazeuse à extraction par un fluide supercritique à plasma induit par micro-ondes et détecteur atomique à émission ;
- GLC-CVAFS : chromatographie gaz-liquide à spectroscopie atomique de fluorescence à vapeur froide ;
- GC-CVAAS : chromatographie gazeuse à spectroscopie atomique d’absorbance à vapeur froide ;
- GC-QFAAS : chromatographie gazeuse à spectroscopie atomique d’absorbance à fournaise de quartz ;
- HPLC-CVAAS : chromatographie liquide à haute performance à spectroscopie atomique d’absorbance à vapeur froide ;
- HPLC-CVAFS : chromatographie liquide à haute performance à spectroscopie atomique de fluorescence à vapeur froide ;
- HPLC-ICPMS : chromatographie liquide à haute performance à spectroscopie de masse couplée à un plasma induit.
Voir aussi
Articles connexes
- Mercure (chimie)
- Toxicologie
- Écotoxicologie
- Hydrargisme (intoxication mercurielle)
Liens externes
- http://www.idrc.ca/fr/ev-4845-201-1-DO_TOPIC.html
- Bioamplification du méthylmercure dans le réseau trophique, Ifremer
- Méthylmercure dans le poisson et risque d’accouchement prématuré
- (fr) Publications du Centre de Toxicologie du Québec
- (fr) Tableaux du régime Général sur le site de l’AIMT
- (fr) Guide des maladies professionnelles de l’INRS (tableaux et commentaires)
Bibliographie
- (en) Amin-Zaki L, Elhassani S, Majeed MA, Clarkson TW, Doherty RA, Greenwood M. (1974) Intra-uterine methylmercury poisoning in Iraq. Pediatrics 54:587–595 (Résumé).
- (en) Amin-Zaki L, Elhassani S, Majeed MA, Clarkson TW, Doherty RA, Greenwood MR, Giovanoli-Jakubczak T (1976) Perinatal methylmercury poisoning in Iraq ; Am J Dis Child. Oct; 130(10):1070-6.
- (en) F. Bakir, H. Rustam, S. Tikriti, S. F. Al-Damluji, and H. Shihristani (1980) Clinical and epidemiological aspects of methylmercury poisoning ; Postgrad Med J. January; 56(651): 1–10.PMCID: PMC2426005 (résumé)
- (en) Bloom, N. S., et al. (1997), Artifact formation of methyl mercury during aqueous distillation and alternative techniques for the extraction of methyl mercury from environmental samples, Fresenius J. Anal. Chem., 358(3), 371–377, doi:10.1007/s002160050432
- (en) Grigal D (2002) Inputs and outputs of mercury from terrestrials watersheds: A review, Environ. Rev., 10(1), 1–39, doi:10.1139/a01-013.
- (en) Hamada R, Arimura K, Osame M (1997) Maternal-fetal mercury transport and fetal methylmercury poisoning ; Met Ions Biol Syst. ; 34:405-20.
- (ja) Harada M. Ryoikibetsu Shokogun Shirizu (2000), [Fetal methylmercury syndrome](30 Pt 5):102-4.
- (en) Marsh DO, Myers GJ, Clarkson TW, Amin-Zaki L, Tikriti S, Majeed MA (1980) Fetal methylmercury poisoning: clinical and toxicological data on 29 cases Ann Neurol. Apr; 7(4):348-53.
- (en) Ullrich SM et al. (2001) Mercury in the aquatic environment: A review of factors affecting methylation, Crit. Rev. Environ. Sci. Technol., 31(3), 241–293, doi:10.1080/20016491089226.
- (en) Yorifuji T, Tsuda T, Inoue S, Takao S, Harada M (2011) Long-term exposure to methylmercury and psychiatric symptoms in residents of Minamata, Japan ; Environ Int. Jul; 37(5):907-13. Epub 2011 Apr 5.
- (en) National Academy of Sciences (2000) Toxicological Effects of Methylmercury. National Academy Press, Washington DC. (résumé)
Notes et références
- Meili, M. (1997), Mercury in lakes and rivers, in Metal Ions in Biological Systems, vol. 34, edited by A. Sigel, and H. Sigel, pp. 21–51, Marcel Dekker, New York.
- Hill, W. R., et al. (1996), Mercury speciation and bioaccumulation in lotic primary producers and primary consumers, Can. J. Fish. Aquat. Sci., 53(4), 812–819, doi:10.1139/cjfas-53-4-812.
- Hall BD et al. (2005), Impacts of reservoir creation on the biogeochemical cycling of methyl mercury and total mercury in Boreal Upland Forests, Ecosystems, 8(3), 248–266, doi:10.1007/s10021-003-0094-3, pDF, 19 pages
- Balogh, S. J., et al. (2006), Elevated methylmercury concentrations and loadings during flooding in Minnesota rivers, Sci. Total Environ., 368(1), 138–148, doi:10.1016/j.scitotenv.2005.09.045.
- Paterson, M. J., et al. (1998), Increases in total and methylmercury in zooplankton following flooding of a peatland reservoir, Environ. Sci. Technol., 32(24), 3868–3874, doi:10.1021/es980343l.
- Schetagne, R., et al. (2000), Export of mercury downstream from reservoirs, Sci. Total Environ., 260(1–3), 135–145, doi:10.1016/S0048-9697(00)00557-X.
- Bank, M. S., et al. (2007), Mercury bioaccumulation in green frog (Rana clamitans) and bullfrog (Rana catesbeiana) tadpoles from Acadia National Park, Maine, USA, Environ. Toxicol. Chem., 26(1), 118–125, doi:10.1897/07-035R.1.
- Hammerschmidt, C. R., and W. F. Fitzgerald (2006), Methylmercury in freshwater fish linked to atmospheric mercury deposition, Environ. Sci. Technol., 40(24), 7764–7770, doi:10.1021/es061480i.
- [Environnement Canada, 2010, Le mercure dans l’environnement, http://www.ec.gc.ca/MERCURY/EH/FR/eh-ec.cfm#M, 18/04/2010]
- [Environnement Canada, 2010, Industrie canadienne, http://www.ec.gc.ca/mercure-mercury/default.asp?lang=Fr&n=CF513593-1, 18/04/2010]
- Clarkson, T.W., 1990. Human health risks from methylmercury in fish. Environ. Toxicol. Chem. 9, 821±823.
- David Kirchgessner ; Mercury in Petroleum and Natural Gas : Estimation of Emissions From Production, Processing, and Combustion (PDF), Sept 2001 ou résumé US EPA, Office of Research & Development | National Risk Management Research Laboratory. Voir notamment le chap. 5 ("Mercury in Petroleum and Natural Gas")
- [SEME, mars 2005, Cycle du mercure, http://seme.uqar.qc.ca/09_biotransfert/cycle_du_mercure.htm, 06/04/2010]
- Sellers, P., et al. (1996), Photodegradation of methylmercury in lakes, Nature, 380(6576), 694–697, doi:10.1038/380694a0.
- St. Louis, V. L., et al. (1994), Importance of wetlands as sources of methyl mercury to boreal forest ecosystems, Can. J. Fish. Aquat. Sci., 51, 1065–1076, doi:10.1139/f94-106.
- [Environnement Canada, 2010, Biogéochimie, http://www.ec.gc.ca/mercure-mercury/default.asp?lang=Fr&n=67E16201-1, 06/04/2010]
- Grandjean P, Weihe P, White RF, Debes F, Araki S, Yokoyama K, et al. 1997. Cognitive deficit in 7-year-old children with prenatal exposure to methylmercury. Neurotoxicol Teratol 19:417–428.
- Lawrence, A.L., McAloon, K.M., Mason, R.P., Mayer, L.M., 1999. Intestinal solubilization of particle-associated organic and inorganic mercury as a measure of bioavailability to benthic invertebrates. Environ. Sci. Technol. 33, 1871±1876.
- McAloon, K.M., Lawrence, A.L., Mason, R.P., Mayer, L.M., 1999. Intestinal solubilization of particle-associated organic and inorganic mercury as a measure of bioavailability to benthic invertebrates. Presentation at SETAC Meeting, Philadelphia, November, 1999.
- Mason, R.P., Fitzgerald, W.F., Morel, F.M.M., 1994. The aquatic biogeochemistry of elemental mercury. Geochim. Cosmochim. Acta 58, 3191±3198.
- [Office fédéral de la santé publique OFSP, novembre 2009, Mercure, pp1-4]
- ≈ 17µg / semaine
- Mercury Levels in Commercial Fish and Shellfish, U.S. Food and Drug Administration, accès le 16 août 2009
- Jean-Jacques Perrier, « Le riz, source de mercure ? », sur Pour la Science, (consulté le )
- Wenli Tang & al. (2019) Increased Methylmercury Accumulation in Rice after Straw Amendment | Environ. Sci. Technol.201953116144-6153 ; 15 avril 2019 | https://doi.org/10.1021/acs.est.8b07145
- Émilien Pelletier ; Modification de la bioaccumulation du sélénium chez Mytilus edulis en présence du mercure organique et inorganique ; Can. J. Fish. Aquat. Sci. 43(1): 203–210 (1986); doi:10.1139/f86-023 ; 1986 CNRC Canada (Résumés anglais et français)
- A. Kingman, T. Albertini et L.J. Brown, « Mercury concentrations in urine and whole blood associated with amalgam exposure in a US military population », Journal of Dental Research, 77, 1998, p. 461-471.
- A. Oskarsson, A. Schultz, S. Skerfving et al., « Total and inorganic mercury in breast milk in relation to fish consumption and amalgam in lactating women », Archives of Environmental Health, 51, 1996, p. 234-241.
- K. Becker, S. Kaus, C. Krause et al., « German Environmental Survey 1998 (GerES III): environmental pollutants in blood of the German population », International Journal of Hygiene and Environmental Health, 205, 2002, p. 97-308.
- K. Becker, M. Mussig-Zufika, A. Conrad et al., German Environmental Survey for Children 2003/06 (GerES IV): Levels of Selected Substances in Blood and Urine of Children in Germany (Research Report 202 62 219), Berlin, Germany: Federal Environment Ministry, 2008.
- Department of Health and Human Services, Centers for Disease Control and Prevention, Third National Report on Human Exposure to Environmental Chemicals, Atlanta, Georgia: National Center for Environmental Health, 2005 (NCEH Pub. No. 05-0570)
- Institut national de santé publique du Québec, Étude sur l’établissement de valeurs de référence d’éléments traces et de métaux dans le sang, le sérum et l’urine de la population de la grande région de Québec, Québec, Institut national de santé publique du Québec, 2004 [INSPQ-2004-030].
- [SEME, mars 2005, Pollution de la baie de Minamata par le mercure, 05/04/2010]
- Amin-Zaki L, Elhassani S, Majeed MA, Clarkson TW, Doherty RA, Greenwood M. 1974. Intra-uterine methylmercury poisoning in Iraq. Pediatrics 54:587–595 (Résumé).
- Maury-Brachet, R., Gentes, S., Dassié, E. P., Feurtet-Mazel, A., Vigouroux, R., Laperche, V., ... & Legeay, A. (2019) Mercury contamination levels in the bioindicator piscivorous fish Hoplias aïmara in French Guiana rivers: mapping for risk assessment. Environmental Science and Pollution Research, 1-13 (résumé)
- Boucher O, Bastien CH, Saint-Amour D, Dewailly É, Ayotte P, Jacobson JL, et al. 2010. Prenatal exposure to methylmercury and PCBs affects distinct stages of information processing : an event-related potential study with Inuit children. Neurotoxicology 31:373–384
- (en) Braun JM, Kahn RS, Froehlich T, Auinger P, Lanphear BP « Exposures to environmental toxicants and attention deficit hyperactivity disorder in U.S. children » Environ. Health Perspect. 2006;114(12):1904–9.
- Ha M, Kwon HJ, Lim MH, Jee YK, Hong YC, Leem JH, et al. 2009. Low blood levels of lead and mercury and symptoms of attention deficit hyperactivity in children: a report of the children’s health and environment research (CHEER). Neurotoxicology 30:31–36.
- Olivier Boucher, Sandra W. Jacobson, Pierrich Plusquellec, Éric Dewailly, Pierre Ayotte, Nadine Forget Dubois, Joseph L. Jacobson et Gina Muckle, Prenatal Methylmercury, Postnatal Lead Exposure, and Evidence of Attention Deficit/Hyperactivity Disorder among Inuit Children in Arctic Québec; Environmental Health Perspectives / Research | Children’s Health ; volume 120, N°10, October 2012
- S. Forsyth, V. Casey, W. Dabeka, A. McKenzie, Food Additives and Contaminants, Vol. 21, No.9, 2004, 849-856
- [F. Ubillus, A. Alegria, R. Barbera, R. Farré, M. J. Lagarda, Food Chemistry, 71, 2000, 529-533]
- [L. Abranko, B. Kmellar, P. Fodor, Microchemical Journal, 85, 2007, 122-126]
- [T. Kuballa, E. Leonhardt, K. Schoeberl, W. Lachenmeier., Eur Food Res Technol., 2009, 228, 425-431]
- [X. Fain, C. Ferrari, 2003, Étude la faisabilité de la mise au point d’un analyseur en continu du méthylmercure dans l’atmosphère, http://www.primequal.fr/files/doc/5ab9b23c0d399ebf.doc, 09/04/2010]
- [Y. Cai, S. Monsalud, K. G. Furton, R. Jaffé, R. D. Jones, Appl. Organometal. Chem. 12, 1998, 565-569]
- G. E. Miller, P. M. Grant, R. Kishore, F. J. Steinkruger, F. S. Rowland et V. P. Guinn, Mercury Concentrations in Museum Specimens of Tuna and Swordfish ; Science 10 March 1972: Vol. 175 no. 4026 pp. 1121-1122 DOI: 10.1126/science.175.4026.1121
- [P. Quevauviller, J. Environ.Monit., 2000, 2, 292-299]
- Portail de la chimie