Extraction par un fluide supercritique
L'extraction par un fluide supercritique (EFS) est un procédé d'extraction d'un soluté d'une substance en utilisant un fluide supercritique comme solvant d'extraction. Ce procédé ressemble au procédé d'extraction par un liquide.
Fluide supercritique
Le dioxyde de carbone (CO2) supercritique est le fluide le plus utilisé. Ses avantages sont surtout sa non toxicité et son inertie chimique. Lors de l'extraction, les conditions d'utilisation du dioxyde de carbone supercritique sont au-dessus de ses points critiques (température critique 31 °C et pression critique 74 bar).
Le dioxyde de carbone est apolaire et donc a quelquefois de faibles pouvoirs de dissolution et ne peut donc pas être utilisé comme solvant surtout pour les solutés polaires. Pour surmonter cette limitation, il est quelquefois accompagné de co-solvants comme l'éthanol ou le méthanol.
Procédé
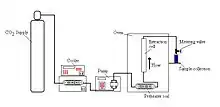
L'extraction se fait en deux étapes :
- extraction du soluté avec le fluide supercritique maintenu au-dessus de ses points critiques (pression élevée entre 70 et 350 bar et température critique).
- séparation du fluide supercritique du soluté. La récupération du fluide à l'état gazeux se fait en réduisant la pression ou en variant la température. Le fluide supercritique perd alors son pouvoir de dissolution et le produit extrait précipite.
Avantages
Comparés aux solvants conventionnels, les solvants supercritiques ont les avantages suivants[1] :
- absence de solvant toxique résiduel (pour le dioxyde de carbone en particulier) ;
- faible coût du solvant utilisé (CO2 ou eau en général) ;
- la possibilité de faire varier les conditions d'extraction (température et pression) rendent ces solvants "modulables", ce qui permet d'ajuster la solubilité et la sélectivité de l'extraction pour les produits extraits ;
- les solutés diffusent rapidement dans les solvants supercritiques.
Comparée aux techniques d'extraction conventionnelles (Soxhlet, Twisselmann, etc.), l'extraction au CO2 supercritique est plus rapide et la température est plus faible, ce qui permet de récupérer les matières thermosensibles. Le milieu d'extraction est récupéré facilement sans avoir besoin d'une étape supplémentaire pour le séparer de la matrice[2].
Limites
Les coûts de l'investissement sont souvent élevés comparés à ceux de l'extraction par liquide. Ceci résulte surtout du besoin de la pression élevée lors de l'étape d'extraction. Les couts opératoires sont par contre comparable où plus réduits en raison du faible coût des solvants. La limite liée à l'investissement peut parfois être compensée lorsque la solubilité des produits est élevée. C'est aussi le cas lorsque les avantages liés à la non toxicité, la qualité des produits ou la spécificité de l'extraction viennent justifier son coût[3].
Applications
L'extraction par un fluide supercritique peut être utilisée pour préparer des échantillons dans le but de les analyser ou à un niveau plus grand pour enlever des composés indésirables comme la caféine du café ou pour collecter des composés intéressants comme les huiles essentielles.
Types
Selon la substance de laquelle le soluté doit être extrait, l'extraction peut être[4] :
- une extraction solide-fluide supercritique : cette méthode suit le même principe que l'extraction solide-liquide. Les applications industrielles majeures sont la décaféination du café et du thé avec du CO2 et l'extraction des fractions amères du houblon.
- une extraction liquide-fluide supercritique : cette méthode suit le même principe que l'extraction liquide-liquide. L'exemple le plus connu est l'extraction des acides gras polyinsaturés présents dans les huiles et les graisses des poissons et de certains végétaux.
Références
- Jimmy L. Humphrey, George E. Keller, Procédés de séparation, Techniques, sélection, dimensionnement, Collection: Technique et Ingénierie, Dunod/Industries et Technologies, 2001.
- Priscilla C. Veggi, Julian Martinez et M. Angela A. Meireles, Chapter 2 Fundamentals of Microwave Extraction, Microwave-assisted Extraction for Bioactive Compounds Theory and Practice, 2013
- (en) M. Perrut, J-Y Clavier, « Supercritical Fluid Applications: Industrial Developments and Economic Issues », Ind. Eng. Chem. Res 39,12 4531-4535, (lire en ligne)
- Martine Poux, Patrick Cognet, Christophe Gourdon, Génie des procédés durables, Du concept à la concrétisation industrielle, Collection: Technique et Ingénierie, Dunod/L'Usine Nouvelle, 2010.