Grand cachalot
Physeter macrocephalus, Physeter catodon • Cachalot, Cachalot macrocéphale
Pour les articles homonymes, voir Cachalot.

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Infra-ordre | Cetacea |
| Micro-ordre | Odontoceti |
| Super-famille | Physeteroidea |
| Famille | Physeteridae |
| Genre | Physeter |
- P. catodon Linnaeus, 1758
- P. microps Linnaeus, 1758
- P. tursio Linnaeus, 1758
- P. australasianus Desmoulins, 1822
- P. australis Gray, 1846

VU A1d : Vulnérable
A1d[1]
Statut CITES
Le grand cachalot (Physeter macrocephalus ou P. catodon), communément appelé cachalot et parfois cachalot macrocéphale, est une espèce de cétacés à dents de la famille des physétéridés et unique représentant actuel de son genre, Physeter. Il est l'une des trois espèces encore vivantes de sa super-famille, avec le cachalot pygmée (Kogia breviceps) et le cachalot nain (K. sima). Il a une répartition cosmopolite, fréquentant tous les océans et une grande majorité des mers du monde. Cependant, seuls les mâles se risquent dans les eaux arctiques et antarctiques, les femelles restant avec leurs jeunes dans les eaux plus chaudes.
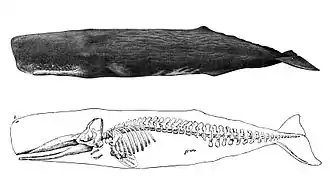
Le mâle peut atteindre plus de 20 m de long, ce qui fait de l'espèce le plus grand carnassier au monde. À elle seule, la tête peut représenter le tiers de la longueur de l'animal. Ce mammifère se nourrit en grande partie de calmars, ainsi que de poissons, en des proportions variables selon l'emplacement géographique. Il est connu pour ses records de plongée en apnée, atteignant les 900 mètres de profondeur, performance qu'aucun mammifère, mis à part la baleine de Cuvier[Note 1] ne peut réaliser. Ses vocalisations en cliquetis sont les sons les plus forts produits par un animal, elles sont utilisées dans le but de communiquer, de s'identifier et de se localiser entre eux[2].
Les cachalots se rassemblent en groupes nommés « pods ». Les femelles vivent avec leurs jeunes, séparément des mâles, et s'entraident pour protéger et allaiter les juvéniles. Elles mettent bas tous les trois à six ans et s'occupent de leur progéniture durant plus d'une dizaine d'années.
Le cachalot n'a pas de prédateurs naturels assez forts pour attaquer avec succès un adulte en bonne santé, seuls les orques peuvent essayer de se fondre dans un pod pour y tuer les plus jeunes. Cependant, du XVIIIe siècle jusqu'à la fin du XXe siècle, la chasse au cachalot par l'homme, qui a inspiré le roman Moby-Dick, a été une industrie majeure pour extraire le spermaceti, l'huile de cachalot, l'ambre gris et l'ivoire de l'animal. En raison de sa taille, le cachalot pouvait parfois se défendre efficacement contre les baleiniers. L'exemple le plus célèbre est celui d'un cachalot de 25 m[3] ayant attaqué et coulé le baleinier américain Essex en 1820. Les populations de cachalots sont lourdement touchées par cette chasse intensive et diminuent de 67 %. La commission baleinière internationale proclame la pleine protection de l'espèce en 1985 qui est depuis classée comme vulnérable.
Description
Mensurations
| Longueur | masse | |
|---|---|---|
| Mâle | 16 m | 41 000 kg |
| Femelle | 11 m | 14 000 kg |
| Nouveau-né | 4 m | 1 000 kg |

Certains mâles adultes mesurant jusqu'à 20,5 m de long et ayant une masse de 57 t, le cachalot est le plus grand des cétacés à dents[5],[6]. À titre de comparaison, les deuxièmes plus grandes baleines à dents, les bérardies, mesurent 12,8 m pour une masse allant jusqu'à « seulement » 15 t[7]. Le Nantucket Whaling Museum possède ainsi une mandibule de 5,5 m de long, provenant d'un individu mesurant, par extrapolation, 24 m de long. Le spécimen qui aurait coulé l'Essex (l'un des incidents derrière la légende de Moby Dick) a été décrit comme mesurant 26 m de long[8]. Cependant, ces individus « hors normes » deviennent rarissimes, la chasse à la baleine systématique ayant conduit à une diminution de leur taille moyenne : les grands mâles étaient très recherchés, surtout après la Seconde Guerre mondiale. Aujourd'hui, ceux-ci ne dépassent généralement pas 18,3 m de longueur ou une masse de 51 t[4].
Le dimorphisme sexuel chez l'espèce est l'un des plus marqués parmi tous les cétacés. À la naissance, les représentants des deux sexes sont à peu près de la même taille[4], mais les mâles adultes sont généralement 30 % à 50 % plus longs et jusqu'à trois fois plus lourds[5]. En effet les femelles pèsent en moyenne 14 t pour 11 m de long alors que les mâles pèsent, également en moyenne, 41 t pour 16 m de long[4].
Morphologie générale

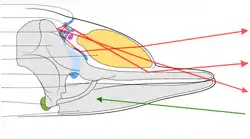
L'énorme tête de l'animal est très distinctive. Quasiment parallélépipédique, elle représente près du tiers du cétacé et peut peser 16 t. L'évent est situé très près de l'extrémité de la tête et est déporté sur le côté gauche[5]. Cela donne au souffle de l'animal un angle de pulvérisation caractéristique, orienté à la fois vers l'avant et vers la gauche, cas unique chez les cétacés.
La queue de l'animal est triangulaire et fendue par une profonde encoche caudale. Très épaisse et puissante, elle mesure jusqu'à 4 m de large et le cétacé la lève hors de l'eau lorsqu'il plonge[5]. Le cachalot n'a pas de nageoire dorsale à proprement parler, mais une série de crêtes sur le tiers postérieur du dos. La plus grande de celles-ci — une bosse triangulaire — peut être confondue avec une nageoire dorsale en raison de sa forme[4]. Les nageoires pectorales sont quant à elles, petites.
Le corps est gris foncé ou noir avec quelques taches sur le ventre. Sa surface peut comporter des marques rectilignes et de nombreuses cicatrices, dues aux combats entre les mâles ou avec des calmars géants. Contrairement à la peau lisse de la plupart des grandes baleines, la peau du dos est habituellement noueuse et peut être comparée à celle d'un pruneau[9]. La peau est normalement d'un gris uniforme, mais peut paraître brune en plein soleil. Des individus albinos ont également été signalés[10],[11]. Dans les eaux chaudes, les cachalots muent en permanence, perdant de grands lambeaux de peau souvent consommés par les poissons des alentours et permettant ainsi aux cétacés de se débarrasser de certains de leurs parasites. Cette mue est moins fréquente dans les plus hautes latitudes[12]. Les cachalots peuvent parfois en groupe se frotter les uns contre les autres pour mieux se débarrasser de leur épiderme[13].
Mâchoire et denture
Les lèvres du cachalot sont blanches, les dents sont coniques et peuvent atteindre le kilogramme pour une longueur de 20 cm[14],[15]. L'animal a 20 à 26 dents de chaque côté de sa mâchoire inférieure[5]. Leur utilité est globalement inconnue puisqu'elles ne semblent pas être nécessaires pour capturer ou manger les calmars, des individus édentés et pourtant bien portants ayant été signalés. On a avancé l'idée que les dents sont principalement utilisées lors d'affrontements entre mâles[16]. Ceux-ci présentent souvent des cicatrices qui semblent être causées par des dents. Des dents rudimentaires peuvent garnir la mâchoire supérieure, mais elles poussent rarement[17]. L'ivoire de ces animaux — lorsqu'il était disponible — a occasionnellement été travaillé par l'homme.
Respiration et plongée
Les cachalots sont, devant les baleines à bec et les éléphants de mer, les mammifères marins plongeant le plus profondément (depuis 2018, la baleine de Cuvier s’est placée au premier rang avec un record de profondeur de 2 992 mètres et une durée en immersion de 138 minutes). Ce cétacé peut rester immergé durant 90 minutes et on a démontré, grâce à des enregistrements vidéo, que les cachalots mâles peuvent approcher le kilomètre (3000 pieds) de fond[18]. Du reste, l'analyse des contenus stomacaux laisse à penser qu'ils pourraient atteindre la profondeur abyssale de 2 000 m[19],[20]. Pour autant, l'animal chasse généralement entre 300 m et 1 000 m[21], les plongées typiques ayant une profondeur moyenne de 400 m pour une durée de 35 minutes[5]. Dans ces grandes profondeurs, des cachalots se sont d'ailleurs emmêlés dans les câbles téléphoniques transocéaniques, provoquant leur noyade[22]. Horizontalement, sa vitesse de croisière ne dépasse pas 8 km/h, mais il peut faire des pointes jusqu'à près de 30 km/h[23].

Le cachalot présente plusieurs adaptations pour faire face aux énormes différences de pression lors de ses plongées. La cage thoracique flexible permet d'éviter l'écrasement des poumons et le métabolisme peut être ralenti (bradycardie) pour économiser l'oxygène[20],[24],[25]. Les veines sont grosses et élastiques, les retia mirabilia peuvent stocker de grandes quantités de sang et combler les vides créés par la compression de l'air[26]. La myoglobine, qui stocke l'oxygène dans les tissus musculaires, est beaucoup plus abondante que chez les animaux terrestres[27],[Note 2]. Pour comparaison, chez un cachalot, on trouve 5,7 g de myoglobine pour 100 g de muscle, contre 0,5 g chez l'homme[28]. Le sang a un taux élevé de globules rouges qui contiennent l'hémoglobine transportant l'oxygène. Le sang oxygéné peut être redirigé vers le cerveau et d'autres organes essentiels quand le niveau d'oxygène général décroît[29],[30],[31]. L'organe du spermaceti peut également ajuster la flottabilité[32] (voir la section « Spermaceti »).
Bien que les cachalots montrent de telles adaptations, les plongées répétées à de grandes profondeurs ont toutefois des effets à long terme. Des lésions aux os, dues à des bulles d'azote mal éliminées et creusant de petites cavités, sont les séquelles de maladies de décompression, comme celles retrouvées chez les humains. Les squelettes âgés présentent davantage ce type de nécroses, tandis que les jeunes ne présentent aucune lésion. Ces observations indiqueraient que les cachalots sont également sujets aux accidents de décompression et qu'une remontée trop rapide vers la surface pourrait leur être fatale[33].
Entre les plongées, le cachalot fait surface pour respirer durant généralement huit minutes avant de replonger[5]. Comme les autres odontocètes (ou baleines à dents), le cachalot respire par un seul évent, d'une vingtaine de centimètres et en forme de S, mais chez le cachalot, cet évent unique résulte de la fusion de deux conduits. L'animal respire 3 à 5 fois par minute au repos, et 6 à 7 fois par minute après une plongée. Le souffle est bruyant, constitué d'un jet simple pouvant s'élever jusqu'à 15 m au-dessus de la surface de l'eau, ainsi que pointant vers l'avant et la gauche selon un angle de 45°. Femelles et juvéniles respirent en moyenne toutes les 12,5 secondes avant de plonger, contre une moyenne de 17,5 secondes pour les grands mâles[34]. La vitesse du cachalot avoisinerait les 7 km/h pour une remontée effectuée à 9 km/h : en près d'un quart d'heure, l'animal aurait le temps de descendre à un kilomètre de profondeur et d'en remonter[28].
Cerveau et sens
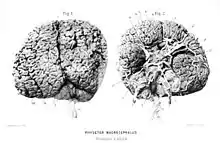
Avec une masse moyenne de huit kilogrammes, le cerveau du cachalot détient le record de masse du monde animal actuel et même fossile[35],[36]. Cependant, le cachalot a un coefficient d'encéphalisation plus faible que de nombreuses autres espèces de baleines et dauphins, encore inférieurs à celui des singes anthropoïdes et beaucoup plus faible que celui de l'humain[36],[37]. Son intelligence et ses capacités cérébrales sont très mal connues, car il est très difficile de l'étudier vivant. Les recherches actuelles laissent penser qu'il pourrait dormir totalement (des deux hémisphères du cerveau) pendant de courtes périodes, en se positionnant à la verticale, la tête juste au-dessous de la surface de l'eau[38],[15].
En raison des matières en suspension qui limitent le champ visuel, mais aussi du fait que les yeux des cachalots ne peuvent pas pivoter dans leurs orbites et que la chambre antérieure de l'œil est vestigiale, il est fort probable que l'écholocation soit un sens plus important que la vision pour ces animaux[39]. Comme les autres baleines à dents (sous-ordre des odontocètes), les cachalots utilisent donc le principe du sonar pour trouver des proies, leur habitat présentant des caractéristiques acoustiques et une absorption par l'eau favorables. Le son sortant est généré par la vibration de l'air poussé dans les narines osseuses au travers des lèvres phoniques (aussi appelées « museau de singe »), une structure située dans le sommet de la tête[40]. Le crâne, le melon et les divers sacs aériens de sa tête jouent tous un rôle important dans la formation et la focalisation du son. La mâchoire inférieure est la principale voie de réception de l'écho. Un canal entièrement rempli de graisse transmet celui-ci à l'oreille interne[41],[42].
Spermaceti
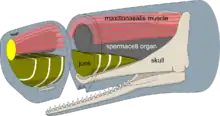
Le spermaceti, principalement constitué d'ester cétylique de palmitate (un lipide de la classe des cérides) et d'alcool cétylique[43], est stocké dans l'organe à spermaceti. Cet organe est constitué de deux grands sacs placés au-dessus de la mâchoire supérieure et protégés dans leur partie supérieure par une couche de lard[28]. L'organe du mâle est beaucoup plus grand que celui de la femelle. Cela peut être un cas de sélection sexuelle, permettant aux mâles de disputer les femelles en se concurrençant par leurs productions sonores[44]. Un cachalot adulte peut avoir jusqu'à une tonne de spermaceti[45]. Anatomiquement, une narine débouche vers l'extérieur et forme l'évent tandis qu'une narine interne s'appuie contre la poche contenant le spermaceti[46].
L'organe à spermaceti peut servir au cétacé à ajuster sa flottabilité : avant la plongée, l'eau froide entre dans l'organe et la substance cireuse se solidifie, celle-ci cristallisant aux alentours des 31 °C[32],[47],[28]. L'augmentation de la densité relative génère une force vers le bas d'environ 392 newtons et permet à l'animal de plonger avec moins d'effort. Au cours de la chasse, la consommation d'oxygène produit de la chaleur qui fait fondre le spermaceti, ce qui augmente la flottabilité et permet au cachalot de remonter à la surface plus facilement[48].
Dans le roman Moby Dick de Herman Melville, il est suggéré que l'organe contenant le spermaceti ait évolué comme une sorte de bélier que les cachalots mâles utilisent pour combattre[49]. Cette hypothèse est cohérente avec les naufrages bien documentés de l'Essex et de l'Ann Alexander, navires coulés par des individus ne pesant probablement pas plus que le cinquième de leur masse[50].
L'organe qui est un melon évolué, pourrait également faciliter l'écholocation. En effet, la forme variable de l'organe peut concentrer ou étendre le faisceau sonore[46].
Écologie et comportement
Organisation et comportement sociaux

Les cachalots sont grégaires, formant des groupes de tailles différentes principalement en fonction du sexe. Les femelles sont philopatriques et vivent en groupes comptant 20 à 40 individus avec leurs petits et les jeunes mâles. Elles sont souvent attachées à leur pod[51], pouvant rester plus d'une dizaine d'années dans un même groupe. Les jeunes mâles quittent ces regroupements à partir de l'âge de 4 à 21 ans et rejoignent des groupes de jeunes de leur âge et de leur taille comptant au maximum une cinquantaine d'individus[52]. En vieillissant, ils ont tendance à se disperser en petits groupes, et les plus vieux mâles mènent généralement une vie solitaire. Toutefois, certains mâles d'âge mûr se regroupent, ce qui suggère un degré de coopération qui n'est pas encore bien compris[5]. Parfois, différents troupeaux s'unissent pour former des hardes de plusieurs centaines d'individus[53].
Hormis la chasse d'origine humaine, d'autres prédateurs peuvent s'en prendre au cachalot, principalement l'orque (Orcinus orca) ou même les dauphins-pilotes (Globicephala) et la fausse orque (Pseudorca crassidens), attaquant parfois les femelles et les jeunes, qui sont particulièrement vulnérables[54],[55]. La plupart de ces prédateurs essayent d'isoler un juvénile du groupe, mais les mâles cachalots repoussent ces attaques en encerclant leur progéniture. Les adultes contrent les orques à l'aide de leur nageoire caudale, soit vers l'extérieur, soit vers l'intérieur afin de se battre avec leurs dents[5]. Cette formation en « marguerite » est également utilisée pour protéger un individu blessé. Un comportement que les baleiniers ont su exploiter : en blessant un seul cachalot, ils attiraient le groupe entier dont il est issu[56]. Si les orques sont suffisamment nombreuses, elles peuvent parfois tuer une femelle adulte. Quant aux grands cachalots mâles, il est probable qu'ils n'ont pas d'autres prédateurs que l'humain, leur grande corpulence et leur force redoutable les laissant à l'abri d'attaques d'orques[57].
Vocalisations
| Fichiers audio | |
| Une série de clics normaux. | |
| Une série de clics rapides. | |
Des difficultés à utiliser ces médias ? | |
|---|---|
Les cachalots ne produisent pas les « chants » des grandes baleines à fanons mais utilisent des cliquetis (ou clics) organisés en séquences types appelées « codas »[58]. Ces clics portent à plusieurs kilomètres et servent à l'écholocation ainsi qu'à la communication[15]. Les sons pouvant avoisiner les 130 décibels ont également été soupçonnés de servir à étourdir les proies du cachalot (voir la section « Prospection ») ; en phase de chasse, il produit des clics très rapprochés formant des « bourdonnements » (buzz). Deux cétologistes de l'université Dalhousie, Luke Rendell et Hal Whitehead sont parvenus à identifier en 2002 des « clans vocaux » (vocal clans), des groupes sociaux réunis par un même « langage », ou plus prosaïquement et plus prudemment des groupes d'individus socialement unis et dont les vocalisations partagent une structure ou des motifs propres au groupe[59].
Cycle de vie et reproduction

Les cachalots, qui peuvent vivre jusqu'à plus de 70 ans[4],[10],[60], sont un excellent exemple d'espèce à stratégie K. La stratégie K est une stratégie de reproduction liée à un environnement stable, un faible taux de natalité, une aide importante des parents apportée à la descendance, la maturation lente et une longévité élevée[5].
Leur manière de choisir leur partenaire n'a pas été définitivement établie. Il est prouvé que les mâles possèdent des relations hiérarchiques et il est également prouvé que le choix des femelles a une influence sur l'accouplement[61]. Les mâles se livrent à de violents combats de janvier à juin pour établir leur dominance avant la saison de reproduction[15]. Le pénis est rétractable, invaginé au repos, et les testicules sont internes pour favoriser l'hydrodynamisme. Les mamelles se situent dans des sillons latéraux de chaque côté de la vulve[15],[62]. Après une gestation de 14 à 16 mois, la femelle met bas d'un unique jeune de 4 m et de plus d'une tonne[4], de couleur plus claire que les adultes[15]. Pour prévenir des attaques d'orques ou de grands requins, les jeunes restent constamment aux côtés de leur mère, sauf si celle-ci plonge profondément. La période de lactation dure généralement de 19 à 42 mois, mais les jeunes peuvent téter jusqu'à 13 ans, parfois même auprès d'autres que leur mère. Les femelles ont généralement des intervalles entre les naissances de trois à six ans[4]. Les jeunes sont nourris d'un lait quinze fois plus gras que le lait de vache et mettent sept à huit ans pour doubler de longueur[15].
Les femelles atteignent leur maturité sexuelle entre 7 et 13 ans, tandis que les mâles l'atteignent à partir de 18 ans. Après avoir atteint la maturité sexuelle, ces derniers se déplacent vers les hautes latitudes où l'eau est plus froide et les ressources alimentaires sont plus abondantes[4] alors que les femelles sont plutôt sédentaires et restent à des latitudes plus basses. Elles sont seulement rejointes par les mâles pour copuler entre la fin de l'hiver et le début de l'été[63]. Ce semi-grégarisme est à l'origine d'un brassage génétique plus important des matériels mâles[64]. Les mâles atteignent leur taille adulte à environ 50 ans et peuvent alors constituer un groupe et s'accoupler[5].
Régime alimentaire

| Lieu | Composition |
|---|---|
| Sud de l'Australie[65] | Onychoteuthidae (36,5 %) Architeuthidae (13,6 %) Pholidoteuthidae (11,4 %) |
| Pérou et Chili[66] | Histioteuthis (56 %) (Histioteuthidae) Dosidicus gigas (32 %) (Ommastrephidae) Vampyroteuthis infernalis (3 %) (Vampyroteuthidae) |
| Brésil[67] | Ommastrephidae (33,1 %) Onychoteuthidae (18,5 %) |
| Açores[68] | Octopoteuthidae (39,8 %) Histioteuthidae (32,7 %) Architeuthidae (12,1 %) |
| Ouest du Canada[69] | Moroteuthis robusta (61,9 %) (Onychoteuthidae) Berryteuthis magister (17,6 %) (Gonatidae) |
| Nord-Est Atlantique[70] | Taningia (79 %) (Octopoteuthidae) Gonatus (13,9 %) (Gonatidae) Teuthowenia (3,4 %) (Cranchiidae) |
| Islande et Groenland[71] | Histioteuthidae (38 %) Cranchiidae (25 %) |
Le grand cachalot se nourrit de nombreuses espèces de calmars de toutes tailles, notamment le calmar géant et le calmar colossal, de pieuvres ainsi que de divers poissons démersaux, comme les raies et parfois de pinnipèdes (phoques). Bien que la composition de leur alimentation varie selon leur lieu de vie et que certaines proies puissent être ingérées accidentellement, leur régime alimentaire est principalement composé de calmars de taille moyenne — on qualifie ainsi le cachalot de teuthophage[72]. La plupart des connaissances sur les calmars en haute mer ont été obtenues à partir de spécimens extraits de l'estomac de cachalots, bien que des études plus récentes aient été menées sur les matières fécales. Concernant ses proies plus rares, on suppose que le cachalot puisse être un prédateur du requin grande gueule (Megachasma pelagios), une espèce rare, de grande taille, découverte dans les années 1970[73],[74]. En effet, on a observé trois cachalots en train d'attaquer ou de jouer avec un requin grande gueule[75]. Dans un cas exceptionnel, on a découvert un requin pèlerin (Cetorhinus maximus) de 2,5 m dans l'estomac d'un cachalot des Açores[23].
Les études présentent des résultats sensiblement différents selon le lieu. À partir du nombre et de la taille des becs de calmar trouvés dans l'estomac du cétacé, parmi la chair déjà bien digérée, la masse des « propriétaires » de ces restes chitineux peut être estimée, donnant une appréciation intéressante de la consommation de céphalopodes car exprimée en unités de masse. Diverses études sont résumées dans le tableau ci-contre. Une étude réalisée aux Galápagos qui n'est pas reportée car se restreignant au nombre de becs, a constaté que les calmars des genres Histioteuthis (62 %), Ancistrocheirus (16 %) et Octopoteuthis (7 %), pesant entre 12 et 650 grammes, étaient les prises dominantes[76]. Une étude menée au sud de l'Australie utilise les contenus stomacaux de spécimens échoués et a conclu que les variations constatées ne sont pas liées à l'âge mais à l'emplacement géographique (lieu de l'échouage en l'occurrence) et au sexe. La même étude a également constaté la présence en abondance de nématodes, et ce dans tous les estomacs, ainsi que des matières plastiques relativement peu rares, des crustacés et autres invertébrés[65]. Une étude plus ancienne, par l'examen de cachalots capturés par la flotte baleinière de Nouvelle-Zélande dans la région du détroit de Cook, a trouvé un rapport de masse calmar/poisson de 1,69:1[77]. Le bec d'un calmar peut parfois conduire à la production d'ambre gris dans le cæcum du cétacé, sous forme de concrétions et de manière analogue à la production de perles par certains mollusques ou des bézoards des ruminants[78],[79]. L'irritation de l'intestin causée par les becs de calmars stimule la sécrétion de cette substance comme lubrifiant.
Les quelques poissons consommés par le cachalot sont notamment le thon, le barracuda et le requin[23]. Les cachalots ingurgitent autour de 3 % de leur masse corporelle par jour. Les quelque 85 000 cachalots vivant près de l'Antarctique dans les eaux froides de l'océan Austral, pourraient consommer en quatre mois près de 12 millions de tonnes de céphalopodes[23] ; la consommation annuelle totale de proies des cachalots dans le monde est estimée à environ 100 millions de tonnes, un chiffre supérieur à la consommation totale d'animaux marins par l'homme chaque année[80].
Prospection

La recherche de nourriture occupe une grande partie du temps du cachalot. Il plonge habituellement entre 300 et 800 m, mais parfois de 1 000 à 2 000 m de profondeur à la recherche de ses proies ; ces plongées peuvent durer plus d'une heure[81]. Les batailles entre le cachalot et le calmar colossal (qui peut peser près de 500 kg) n'ont jamais été observées, mais les cicatrices blanches sont susceptibles d'avoir été causées par ce dernier. Une étude publiée en 2010 suggère que les femelles cachalots peuvent coopérer pour chasser le calmar de Humboldt (Dosidicus gigas)[82].

On ne sait pas bien pourquoi la tête du cachalot est si grande par rapport à la mâchoire inférieure. Une théorie suppose que la capacité du cachalot à utiliser l'écholocation avec sa tête lui permet de chasser dans les grandes profondeurs. Cependant, les calmars — ses proies principales — peuvent avoir des propriétés acoustiques trop semblables à celles de l'eau de mer pour réfléchir le son[83]. La tête du cachalot contient une structure, appelée « museau de singe », par laquelle passe l'air qu'il expire. Cela peut créer des clics qui ont un niveau d'émission maximal à une distance d'un mètre de 230 décibels — par rapport à une pression acoustique d'un micropascal — en d'autres termes il est de loin le son le plus fort produit par un animal, de 10 à 14 dB plus fort que le son d'une puissante arme à feu à un mètre[84]. Les scientifiques pensent alors que ces clics permettraient d'étourdir les proies, mais les études expérimentales étant incapables de reproduire les lésions supposées, cette hypothèse reste douteuse[85].
Une hypothèse plus ancienne ferait du cachalot un chasseur à l'affût : stagnant en profondeur entre deux eaux ou sur le plancher océanique, stabilisé grâce à son spermaceti, il attendrait immobile ses proies bioluminescentes attirées par les taches blanches parsemant ses mâchoires ; cette hypothèse serait par ailleurs confortée par la présence de cachalots noyés empêtrés dans les câbles sous-marins[15],[23]. Les cachalots volent parfois de la morue charbonnière et de la légine au bout des longues lignes de pêche. Les pêcheurs à la palangre du golfe d'Alaska se plaignent que les cachalots profitent de leurs campagnes de pêche pour manger le produit de leur labeur, épargnant ainsi aux cachalots l'effort de la chasse[86]. Pourtant la quantité de poissons ainsi saisie par le cachalot est moindre par rapport à ses besoins quotidiens.
Importance écologique
Positionné au sommet de la pyramide alimentaire marine et cela jusqu'à de grandes profondeurs, le grand cachalot est un superprédateur qui joue un rôle majeur dans le milieu marin, en régulant notamment les populations de pieuvres et de grands calmars. En effet, il n'existe pratiquement pas de compétiteurs dans sa niche écologique, il profite donc de l'importante source de protéines que constituent ces céphalopodes. Sa chasse avait par ailleurs causé sa régression qui a affecté la répartition et certains équilibres au sein des populations halieutiques.
Par un phénomène de cause à effet, il semble que cette régression puisse aussi participer au dérèglement climatique, lequel peut à son tour affecter les populations de tout ou une partie des cétacés. L'océan Austral est naturellement assez pauvre en fer, un oligo-élément vital et puissant stimulant de la photosynthèse phytoplanctonique à la base de la « pompe à carbone » océanique, ce qui devrait limiter sa productivité et ses fonctions de puits de carbone. En 2010, des chercheurs australiens de l'université Flinders ont montré que les grands cétacés jouaient un rôle important dans le recyclage du fer au sein de l'écosystème marin : en chassant à grande profondeur, les 12 000 cachalots de l'Antarctique remontent via leurs excréments de la matière organique et des oligo-éléments dont quelque 400 000 tonnes de carbone. Cette quantité suffit à stimuler un puits de carbone environ deux fois plus important que l'émission de CO2 de ces animaux par respiration. Ce phénomène aurait pu être dix fois plus important si l'espèce n'avait pas été pourchassée durant deux siècles[87]. En outre, en renforçant ainsi le « recyclage du fer » de la production primaire, les cachalots de la zone australe contribuent aussi à permettre et entretenir une importante chaîne alimentaire.
Comme sa densité est plus faible que celle de l'eau, contrairement à d'autres cétacés, une fois mort, le cachalot flotte à la surface. Ainsi, il ne participe pas ou peu à la création d'écosystèmes éphémères créés par les carcasses de baleines qui tombent sur la plaine abyssale[45].
Parasites
Comme toutes les baleines, le grand cachalot constitue un support pour de nombreux parasites. On distingue les parasites internes et externes :
- les parasites internes, de petits invertébrés tels que des vers plats (trématodes, cestodes), des nématodes ou des acanthocéphales, peuvent même pour certains se révéler dangereux pour leur hôte : en se multipliant dans les conduits auditifs, ils provoquent le dysfonctionnement du sonar ; n'ayant plus de repères, le cachalot s'échoue, ne peut plus chasser ou n'arrive plus à éviter les obstacles ;
- les parasites externes évoluent sur l'épiderme du cachalot en mangeant leur peau ou en nettoyant les plaies purulentes. Ce sont en général des crustacés, notamment copépodes ou amphipodes. Ces derniers peuvent être dotés de puissants crochets qu'ils ancrent très solidement dans la peau, laissant de grosses cicatrices[15]. Ils ciblent les zones où la peau est la plus tendre, au niveau par exemple des parties génitales, de l'évent ou des paupières et sucent le sang du cétacé[88]. Parmi eux, le cyamidé Neocyamus physeteris est spécifique au cachalot : il est le plus commun des ectoparasites, trouvé uniquement sur les femelles et les jeunes[89], mais chez toutes les populations et est parfois lui-même porteur d'épizoaires[90],[91]. Les grands mâles sont, quant à eux, la cible d'un autre cyamidé, Cyamus catodontis[89]. D'autres crustacés, les cirripèdes, sont de simples épizoaires du cachalot ; tel est le cas des anatifes et des pouces-pieds. Si l'animal ne sert que de substrat, la fixation de ces organismes reste gênante, surtout en cas de prolifération excessive, en particulier dans les eaux froides[88]. Parmi les vertébrés, le squalelet féroce (Isistius brasiliensis) peut découper de pleines bouchées dans la chair du cachalot[92].
Répartition et habitat
.jpg.webp)
Le cachalot compte parmi les espèces les plus cosmopolites. Il vit en une certaine abondance dans tous les océans et presque toutes les mers, dont la Méditerranée. Il préfère les eaux libres de plus de 1 000 m de profondeur[1]. On trouve plus volontiers l'animal dans les eaux équatoriales ou tropicales, les femelles et leurs jeunes ne dépassant notamment pas les 50e parallèles (Nord et Sud) pour rester dans des eaux chaudes, mais les mâles adultes remontent jusqu'aux mers polaires[10]. Les mâles peuvent descendre au sud jusque vers l'Antarctique : rares en Géorgie du Sud, ils se cantonnent aux eaux profondes, évitant les côtes[93]. Ils sont présents dans le passage de Drake au large du cap Horn et ont été observés dans de nombreuses baies de la Terre de Feu ouvertes à l'océan, le pourtour côtier de la péninsule Mitre, le canal de Beagle ainsi que le détroit de Magellan[94] ; ils occupent toutes les eaux jusqu'au 75e parallèle nord. Cependant les changements d'hémisphères sont peu fréquents, un mâle particulier restant toujours du même côté de l'équateur[23].
On le trouve en mer Méditerranée, mais pas en mer Noire[4] et sa présence dans la mer Rouge est incertaine[1]. Les entrées peu profondes à la fois en mer Noire et en mer Rouge pourraient expliquer son absence[95]. Les basses profondeurs de la mer Noire sont également anoxiques et contiennent de fortes concentrations de composés soufrés, tels que le sulfure d'hydrogène[96]. Les populations sont plus denses à proximité des plateaux continentaux et des canyons sous-marins[10]. Les cachalots se trouvent généralement dans les eaux profondes au large des côtes, mais on peut les voir près de la côte dans les zones où le plateau continental est bas et diminue rapidement à des profondeurs de 310 à 920 m[4]. Les zones côtières qui comprennent d'importantes populations de cachalots sont les Açores et l'île des Caraïbes de la Dominique[97].
Les cachalots suivent un calendrier de migration avec des motifs similaires à ceux des rorquals : les mâles se rapprochent chaque hiver de l'équateur afin de rejoindre les pods de femelles. Une fois la reproduction achevée, ils repartent vers les pôles où la nourriture se fait plus abondante[23].
Étymologie et dénomination

Le terme « cachalot » est d'origine ibérique. Toutefois, on retrouve dans les textes français l'occurrence de cachalut dès 1628, où cette appellation était employée à Saint-Jean-de-Luz pour décrire l'animal considéré comme « le m[â]le de la baleine ». Le terme actuel, trouvé à l'écrit en 1694, est emprunté au portugais cachalote ou cacholote au XVIIe siècle, désignant le même animal, mais dont l'origine n'est pas claire. Il semble provenir du portugais cachola, signifiant « grosse tête »[98]. Le terme est aussi attribué au gascon cachau ou de caichal, relevé à Carcassonne, au sens de « grandes dents »[99],[100]. Dans son dictionnaire étymologique, Joan Coromines propose que les termes ibériques soient issus du latin populaire cappula, pluriel de cappulum, le manche de l'épée[101]. Bien que seul le terme « cachalot » désigne originellement et généralement l'espèce Physeter macrocephalus, il peut également être utilisé pour désigner tous les membres de la super-famille des Physeteroidea, qu'ils soient vivants ou fossiles, et notamment les cachalots nain et pygmée.

Les anglophones l'appellent généralement sperm whale, apocope de spermaceti whale, le spermaceti étant une substance semi-liquide, cireuse, trouvée dans l'organe éponyme occupant un volume important dans la tête de l'animal et servant de ballast lors des plongées (voir la section « Spermaceti »). Spermaceti signifie en latin « sperme de baleine », la substance blanchâtre ayant été confondue initialement avec du liquide séminal. Un autre nom pour l'animal, en ancien français, était « physétère » parfois dérivé en « physale », simple francisation du nom scientifique de son genre, Physeter et provenant du grec ancien pour le mot « souffleur », construit à partir de φυσώ (physo) signifiant « souffler ». Ce terme, aujourd'hui complètement désuet, se retrouve, par exemple, sous la plume de François Rabelais sous la graphie de « Physetère » dans les chapitres 33 et 34 de son Quart Livre de 1552 où réapparaît Pantagruel[102]. La dénomination spécifique macrocephalus vient également du grec, construit à partir de μακρός (makrós) et de κεφαλή (képhalế) et signifiant littéralement « grosse tête » ; son alternative, catodon signifie « dents sur la mandibule », du grec κατά (katá) pour « en bas » et ὀδούς (odoús) pour « dent »[15].
Systématique
Taxinomie
Le grand cachalot est placé dans le genre Physeter, de la famille des Physeteridae, elle-même placée dans la super-famille des Physeteroidea, regroupant tous les cachalots[103]. Deux espèces actuelles proches, du genre Kogia — à savoir le cachalot nain (K. sima) et le cachalot pygmée (K. breviceps) — sont parfois aussi placées dans cette famille, ou bien dans leur propre famille des Kogiidae[104]. Si le monotypisme de la famille n'est pas fixé, l'unicité de l'espèce P. macrocephalus au sein de son genre est avérée. Cela n'a pas toujours été le cas, puisque Carl von Linné, descripteur de l'espèce en 1758 dans son ouvrage Systema Naturae décrit quatre espèces dans le genre[105] : P. catodon, P. macrocephalus, P. microps et P. tursio. Sur la base d'une étude de 1836 de Frédéric Cuvier suivie par tous les cétologistes, les quatre espèces seront ramenées à une seule, mais il subsistera de la description originale une ambiguïté pour l'appellation de l'espèce, P. macrocephalus et P. catodon, tous deux utilisés par Linné ayant été repris indifféremment. L'espèce est au début généralement connue sous le nom de P. catodon, jusqu'à ce que Husson et Holthuis proposent en 1974 pour nom correct P. macrocephalus[106], le deuxième nom décrit originellement dans le genre Physeter par Linné et en même temps que P. catodon, mais se fondant sur le fait que les deux noms étant des synonymes publiés simultanément, le « principe du premier réviseur » du CINZ devait s'appliquer, conduisant en l'occurrence au choix de P. macrocephalus, une vue répétée par Holthuis en 1987[107]. La plupart des auteurs ont suivi ce constat, bien que Schevill (en 1986 et 1987) ait fait valoir que P. macrocephalus avait été publié avec une description inexacte et que par conséquent, seul P. catodon pouvait être considéré comme valide, rendant le principe du « premier réviseur » inapplicable[108],[109]. Cependant aujourd'hui, la plupart des auteurs acceptent dorénavant macrocephalus comme nom valide, faisant de catodon un simple synonyme de second plan.
L'espèce connaît de nombreux synonymes, et compte même certaines sous-espèces décrites, même si elle est aujourd'hui considérée comme monotypique.
| Espèce | Sous-espèces | ||
|---|---|---|---|
|
| ||
Fossiles

Bien que les données fossiles soient pauvres[111], plusieurs genres éteints ont été affectés à la super-famille parfaitement monophylétique des Physeteroidea qui comprend le dernier ancêtre commun du cachalot moderne, du cachalot pygmée et du cachalot nain, et tous les descendants de cet ancêtre. Ferecetotherium, trouvé en Azerbaïdjan et datant de l'Oligocène (environ 28 à 23 millions d'années), est le fossile le plus primitif qui a été trouvé qui possède des caractéristiques spécifiques aux cachalots comme un rostre asymétrique[112]. La plupart des cachalots fossiles datent de la période du Miocène, il y a de 23 à 5 millions d'années de cela. Diaphorocetus, en provenance d'Argentine, qui a été daté du Miocène inférieur. Les fossiles du Miocène moyen comprennent Aulophyseter, Idiorophus et Orycterocetus, qui ont tous été trouvés sur la côte occidentale des États-Unis, Leviathan melvillei trouvé en 2010 plus au sud, au Pérou, et Scaldicetus qui fut trouvé en Europe et au Japon[112],[113]. Les fossiles de Orycterocetus ont également été trouvés dans l'océan Atlantique Nord et la mer Méditerranée, en plus de la côte occidentale des États-Unis[114]. Placoziphius, trouvé en Europe, et Acrophyseter au Pérou, sont datés de la fin du Miocène[115],[112].
Les fossiles de cachalots diffèrent du cachalot moderne notamment par le nombre de dents ainsi que par la forme de la face et de la mâchoire[112]. Par exemple, Scaldicetus a un rostre effilé[113]. Les genres de l'Oligocène et du début du Miocène moyen, à l'exception possible d'Aulophyseter, avaient des dents dans la mâchoire supérieure[112]. Acrophyseter, de la fin du Miocène, avait également des dents dans la mâchoire supérieure et celle inférieure ainsi qu'un rostre court avec une mâchoire inférieure (mandibule) courbée vers le haut[115]. Ces différences anatomiques suggèrent que les espèces fossiles ne sont pas nécessairement des chasseurs d'eaux profondes, comme le cachalot moderne, mais que certains genres mangeaient principalement du poisson[112]. Zygophyseter, vivant au milieu à la fin du Miocène, avait des dents dans les deux mâchoires et semble avoir été adapté pour se nourrir de proies de grande taille, un peu comme l'orque moderne[83].
| Arbre phylogénétique du grand cachalot[116], incluant les branches simplifiées des groupes éteints (†)[83] | |
|
Phylogénie
La théorie la plus largement admise affirme que les mysticètes (baleines à fanons) et odontocète (baleines à dents) dérivent des baleines primitives du début de l'Oligocène, et que la super-famille des physétéroidés, qui contient le cachalot, le cachalot nain et le cachalot pygmée, ont divergé des autres baleines à dents peu de temps après, il y a plus de 23 millions d'années[111],[112]. Effectuées entre 1993 et 1996, des analyses moléculaires phylogénétiques ont suggéré que les cachalots sont plus étroitement proches des baleines à fanons qu'ils ne le sont d'autres baleines à dents, ce qui aurait signifié que le sous-ordre des odontocètes n'était pas monophylétique, en d'autres termes qu'il ne constituait pas un groupe d'espèces comprenant une baleine à dents ancestrale et tous ses descendants[117],[116]. Cependant, les études ultérieures d'anatomie comparée et de phylogénie moléculaire utilisant un ensemble de caractères morphologiques et des marqueurs moléculaires plus nombreux ont contesté ces résultats pour des raisons techniques (enracinement des arbres et alignements utilisés) et conclu à la monophylie des odontocètes[116],[118],[119],[120].
Ces analyses confirment également qu'il y a eu une diversification rapide de la super-famille des physétéroidés durant le Miocène[83]. La famille des kogiidés (les cachalots nains et pygmées) s'est séparée de celle du grand cachalot il y a au moins 8 millions d'années[118].
Le cachalot et l'Homme
Les prémices de la chasse commerciale


Avant le début du XVIIIe siècle, la chasse était traditionnelle et majoritairement pratiquée par les autochtones indonésiens du village baleinier de Lamalera sur l'île de Lembata[121]. Elle avait pour but de tirer parti de la viande, de l'huile et du lard (« blubber ») des cachalots. Concernant la première chasse « occidentale », une chronique maritime rapporte que vers 1712, le baleinier du capitaine Christopher Hussey qui cherchait des baleines franches près des côtes, fut drossé vers le large. Il y croisa un pod de cachalots et tua l'un d'eux[122]. Le juge Paul Dudley, dans son Essay upon the Natural History of Whales de 1725 affirme qu'un certain Atkins, actif depuis dix ou douze ans dans le domaine, a été parmi les premiers à exploiter les cachalots au large de la Nouvelle-Angleterre aux environs de 1720[123].
Ces exemples marquent les prémices de la chasse commerciale, car durant les XVIIIe, XIXe et XXe siècles, le spermaceti et l'huile de cachalot sont alors très recherchés par les baleiniers qui se diversifient ou bien se spécialisent dans la capture du cétacé à dents. Ces produits animaux acquièrent à l'époque un large éventail d'applications comme dans la fabrication de bougies, de savon, de cosmétiques, d'huile moteur ; d'autres lubrifiants spéciaux pour les machines de la révolution industrielle, les huile pour lampe, les crayons ; d'imperméabilisant pour cuir ; pour la protection contre la rouille et dans de nombreux composés pharmaceutiques. L'ambre gris, substance cireuse, solide et inflammable a également été utilisée comme fixateur en parfumerie. Au vu des nombreuses applications pour ces matières à l'époque de la Révolution industrielle, la chasse devint indispensable par l'absence de substituts[124],[125],[126],[127]. Le nombre de baleiniers dédiés à la chasse au cachalot augmenta rapidement jusqu'à quasi industrialiser les méthodes de pêche et d'extraction de produits animaux.
Essor, déclin et renaissance

Seules quelques captures sont enregistrées pendant les premières décennies de la chasse au cachalot en pleine mer (de 1709 aux années 1730). Les chaloupes se concentrent plutôt aux Nantucket Shoals pour chasser la baleine franche ou autour du détroit de Davis région pour trouver la baleine boréale. Au début des années 1740 (avant 1743), avec l'avènement de bougies au spermaceti, les navires américains commencent à s'intéresser aux cachalots. La chasse américaine s'étend rapidement depuis la côte orientale des colonies américaines jusqu'au Gulf Stream, les Grands Bancs, l'Afrique de l'Ouest dès 1763, les Açores en 1765 et l'Atlantique Sud en 1770. De 1770 à 1775, les ports du Massachusetts, de New York, du Connecticut et de Rhode Island produisent 45 000 barils d'huile de cachalot par an, contre à 8 500 d'huile de baleine[128]. La même décennie les Britanniques commencent la chasse au cachalot en utilisant des navires et du personnel américains ; la décennie suivante les Français entrent dans ce commerce et font appel également aux connaissances américaines[129].

La chasse au cachalot prend de plus en plus d'importance à partir du XVIIIe siècle. Commençant avec de petites chaloupes transportant une ou deux baleinières, le champ d'action et la taille de la flotte augmentent au fil du temps, de plus grands navires tirant profit de cette ressource. À la fin du XVIIIe siècle et au début du XIXe siècle, les baleiniers chassant le cachalot naviguent dans le Pacifique, l'océan Indien, au Japon, la côte de l'Arabie, l'Australie et la Nouvelle-Zélande[129],[130]. La chasse consiste à harponner la bête et la laisser s'épuiser. Cette stratégie se révèle parfois dangereuse pour l'équipage, comme l'illustrent les naufrages de l'Essex et de l'Ann Alexander.
L'activité baleinière diminue des années 1880 jusqu'aux années 1940, notamment parce que le pétrole se substitue aux produits issus des grands mammifères marins. En ce sens, on peut dire que l'« or noir » a protégé les populations de cétacés d'une exploitation plus grande[131],[132]. Mais la chasse reprend de plus belle aux abords de la Seconde Guerre mondiale, notamment de la part de l'Allemagne nazie. Les moyens modernes se révèlent plus efficaces, les chasseurs employant des navires à vapeur et des harpons explosifs[133]. La pêche aux cétacés s'axe en priorité sur les grandes baleines à fanons, mais le cachalot devient plus recherché à mesure que les populations de mysticètes décroissent. Les industries des cosmétiques, du savon et de l'huile mécanique sont à cette époque les principaux acheteurs. L'huile des cétacés est par ailleurs indispensable pour la production de nitroglycérine[133]. Après que les populations diminuent de manière significative, la Commission baleinière internationale proclame la pleine protection de l'espèce en 1985. Cependant, la chasse continue sous sa forme traditionnelle aux Açores jusqu'en 1984[134] et au Japon dans le Nord de l'océan Pacifique jusqu'en 1988[132].
Populations et conservation
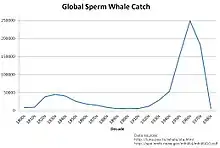
Il est estimé que la population mondiale de cachalots comptait aux environs de 1 100 000 individus avant la chasse commerciale. En 1880, ce chiffre avait diminué de près de 29 %[1]. Jusqu'en 1946, les effectifs semblent récupérer quelque peu avec la pression moindre de la chasse, mais après la Seconde Guerre mondiale, la population diminue encore davantage pour atteindre seulement 33 % de l'effectif initial, d'avant l'ère de la chasse[1]. Il a été estimé que durant le XIXe siècle entre 184 000 et 236 000 cachalots ont été tués par les différentes nations baleinières[135], tandis que la vague moderne de la chasse a pris au moins 770 000 individus à la mer, la plupart entre 1946 et 1980[Note 3]. Un impact périphérique a été constaté sur les populations de cachalots : les grands mâles ayant été chassés en priorité, voire surexploités, une diminution de la longueur moyenne a, au moins localement, été relevée[139].
Les populations restantes de cachalots sont assez grandes pour que le statut de conservation soit défini par l'UICN comme vulnérable (VU)[1]. Néanmoins, le repeuplement après les années de chasse est un processus lent, en particulier dans le Pacifique Sud, où le tribut fut lourd à payer pour les mâles en âge de reproduction[140]. Le nombre actuel de cachalots dans le monde entier est incertain, mais les scientifiques supposent qu'il peut y en avoir environ 360 000, chiffre des années 1990 dont on ne peut pas affirmer s'il a bougé depuis. Ce chiffre représente une réduction de 67 % vis-à-vis de la population d'avant le début de l'exploitation par l'homme. Les perspectives de conservation sont plus claires que pour beaucoup d'autres baleines, mais il n'y a pas de preuves que la population ait augmenté depuis l'interdiction de la chasse, ni qu'elle se soit réduite, sauf exceptions régionales[1].
L'espèce est protégée pratiquement partout dans le monde et la chasse commerciale a quasiment cessé. Il est cependant avéré que certains pays contournent le moratoire, comme le Japon qui prélève dix grands cachalots par an dans le Pacifique, et jusqu'en 2006 des dizaines de cachalots ont été chassés au large de l'Indonésie[133]. Les pêcheurs ne ciblent pas les espèces que le cachalot mange ; ainsi la pêche n'a pas d'impact sur ses ressources alimentaires. L'enchevêtrement dans les filets de pêche et les collisions avec les navires représentent les plus grandes menaces pour les populations de cachalots[10]. D'autres menaces actuelles comprennent l'ingestion des débris marins, la pollution sonore des océans et la pollution chimique[141]. L'impact éventuel de l'industrie touristique basée sur l'observation des cachalots en mer, a été étudié à Kaikoura (Nouvelle-Zélande). Il semble effectivement que cette activité modifie le comportement des animaux, mais dans des proportions si faibles que les conséquences biologiques n'en sont sans doute pas à redouter[142].
Utilisations alimentaires
Lorsqu'un cachalot vient à s'échouer sur le rivage, la viande de couleur rouge foncé mise à nu devient rapidement noirâtre à l'air libre, la rendant peu appétissante. Ainsi, les habitants des Açores, sur le site d'échouage du mammifère, ne prélevaient pas la viande et se contentaient d'extraire les dents pour leurs rites culturels[143]. Cependant le grand cachalot, comme les autres baleines, rentre dans le régime alimentaire de l'homme. Il y apparaît de manière occasionnelle, dans la plupart des cultures. En effet, sa grande taille fait du grand cachalot une manne alimentaire considérable, bien que seul le lard soit vraiment comestible. Cette viande n'a pas de valeur gastronomique particulière, elle est plutôt quelconque et servait donc surtout à l'alimentation animale. Les baleiniers américains débitaient les planches de lard en petits pavés et en faisaient des boulettes qu'ils plongeaient ensuite dans l'huile bouillante, dont ils se régalaient. Mais la majorité de ces pavés étaient desséchés à l'aide d'un cuiseur pour être ensuite broyés en farine animale pour le bétail[143].
Les baleines étant auparavant confondues avec les poissons, l'Islam autorise la consommation de cachalot. D'ailleurs, celle-ci est décrite dans la Sunna durant l'« expédition vers la côte », menée par Abu Ubayda ibn al-Djarrah accompagné de trois cents hommes[144]. Aujourd'hui, la chasse du grand cachalot étant interdite, sa viande n'est plus consommée, sauf au Japon où l'on trouve de la viande d'une grande variété de baleines dans les assiettes. Cette consommation s'inscrit dans une tradition remontant à avant le XVIIe siècle[145]. S'agissant du cachalot, les Japonais cuisinent le lard (honkawa 本皮) en le faisant cuire dans un bouillon appelé koro oden (コロおでん). De nombreuses autres parties sont toujours consommées, et même prisées, depuis la tête (le kabura-bone かぶら骨, cartilage du rostre) jusqu'à la queue (l'onomi 尾の身, la base de la queue), le rein (mamewata 豆腸) et même le pénis (takeri たけり)[133],[146].
Des études récentes suggèrent que la graisse contient naturellement des PCB, substances cancérogènes qui endommagent les systèmes nerveux, immunitaire et reproducteur de l'homme[147],[148]. La source des concentrations de PCB est inconnue. Les baleines à dents, comme le grand cachalot, sont généralement au sommet de la chaîne alimentaire et sont ainsi susceptibles d'emmagasiner de grandes quantités de polluants industriels par bioaccumulation. Toutefois, le cas du grand cachalot semble plus complexe, étant donné qu'il trouve sa nourriture à de grandes profondeurs.
Observation du cachalot
Les grands cachalots ne sont pas les cétacés les plus faciles à observer, notamment à cause de leurs longues apnées et leur capacité à parcourir de longues distances sous l'eau. Toutefois, en raison de leur aspect particulier et de leur grande taille, l'opportunité de les observer dans leur milieu naturel est de plus en plus convoitée. Les observateurs des cachalots utilisent souvent des hydrophones pour écouter les clics des baleines afin de les localiser avant qu'ils fassent surface. Parmi les endroits les plus connus pour observer des cachalots, on peut citer Kaikoura, sur l'île du Sud de Nouvelle-Zélande, où le plateau continental est si étroit que les baleines peuvent être observées depuis la rive ; Andenes et Tromsø en Norvège ; et enfin aux Açores où l'on peut en voir tout au long de l'année[149]. La Dominique est considérée comme la seule île des Caraïbes possédant un groupe résidant toute l'année, composé de femelles et de jeunes[150].
Depuis 2013, une équipe de plongeurs et plongeuses pratique une observation sous-marine régulière d'une population de grands cachalots au large de l'Île Maurice afin d'étudier leur structure sociale[151].
Ethnologie

Jusqu'à la fin du XVIIe siècle, la civilisation occidentale classait les cétacés parmi les poissons et le grand cachalot n'était pas véritablement différencié des autres baleines. Le milieu marin étant particulièrement redouté, les baleines faisaient partie du bestiaire effrayant. Pourtant, 400 ans av. J.-C., le philosophe grec Aristote classait déjà les baleines parmi les mammifères[15].

Les dents de cachalot sont des objets culturels importants dans tout le Pacifique. En Nouvelle-Zélande, les Maoris les appelaient « rei puta » et elles étaient rares, car les cachalots n'étaient pas chassés dans la société traditionnelle[152]. Les dents et les os provenaient alors de cachalots échoués. Aux Fidji, les dents sont connues sous le nom « tabua » où elles étaient traditionnellement données en cadeau ou bien pour l'expiation (appelée sevusevu). Elles étaient ainsi importantes dans les négociations entre les chefs rivaux[153]. Friedrich Ratzel dans The History of Mankind signale en 1896 que, dans les îles Fidji, les dents de cachalots étaient des objets d'ornements très précieux. On y taillait dedans des perles pour réaliser des colliers[154]. Aujourd'hui, le tabua reste un élément important dans la vie fidjienne. Les dents étaient initialement rares dans les îles Fidji et Tonga, mais avec l'arrivée des Européens, les dents ont inondé le marché et cette « monnaie » s'est effondrée. L'offre excédentaire a conduit à son tour au développement de l'art européen du scrimshaw[155]. On a également retrouvé des traces de ces dents datant de l'époque gauloise en Vendée[156] et du XIIe siècle av. J.-C. en Assyrie[157].

Références culturelles

L'histoire de Moby Dick (the White Whale) d'Herman Melville est fondée sur l'histoire authentique du cachalot ayant attaqué le baleinier Essex et peut-être sur un cachalot blanc du Pacifique connu pour sa férocité, un mâle baptisé Mocha Dick. Melville a associé le cachalot avec le Léviathan de la Bible. Cependant, alors que le drame de l'Essex est cité dans le roman comme dans la correspondance de l'auteur, Mocha Dick, lui, n'y apparaît jamais. Il peut donc s'agir d'une coïncidence, les cas d'albinisme n'étant pas rares chez ces animaux-là, non plus que les prénoms (Dick étant Richard) donnés par les chasseurs aux spécimens particulièrement combatifs, et dont fait état Melville dans un chapitre de son roman. La redoutable réputation perpétuée par Melville a été fondée sur la capacité des cachalots à se défendre farouchement contre les attaques des premiers baleiniers, allant même à les briser. En 1869 Jules Verne, dans Vingt Mille Lieues sous les mers, mentionne des cachalots (peut-être à tort) qui s'attaquent à d'autres baleines[158]. L'animal apparaît également sous des traits farouches d'un certain Monstro dans le film de Disney de 1940, Pinocchio. Il avale Geppetto avec son bateau, de façon analogue au récit de Jonas, prophète biblique avalé par une baleine. Bien que la présence de dents dans la mâchoire de cet immense cétacé ne laisse qu'une interprétation possible quant à son identité, la représentation reste approximative et l'animal possède certains grands traits des mysticètes[159]. En 2006, un long docu-fiction en images de synthèse lui est consacré, intitulé Deep ocean, au royaume des cachalots[160]. Les échouages ont aussi inspiré certains auteurs : dans la bande dessinée Le Bal du rat mort par exemple, un cachalot échoue à Ostende et une masse grouillante de rats sort de son ventre. Deux sous-marins de la United States Navy ont porté le nom de l'animal : le USS Cachalot (SS-33) (renommé USS K-2 (SS-33) en 1911) et le USS Cachalot (SS-170) de la « classe Cachalot ». Le cétacé est par ailleurs le symbole de la préfecture de Yamanashi au Japon et de l'État du Connecticut aux États-Unis.
Annexes
Articles connexes
- Physeteroidea, la super-famille comprenant l'ensemble des cachalots, actuels et éteints ;
- Physeteridae, la famille biologique
- Spermaceti
- Chasse au cachalot | Commission baleinière internationale
- Moby Dick
- Livyatan
- Liste des cétacés par population
- Liste d'espèces et de genres de cétacés éteints
- Histoire évolutive des cétacés
Bibliographie
- (en) Hadoram Shirihai et Brett Jarrett, Whales Dolphins and Other Marine Mammals of the World, Princeton, Princeton University Press, , 384 p. (ISBN 978-0-691-12756-9)
- (en) Hal Whitehead, Sperm Whales Social Evolution in the Ocean, University of Chicago Press, , 431 p. (ISBN 0-226-89518-1)
- (en) Hal Whitehead et Lindy Weilgart, « The Sperm Whale », cité dans Janet Mann, Richard C. Connor, Peter L. Tyack et Hal Whitehead, Cetacean Societies : field studies of dolphins and whales, University of Chicago Press, , 433 p. (ISBN 978-0-226-50341-7)
- (fr) Maurizio Würtz et Nadia Repetto (trad. Marie-Paule Duverne), Dauphins et Baleines, Gründ, , 167 p. (ISBN 2-7000-3421-X)
- (fr) Jean-Pierre Sylvestre, Baleines et cachalots, Delachaux et Niestlé, , 135 p. (ISBN 978-2603006887)
- David Chauvel et Alfred (auteur), Octave et le Cachalot, Delcourt Jeunesse, coll. « Jeunesse », , 31 p. (ISBN 978-2840559375)
- Stéphane Granzotto et Paul Watson (Préface), Cachalots, Nemesys, , 208 p. (ISBN 978-2955831700) :
- Ce livre retrace des dizaines d'heures de plongée, et des centaines d'heures d'observation de la vie sociale et du comportement singulier de ces géants des mers, animaux paisibles et étonnants.
Références taxinomiques
- (en) Référence Catalogue of Life : Physeter macrocephalus Linnaeus, 1758 (consulté le )
- (fr) Référence INPN : Physeter macrocephalus Linnaeus, 1758 (Syn. Physeter catodon) (consulté le )
- (fr+en) Référence ITIS : Physeter macrocephalus Linnaeus, 1758
- (en) Référence World Register of Marine Species : espèce Physeter macrocephalus Linnaeus, 1758
- (en) Référence Mammal Species of the World (3e éd., 2005) : Physeter catodon Linnaeus, 1758
- (en) Référence Paleobiology Database : Physeter catodon Linnaeus 1758
- (en) Référence Animal Diversity Web : Physeter catodon
Liens externes
- Ressources relatives au vivant :
- Convention de Bonn
- DORIS
- Nederlands Soortenregister
- NOAA Fisheries Species Directory
- Registre public des espèces en péril
- TAXREF (INPN)
- (en) Animal Diversity Web
- (en) ARKive
- (en) Catalogue of Life in Taiwan
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) European Nature Information System
- (en) Fossilworks
- (en) Global Biodiversity Information Facility
- (en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) NBN Atlas
- (nl) NDFF Verspreidingsatlas
- (en) New Zealand Organisms Register
- (en) SeaLifeBase
- (en) Species+
- (en) Système d'information taxonomique intégré
- (en) Union internationale pour la conservation de la nature
- (en) World Register of Marine Species
- (en) ZooBank
- Ressource relative à la santé :
- (en) Référence UICN : espèce Physeter macrocephalus Linnaeus, 1758 (consulté le )
- (en) Référence CITES : espèce Physeter macrocephalus Linnaeus, 1758 (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Physeter macrocephalus (sur le site du ministère français de l'Écologie) (consulté le )
- (fr) Référence DORIS : espèce Physeter catodon
- (en) Référence NCBI : Physeter catodon (taxons inclus)
- (en) Référence Fonds documentaire ARKive : Physeter macrocephalus
- (fr) « Cachalot », sur lesbaleines.net, Les Baleines.net (consulté le )
- (fr) « Vidéos de cachalots », sur cetace.info, L'info des Cétacés (consulté le )
Notes et références
Notes
- Une baleine de Cuvier a été rencontrée par 2 992 mètres de profondeur par une équipe en 2018, voir l'article consacré
- L'abondance, entre autres, de la myoglobine du cachalot lui a valu d'être la première protéine dont la structure tridimensionnelle a été déterminée par cristallographie aux rayons X, par les travaux de John Kendrew (aux côtés de Max Perutz).
- Plus de 680 000 saisies ont été officiellement déclarées[136], mais des études ont relevé que les rapports officiels de l'URSS avaient sous-estimé les captures d'au moins 89 000 individus[137]. De plus, il est avéré que d'autres pays tels le Japon, ont sous-estimé également les captures[138].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sperm whale » (voir la liste des auteurs).
- UICN, consulté le 21 octobre 2010
- Melissa Hogenboom, « The whales that speak in code to show their identity », sur www.bbc.com (consulté le )
- Frédéric Lewino et Gwendoline Dos Santos, « 20 novembre 1820. Le baleinier l'"Essex" est coulé par un cachalot. Les marins survivants s'entre-dévorent. », sur lepoint.fr, (consulté le )
- Shirihai et Jarrett 2006, p. 21–24
- (en) Hal Whitehead, « Sperm whale Physeter macrocephalus », cité dans William F. Perrin, Bernd G. Würsig et J.G.M. Thewissen, Encyclopedia of Marine Mammals, Academic Press, , 1414 p. (ISBN 0-12-551340-2, lire en ligne), p. 1165–1172
- (en) « Physeter macrocephalus, Sperm Whale », sur marinebio.org
- Shirihai et Jarrett 2006, p. 112–115
- « The Wreck of the Whaleship Essex », BBC (consulté le )
- (en) Mark Carwardine, On the Trail of the Whale, Thunder Bay Publishing Co, (ISBN 1-899074-00-7)
- (en) Randall R. Reeves, Brent S. Stewart, Philip J. Clapham et James A. Powell, Guide to Marine Mammals of the World, New York, Alfred A. Knopf, (ISBN 0-375-41141-0), p. 240–243
- (en) Animal Life Resource, « Sperm Whale (Physeter macrocephalus): Species Accounts », sur animals.jrank.org (consulté le )
- [PDF] (en) Hal Whitehead, Jonathan Gordon, Elizabeth A. Mathews et Kenny R. Richard, « Obtaining skin samples from living sperm whales », Marine mammal science, vol. 6, no 4, , p. 316-326 (DOI 10.1111/j.1748-7692.1990.tb00361.x, lire en ligne)
- Coghlan A (2017), Sperm whale’s skin comes off during mass ‘scratchathon’ (“Skinny stripping”), Aperture 15 February 2017
- (en) American Cetacean Society, « American Cetacean Society Fact Sheet - SPERM WHALE - Physeter macrocephalus » (consulté le )
- DORIS, consulté le 28 octobre 2010
- (en) « Sperm Whale Facts », sur whale-images.com (consulté le )
- Whitehead 2003, p. 4
- Phil Manfield, « Whale sighting at 3000 feet », (consulté le )
- (en) William Alfred Watkins, Mary Ann Daher, Kurt M. Fristrup, Terrance J. Howald et Giuseppe Notarbartolo di Sciara, « Sperm whales tagged with transponders and tracked underwater by sonar », Marine Mammal Science, vol. 9, , p. 55–67
- (fr) Pierre Darmangeat, Les baleines, Éditions Artemis, , 61 p. (ISBN 9782844165640, lire en ligne), p. 37
- [PDF] (en) Stephanie L. Watwood, Patrick J.O. Miller, Mark Johnson, Peter T. Madsen et Peter L. Tyack, « Deep-diving foraging behaviour of sperm whales (Physeter macrocephalus) », Journal of Animal Ecology, no 75, , p. 814–825 (DOI 10.1111/j.1365-2656.2006.01101.x, lire en ligne)
- (en) The Southwestern Company, The Volume Library, (ISBN 0-87197-208-5), p. 65
- Würtz et Repetto 1999, p. 122–125, « Le cachalot: Le seigneur des océans »
- (en) G.L. Kooyman et P.J. Ponganis, « The Physiological Basis of Diving to Depth: Birds and Mammals », Annual Review of Physiology, vol. 60, no 1, , p. 19–32 (DOI 10.1146/annurev.physiol.60.1.19)
- (en) Peter L. Tyack, M. Johnson, N. Aguilar Soto, A. Sturlese et P. Madsen, « Extreme diving of beaked whales », Journal of Experimental Biology, vol. 209, , p. 4238–4253 (PMID 17050839, DOI 10.1242/jeb.02505, lire en ligne)
- Würtz et Repetto 1999, p. 52–53, « Un record d'apnée »
- (en) S.R. Noren et T.M. Williams, « Body size and skeletal muscle myoglobin of cetaceans: adaptations for maximizing dive duration », Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology, vol. 126, no 2, , p. 181–191 (DOI 10.1016/S1095-6433(00)00182-3)
- (fr) Frédéric Lemaître, L'apnée: De la théorie à la pratique, Publication Univ Rouen Havre, , 428 p. (ISBN 9782877754248, lire en ligne), p. 144–146, 158
- (en) C. Marshall, « Morphology, Functional; Diving Adaptations of the Cardiovascular System », cité dans William F. Perrin, Bernd G. Würsig et J.G.M. Thewissen, Encyclopedia of Marine Mammals, Academic Press, (ISBN 0-12-551340-2), p. 770
- « Aquarium of the Pacific - Sperm Whale », Aquarium of the Pacific
- (en) Mark Shwartz, « Scientists conduct first simultaneous tagging study of deep-diving predator, prey », Stanford Report,
- (en) Malcolm R. Clarke, « Structure and Proportions of the Spermaceti Organ in the Sperm Whale », Journal of the Marine Biological Association of the United Kingdom, vol. 58, , p. 1–17 (lire en ligne)
- (en) M.J. Moore et G.A. Early, « Cumulative sperm whale bone damage and the bends », Science, vol. 306, no 5705, , p. 2215 (PMID 15618509, DOI 10.1126/science.1105452)
- Whitehead 2003, p. 156–161, « Foraging »
- (en) « Sperm Whales (Physeter macrocephalus) », U.S. Department of Commerce NOAA Office of Protected Resources
- [PDF] (en) L. Marino, « Cetacean Brain Evolution Multiplication Generates Complexity », International Journal of Comparative Psychology, vol. 17, , p. 3–4 (lire en ligne)
- (en) U. Dicke et G. Roth, « Intelligence Evolved », Scientific American Mind, , p. 71–77
- http://www.st-andrews.ac.uk/news/archive/2008/title,19526,en.php
- (en) Christina Lockyer, The Encyclopedia of Mammals, New York, D. Macdonald, Facts on File, , 895 p. (ISBN 0-87196-871-1), p. 204–209
- (en) Ted W. Cranford, « In Search of Impulse Sound Sources in Odontocetes », cité dans W.W.L. Au, A.N. Popper et R.R. Fay, Hearing by Whales and Dolphins (Springer Handbook of Auditory Research series), New York, Springer-Verlag, (ISBN 0387949062)
- (en) W. Whitlow, « Echolocation », cité dans William F. Perrin, Bernd G. Würsig et J.G.M. Thewissen, Encyclopedia of Marine Mammals, Academic Press, (ISBN 0-12-551340-2), p. 359–367
- Hervé Le Guyader, « Le bizarre sonar du cachalot », Pour la Science, no 485, , p. 92
- (fr) (en) Reginald H. Garrett et Charles M. Grisham (trad. B. Lubochinsky), Biochimie, Université De Boeck, , 1254 p. (ISBN 978-2-7-445-0020-6, lire en ligne), « Les lipides », p. 251
- (en) Ted W. Cranford, « The Sperm Whale's Nose: Sexual Selection on a Grand Scale? », Marine Mammal Science, vol. 15, no 4, , p. 1133–1157 (DOI 10.1111/j.1748-7692.1999.tb00882.x)
- (fr) Tous les animaux du monde, vol. 3, Librairie Larousse, , p. 61–18
- Whitehead 2003, p. 8–9, « The Peculiar Anatomy of the Sperm Whale: The Spermaceti Organ »
- [PDF] (en) Malcolm R. Clarke, « Physical Properties of Spermaceti Oil in the Sperm Whale », Journal of the Marine Biological Association of the United Kingdom, vol. 58, , p. 19–26 (lire en ligne)
- (en) Malcolm R. Clarke, « Function of the Spermaceti Organ of the Sperm Whale », Nature, vol. 228, , p. 873–874 (DOI 10.1038/228873a0)
- [PDF] (en) « Spermaceti as battering ram? »
- (en) D. Carrier, S. Deban et J. Otterstrom, « The face that sank the Essex: potential function of the spermaceti organ in aggression », The Journal of Experimental Biology, vol. 205, , p. 1755–1763 (lire en ligne)
- Un pod de cachalots dans l’océan indien.
- Würtz et Repetto 1999, p. 68–69, « La vie en société »
- (fr) Félix Rodriguez de la Fuente, La Faune, vol. 10, Paris, Grange batelière, , p. 300
- (en) R.L. Pitman, L.T. Ballance, S.I. Mesnick et S.J. Chivers, « Killer whale predation on sperm whales: Observations and implications », Marine Mammal Science, vol. 17, no 3, , p. 494–507 (lire en ligne)
- Whitehead et Weilgart 2000, p. 165
- (en) Ross Piper, Extraordinary Animals: An Encyclopedia of Curious and Unusual Animals, Greenwood Press, , 298 p. (ISBN 978-0313339226), p. 268–269
- (en) James A. Estes, Whales, Whaling, and Ocean Ecosystems, University of California Press, , 402 p. (ISBN 0520248848, lire en ligne), p. 179
- Codas, clics et clangs : le langage morse des cachalots.
- (en) Luke E. Rendell et Hal Whitehead, « Vocal clans in sperm whales (Physeter macrocephalus) », Proceedings of the Royal Society of London, Biological Sciences, vol. 270, 2002-2003 (DOI 10.1098/rspb.2002.2239)
- Whitehead et Weilgart 2000, p. 169
- Whitehead 2003, p. 271–285, « Mating Systems »
- (fr) Pierre Auguste Joseph Drapiez, Dictionnaire classique des sciences naturelles : présentant la définition, l'analyse et l'histoire de tous les êtres qui composent les trois règnes, leur application générale aux arts, à l'agriculture, à la médecine, à l'économie domestique, etc., t. 2, Bruxelles, , 570 p. (lire en ligne), p. 14–15
- Würtz et Repetto 1999, p. 160–161
- (en) Thomas Lyrholm, Olof Leimar, Bo Johanneson et Ulf Gyllensten, « Sex-biased dispersal in sperm whales: contrasting mitochondrial and nuclear genetic structure of global populations », Proceedings of the Royal Society B, Royal Society, vol. 266, no 1417, , p. 347-354 (ISSN 0962-8452 et 1471-2954, PMID 10097396, PMCID 1689695, DOI 10.1098/RSPB.1999.0644)
- [PDF] (en) Karen Evans et Mark A. Hindell, « The diet of sperm whales (Physeter macrocephalus) in southern Australian waters », ICES Journal of Marine Science, vol. 61, , p. 1313e1329 (DOI 10.1016/j.icesjms.2004.07.026, lire en ligne)
- (en) Malcolm R. Clarke, Neil MacLeod et O. Paliza, « Cephalopod remains from the stomachs of Sperm whales caught off Peru and Chile », Journal of Zoology, vol. 180, no 4, , p. 477–493 (DOI 10.1111/j.1469-7998.1976.tb04693.x)
- [PDF] (en) Malcolm R. Clarke, Neil MacLeod, H.P. Castello et M.C. Pinedo, « Cephalopod remains from the stomach of a sperm whale stranded at Rio Grande do Sul in Brazil », Marine Biology, vol. 59, no 4, , p. 235–239 (DOI 10.1007/BF00404746, lire en ligne)
- (en) Malcolm R. Clarke, H.R. Martins et P. Pascoe, « The Diet of Sperm Whales (Physeter macrocephalus Linnaeus 1758) off the Azores », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 339, no 1287, , p. 67–82 (lire en ligne)
- [PDF] (en) Malcolm R. Clarke et Neil MacLeod, « Cephalopod remains from sperm whales caught off western Canada », Marine Biology, vol. 59, no 4, , p. 241–246 (DOI 10.1007/BF00404747, lire en ligne)
- (en) M.B. Santos, G.J. Pierce, M. García Hartmann, C. Smeenk, M.J. Addink, T. Kuiken, R.J. Reid, I.A.P. Patterson, C. Lordan, E. Rogan et E. Mente, « Additional notes on stomach contents of sperm whales Physeter macrocephalus stranded in the north-east Atlantic », Journal of the Marine Biological Association of the United Kingdom, Cambridge, Cambridge University Press, vol. 82, no 3, , p. 501-507 (ISSN 0025-3154 et 1469-7769, OCLC 1756690, DOI 10.1017/S0025315402005787)
- (en) A.R. Martin et Malcolm R. Clarke, « The Diet of Sperm Whales (Physeter Macrocephalus) Captured Between Iceland and Greenland », Journal of the Marine Biological Association of the United Kingdom, vol. 66, , p. 779–790 (DOI 10.1017/S0025315400048426)
- Whitehead 2003, p. 43–55, « The Diet of a Sperm Whale: The Walnut, the Pea and the Half-Pound Steak »
- (en) R.A. Scott, « Animal facts: Megamouth shark », sur helium.com (consulté le )
- (en) Pietro Pecchioni et Carla Benoldi, « Sperm Whales Spotted Attacking Megamouth Shark », Florida Museum of Natural History Ichthyology Department (consulté le )
- [PDF] (en) Leonard J.V. Compagno, Sharks of the World, vol. 2 : Bullhead, mackerel and carpet sharks, FAO Species Catalogue for Fishery Purposes, (lire en ligne), p. 74–78
- (en) Sean C. Smith et Hal Whitehead, « The Diet of Galapagos sperm whales Physeter macrocephalus as indicated by fecal sample analysis », Marine Mammal Science, Wiley, vol. 16, no 2, , p. 315-325 (ISSN 0824-0469 et 1748-7692, OCLC 637552943, DOI 10.1111/J.1748-7692.2000.TB00927.X)
- (en) D. Gaskin et M. Cawthorn, « Diet and feeding habits of the sperm whale (Physeter macrocephalus L.) in the Cook Strait region of New Zealand », New Zealand Journal of Marine and Freshwater Research, vol. 2, , p. 156–179
- (en) K.H. Dannenfeldt, « Ambergris: The Search for Its Origin », Isis, vol. 73, no 3, , p. 382–397 (DOI 10.1086/353040)
- (fr) Une société de naturalistes et d'agriculteurs, Nouveau dictionnaire d'histoire naturelle, vol. 1 : ABA – ANI, Paris, Déterville, , 552 p. (lire en ligne), p. 412–417
- (en) Richard Ellis, Monsters of the Sea, The Lyons Press, (ISBN 1592289673), p. 245
- Whitehead 2003, p. 79, « Vertical Movements: The Sperm Whale's Dive »
- (en) Sid Perkins, « Sperm Whales Use Teamwork to Hunt Prey », Science News, (consulté le )
- (en) Giovanni Bianucci et Walter Landini, « Killer sperm whale: a new basal physeteroid (Mammalia, Cetacea) from the Late Miocene of Italy », Zoological Journal of the Linnean Society, Wiley-Blackwell, vol. 148, no 1, , p. 103-131 (ISSN 1096-3642 et 0024-4082, OCLC 01799617, DOI 10.1111/J.1096-3642.2006.00228.X)
- (en) Bertel Møhl, Magnus Wahlberg, Peter T. Madsen, Anders Heerfordt et Anders Lund, « The monopulsed nature of sperm whale clicks », The Journal of the Acoustical Society of America, vol. 114, no 2, , p. 1143–1153 (DOI 10.1121/1.1586258)
- (en) K. Benoit-Bird, W. Au et R. Kastelein, « Testing the odontocete acoustic prey debilitation hypothesis: No stunning results », The Journal of the Acoustical Society of America, vol. 120, no 2, , p. 1118–1123 (DOI 10.1121/1.2211508)
- (en) « Sneaky Cetaceans », Arctic Science Journeys (consulté le )
- (en) Trish J. Lavery, Ben Roudnew, Peter Gill, Justin Seymour, Laurent Seuront, Genevieve Johnson, James G. Mitchell et Victor Smetacek, « Iron defecation by sperm whales stimulates carbon export in the Southern Ocean », Proceedings of the Royal Society B, Royal Society, vol. 277, no 1699, , p. 3527-31 (ISSN 0962-8452 et 1471-2954, PMID 20554546, PMCID 2982231, DOI 10.1098/RSPB.2010.0863)
- Würtz et Repetto 1999, p. 92–95, « Les parasites »
- (en) Janet Mann, Richard C. Connor, Peter L. Tyack et Hal Whitehead, Cetacean societies : field studies of dolphins and whales, University of Chicago Press, , 433 p. (ISBN 978-0-226-50341-7, lire en ligne), p. 20
- (en) Animal Life Resource, « Sperm Whale Lice (Neocyamus physeteris): Species Accounts », sur animals.jrank.org (consulté le )
- (fr) Guy Oliver et Jean-Paul Trilles, « Crustacés parasites et épizoïtes du Cachalot, Physeter catodon Linnaeus, 1758 (Cetacea, Odontoceti), dans le golfe du Lion (Méditerranée occidentale) », Parasite, vol. 7, no 4, , p. 311–321 (PMID 11147040)
- (en) R.A. Martin, « Deep Sea: Cookiecutter Shark », ReefQuest Centre for Shark Research (consulté le )
- (en) Sally Poncet et Kim Crosbie, South Georgia, Wild Guides Ldt, , 180 p. (ISBN 1-903657-08-3), p. 167
- (en) Elio Massoia et Juan Carlos Chebez, Mamiferos Fueguino, L.O.L.A. (Literature of Latin America), , 261 p. (ISBN 950-9725-14-5), p. 144
- Whitehead 2003, p. 33, « Oceanographic Habitat of the Sperm Whale »
- (en) J.W. Murray, H.W. Jannasch, S. Honjo, R.F. Anderson, W.S. Reeburgh, Z. Top, G.E. Friederich et L.A. Codispoti, « Unexpected changes in the oxic/anoxic interface in the Black Sea », Nature, vol. 338, , p. 411–413 (DOI 10.1038/338411a0)
- Whitehead 2003, p. 23–24, « Sperm Whales and Humans »
- Définitions lexicographiques et étymologiques de « cachalot » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- [PDF] (en) M. Fernández-Casado, « El Cachalote (Physester macrocephalus) », Galemys, vol. 12, no 2, (lire en ligne)
- (en) Paul Haupt, « Jonah's whale », Proceedings, American Philosophical Society, Philadelphie, American Philosophical Society, vol. 46, , p. 151–164 (ISBN 9781422373453, lire en ligne)
- (es) Joan Coromines, Breve diccionario etimológico de la lengua castellana, Madrid, Gredos, , 628 p. (ISBN 84-249-1 332-9)
- (fr) Le Quart Livre (lire en ligne)
- (en) Olivier Lambert, Giovanni Bianucci et Christian de Muizon, « A new stem-sperm whale (Cetacea, Odontoceti, Physeteroidea) from the Latest Miocene of Peru », Comptes Rendus Palevol, vol. 7, no 6, , p. 361–369 (DOI 10.1016/j.crpv.2008.06.002)
- (en) James G. Mead et Robert L. Brownell Jr., « Order Cetacea », cité dans Don E. Wilson et DeeAnn M. Reeder, Mammal Species of the World: A Taxonomic and Geographic Reference, Baltimore, Johns Hopkins University Press, , 2142 p. (ISBN 978-0-8018-8221-0, lire en ligne), p. 723–743
- [PDF] (la) Carl Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, t. I, Holmiae (Laurentii Salvii), , 10e éd., 824 p. (lire en ligne), p. 76–77 :
« Dentes in maxilla inferiore.
Fiſtula in capite ſ. fronte. » - (en) A.M. Husson et L.B. Holthuis, « Physeter macrocephalus Linnaeus, 1758, the valid name for the sperm whale », Zoologische Mededelingen, vol. 48, , p. 205–217 (lire en ligne)
- (en) L.B. Holthuis, « The scientific name of the sperm whale », Marine Mammal Science, vol. 3, no 1, , p. 87–89
- (en) W.E. Schevill, « The International Code of Zoological Nomenclature and a paradigm: the name Physeter catodon Linnaeus 1758 », Marine Mammal Science, vol. 2, no 2, , p. 153–157
- (en) W.E. Schevill, « Reply to L.B. Holthuis "The scientific name of the sperm whale" », Marine Mammal Science, vol. 3, no 1, , p. 89–90
- WoRMS, consulté le 15 septembre 2010
- [PDF] (en) R.E. Fordyce et L.G. Barnes, « The Evolutionary History of Whales and Dolphins », Annual Review of Earth and Planetary Sciences, vol. 22, , p. 419–455 (DOI 10.1146/annurev.ea.22.050194.002223, lire en ligne)
- (en) Guram Andreevich Mchedlidze, « Sperm Whales, Evolution », cité dans William F. Perrin, Bernd G. Würsig et J.G.M. Thewissen, Encyclopedia of Marine Mammals, Burlington, Academic Press, , 2e éd. (ISBN 978-0-12-373553-9, lire en ligne), p. 1097–1098
- (en) K. Hirota et L.G. Barnes, « A new species of Middle Miocene sperm whale of the genus Scaldicetus (Cetacea; Physeteridae) from Shiga-mura, Japan », Island Arc, vol. 3, no 4, , p. 453–472 (DOI 10.1111/j.1440-1738.1994.tb00125.x)
- (en) Giovanni Bianucci, Walter Landini et Angelo Varola, « First discovery of the Miocene northern Atlantic sperm whale Orycterocetus in the Mediterranean », Geobios, vol. 37, no 5, , p. 569–573 (DOI 10.1016/j.geobios.2003.05.004)
- (en) Oliver Lambert, Giovanni Bianucci et Christian de Muizon, « A new stem-sperm whale (Cetacea, Odontoceti, Physeteroidea) from the Latest Miocene of Peru », Comptes Rendus Palevol, vol. 7, no 6, , p. 361–369 (DOI 10.1016/j.crpv.2008.06.002)
- (en) M. Nikaido, F. Matsuno, H. Hamilton, R. Brownwell, Y. Cao, W. Ding, Z. Zuoyan, A. Shedlock, R.E. Fordyce, M. Hasegawa et N. Okada, « Retroposon analysis of major cetacean lineages: The monophyly of toothed whales and the paraphyly of river dolphins », Proceedings of the National Academy of Sciences of the United States of America, vol. 98, no 13, , p. 7384–7389 (DOI 10.1073/pnas.121139198, lire en ligne)
- (en) Michel C. Milinkovitch, Guillermo Orti et Axel Meyer, « Revised phylogeny of whales suggested by mitochondrial ribosomal DNA sequences », Nature, vol. 361, no 6410, , p. 346–348 (DOI 10.1038/361346a0)
- Whitehead 2003, p. 2–3, « Evolutionary History of the Sperm Whale »
- (en) J. Heyning, « Sperm Whale Phylogeny Revisited: Analysis of the Morphological Evidence », Marine Mammal Science, vol. 13, no 4, , p. 596–613 (DOI 10.1111/j.1748-7692.1997.tb00086.x)
- (en) Michael R. McGowen, Michelle Spaulding et John Gatesy, « Divergence date estimation and a comprehensive molecular tree of extant cetaceans », Molecular Phylogenetics and Evolution, vol. 53, no 3, , p. 891–906 (DOI 10.1016/j.ympev.2009.08.018)
- Whitehead 2003, p. 14, « Sperm Whales and Humans »
- (en) B. Simons, « Christopher Hussey Blown Out (Up) to Sea », Nantucket Historical Association
- (en) P. Dudley, « An Essay upon the Natural History of Whales, with a Particular Account of the Ambergris Found in the Sperma Ceti Whale », Philosophical Transactions of the Royal Society B: Biological Sciences, The Royal Society, vol. 33, , p. 267 (lire en ligne)
- (en) D. Wilson, The Smithsonian Book of North American Mammals, (ISBN 0-7748-0762-8), p. 300
- (en) The Southampton Oceanography Centre & A. Charlotte de Fontaubert, The status of natural resources on the high seas, UICN, (lire en ligne), p. 63
- (en) A. Jamieson, A Dictionary of Mechanical Science, Arts, Manufactures, and Miscellaneous Knowledge, H. Fisher, Son & Co., , p. 566
- (en) « Aquarium of the Pacific – Sperm Whale », sur aquariumofpacific.org
- (en) A. Starbuck, History of the American Whale Fishery from its Earliest Inception to the Year 1876, (lire en ligne)
- [PDF] (en) J. Bockstoce, « From Davis Strait to Bering Strait: The Arrival of the Commercial Whaling Fleet in North America's West Arctic », Arctic, vol. 37, no 4, , p. 528–532 (lire en ligne)
- (en) E.A. Stackpole, Whales & Destiny: The Rivalry between America, France, and Britain for Control of the Southern Whale Fishery, 1785-1825, The University of Massachusetts Press, (ISBN 0870231049)
- (en) J. Estes, Whales, Whaling, and Ocean Ecosystems, University of California Press, (ISBN 0520248848), p. 329
- Whitehead 2003, p. 13–21, « Sperm Whales and Humans »
- [PDF] (fr) Claude Paquet, « Les derniers chasseurs de cachalots en Atlantique Nord », sur www.lulu.com, (consulté le )
- (pt) Rui Prieto et Frederico Cardigos, « Os Cachalotes », Universidade dos Açores (Departamento de oceanografía e pescas)
- (en) L. Davis, R. Gallman et K. Gleiter, In Pursuit of Leviathan: Technology, Institutions, Productivity, and Profits in American Whaling, 1816-1906 (National Bureau of Economic Research Series on Long-Term Factors in Economic Dev), University of Chicago Press, (ISBN 0226137899), p. 135
- (en) « Whaling Statistics »
- [PDF] (en) U.S. Pacific Marine Mammal Stock Assessments, « Sperm Whale (Physeter macrocephalus): California/Oregon/Washington Stock » (consulté le )
- [PDF] (en) « The RMS - A Question of Confidence: Manipulations and Falsifications in Whaling »
- (fr) Denise Viale, « Écologie des cétacés de la Méditerranée occidentale », cité dans (en) Mammals in the Seas, vol. 3 : General papers and large cetaceans, FAO, 287–298 p. (ISBN 92-5-100513-3, lire en ligne)
- Whitehead 2003, p. 360–362, « Ghosts of Whaling Past »
- Whitehead 2003, p. 362–368, « New Threats to Sperm Whales »
- (en) C. Richter, S. Dawson et E. Slooten, « Impacts of commercial whale watching on male sperm whales at Kaikoura, New Zealand », Marine Mammal Science, vol. 22, no 1, , p. 46–63 (DOI 10.1111/j.1748-7692.2006.00005.x)
- Michel Barré, Les dernières chasses au cachalot: Açores, Le gerfaut, (lire en ligne), « Peler, découper, fondre »
- « La viande de requin est-elle Halal ? », Aslamna (consulté le )
- [PDF] (en) Nancy Shoemaker, « Whale Meat in American History », Environmental History, vol. 10, , p. 269-294 (lire en ligne)
- (fr) isanatori, « La chasse à la baleine au Japon : Gastronomie baleinière », (consulté le )
- (en) « Chemical Compounds Found In Whale Blubber Are From Natural Sources, Not Industrial Contamination » (consulté le )
- (en) « Japan warned on 'contaminated' blubber », BBC News, (consulté le )
- (en) « Whale and dolphin watching in the Azores », Wildlife Extra (consulté le )
- (en) « Whale Watching Island | Dominica », sur dominica.dm (consulté le )
- « Le club de la Terre au Carré : le gang des cachalots, le noyau de la Terre, les plantes urticantes ! », sur www.franceinter.fr (consulté le )
- (en) « Museum of New Zealand Te Papa Tongarewa Collections Online Search - Rei puta » (consulté le )
- (en) A. Arno, « Cobo and tabua in Fiji: Two forms of cultural currency in an economy of sentiment », American Ethnologist, vol. 32, no 1, , p. 46–62 (DOI 10.1525/ae.2005.32.1.46, lire en ligne)
- (en) Friedrich Ratzel, « Dress and Weapons of the Melanesians: Ornament », The History of Mankind (consulté le )
- (en) Rochelle Constantine, « Folklore and Legends », cité dans William F. Perrin, Bernd G. Würsig et J.G.M. Thewissen, Encyclopedia of Marine Mammals, Academic Press, , 1414 p. (ISBN 0-12-551340-2, lire en ligne), p. 448–449
- (fr) Marcel Baudouin, « Découverte de dents de cachalot dans un dolmen de l'Ile d'Yeu (Vendée) », Bulletin de la Société préhistorique française, vol. 4, no 2, , p. 120–122 (DOI 10.3406/bspf.1907.11525, lire en ligne, consulté le )
- (fr) François Lenormant, « Sur l'existence de l'éléphant dans la Mésopotamie au XIIe siècle avant l'ère chrétienne », Comptes-rendus des séances de l'Académie des Inscriptions et Belles-Lettres, 17e année, no 1, , p. 178–183 (DOI 10.3406/crai.1873.68030, lire en ligne, consulté le )
- Jules Verne, Vingt Mille Lieues sous les mers, t. 2, Hetzel, (lire en ligne), chap. XII (« Cachalots et baleines »)
- (en) Robin Allan, Walt Disney and Europe: European Influence on the animated feature films of Walt Disney, Londres, John Libbey & Co, , 368 p. (ISBN 1-86462-040-4), p. 87
- (fr) « Deep ocean, au royaume des cachalots », France 4 (consulté le )
- Portail des cétacés
- Portail de la biologie marine
- Portail des abysses
- Portail de la conservation de la nature
- Portail des records
- Portail des mammifères

.jpg.webp)