Hadronthérapie
L'hadronthérapie est une méthode de radiothérapie pour le traitement du cancer. Elle permet de soigner des cancers radiorésistants, inopérables et au stade d’évolution locorégionale. La radiothérapie conventionnelle utilise essentiellement des rayons X alors que l'hadronthérapie bénéficie des avantages d’un faisceau de particules : les hadrons, notamment des protons (protonthérapie) et des ions carbone (carbonethérapie). Le but de cette technique innovante est d’améliorer l’irradiation des cellules tumorales tout en épargnant les tissus sains et les organes.
Histoire
La découverte des rayons X, qui valut le premier prix Nobel de physique à l'allemand Wilhelm Röntgen en 1895, a ouvert la voie à la physique médicale moderne en apportant les techniques d'imagerie. Un an plus tard, le physicien français Henri Becquerel met en évidence l'existence des rayonnements gamma. À l'époque, les effets de ces rayonnements sur la santé sont très mal connus, mais les applications pour le traitement du cancer sont pressentis par un médecin français, Victor Despeignes, qui traita pour la première fois en 1896 un patient atteint d'un cancer de l'estomac par rayons X[1]. La radiothérapie dite conventionnelle est née.
Par la suite, elle se développa grâce aux travaux de Marie Curie qui découvrit deux sources radioactives intenses, le radium et le polonium. Ces sources permettent d'obtenir des rayonnements X et gamma plus intenses permettant de créer des techniques de radiothérapie plus performante. C'est également par son initiative et de celle du professeur Émile Roux que l'Institut du radium vit le jour en 1914 en regroupant le laboratoire de physique et de chimie, dirigé par Marie Curie, et le laboratoire Pasteur, spécialisé en radiothérapie et dirigé par Claudius Regaud, médecin considéré comme un des premiers radiothérapeutes.
Parallèlement, le physicien anglais William Henry Bragg mit en évidence en 1903 une courbe représentant l'évolution de la perte d'énergie des particules alpha au cours de leur trajet dans la matière. Cette courbe est aujourd'hui connue sous la dénomination de pic de Bragg. Elle est très utilisée en hadronthérapie notamment pour les simulations dosimétriques pré-thérapeutiques afin d'optimiser la qualité des traitements.
C'est avec l'émergence des premiers accélérateurs de particules dans les années 1920 qu'apparaît la possibilité de traiter des cellules cancéreuses grâce à des électrons mais également grâce à des particules plus lourdes telles que les protons ou les ions plus lourds. C'est en 1946 que Robert R. Wilson fut le premier à proposer l'usage de faisceaux de protons pour le traitement du cancer[2] et c'est ainsi qu'en 1954, sous l'impulsion du physicien Ernest O. Lawrence, prix Nobel de physique 1939, et de son frère le médecin John H. Lawrence que le cyclotron du laboratoire de Berkeley fut utilisé pour traiter le premier patient par protonthérapie. L'idée d'utiliser des ions plus lourds, aussi appelés hadrons, naît rapidement dans l'esprit des physiciens, et, en 1957, le laboratoire de Berkeley utilise des faisceaux d'ions légers (hélium, néon, etc) pour traiter des patients puis des faisceaux d'ions carbone dès 1975. Toutefois, ces pionniers de l'hadronthérapie ne seront réellement suivis par une recherche plus profonde que vingt années plus tard.
Avant les années 2000, une vingtaine de centres ouvrent leurs portes à la protonthérapie et seulement trois expérimentent le traitement par faisceaux d'ions. Ce n'est qu'en 1994 que le premier centre entièrement conçu pour le traitement par ions carbone est construit à Chiba au Japon. HIMAC (Heavy Ion Medical Accelerator in Chiba) est encore en fonctionnement et a accueilli plus de 7 000 patients depuis son ouverture.
Depuis les années 2000, plus de 30 centres de protonthérapie ont ouvert dans le monde entier et traitent régulièrement des personnes. L'émergence de l'hadronthérapie par ions carbone s'est faite plus timide du fait de la complexité technologique. En effet, seuls 6 centres ont été construits depuis 1995. Cependant, depuis 2010 et l’ouverture de centres totalement dédiés au soin, la technique de l'hadronthérapie est arrivée à maturité au Japon et se développe en Europe.
Principe de l'hadronthérapie
Approche fondamentale
Grâce à leur charge électrique les ions légers (particules nommées aussi hadrons car ils sont constitués de neutrons et de protons) peuvent acquérir de l'énergie dans les accélérateurs de particules et être guidés en faisceaux précis. Ils peuvent alors être vus comme des projectiles possédant une certaine énergie. À la sortie des accélérateurs les particules interagissent avec leur milieu grâce à différents types d'interactions :
- l'effet photo-électrique ;
- la diffusion Compton ;
- la création de paire électron/positron.
Les particules chargées déposent une énergie dans le milieu qu'elles traversent. Ce dépôt d'énergie par unité de longueur a été décrit par Hans Bethe, lauréat du prix Nobel de physique 1967, grâce à un développement perturbatif en mécanique quantique donnant naissance à la formule de Bethe et Bloch :
où est le rayon classique de l'électron, est la masse de l'électron, est le nombre d'Avogadro, est l'énergie de première ionisation, est le nombre atomique du matériau absorbant, est le nombre de nucléons du matériau absorbant, est la densité du matériau absorbant, est la charge de la particule incidente, , est la vitesse de la particule incidente, est la vitesse de la lumière, est l'énergie de transfert maximale dans une collision simple.
Toutefois on utilise plus facilement les pics de Bragg pour pouvoir avoir une meilleure visualisation de la déposition d'énergie dans un milieu. Alors que les courbes du dépôt d'énergie des photons et des électrons varient peu en fonction de la distance on observe que le pic de Bragg des hadrons forme bel et bien un vrai pic, les ions déposent donc une importante quantité d'énergie sur une très courte distance avant de s'arrêter complètement.
Les propriétés balistiques des ions légers sont d'une importance capitale en hadronthérapie car elles permettent de traiter la tumeur avec une meilleure précision qu'en radiothérapie conventionnelle en limitant les dommages faits aux cellules saines, ce qui implique moins d’effet indésirables pour le patient au terme du traitement.
Approche biologique
Cette énergie, transférée par des chocs successifs des particules dans les tissus cibles, provoque une excitation et une ionisation du milieu ainsi que des dommages aux cellules visées. Pour parler du transfert d'énergie particules/environnement les physiciens utilisent la formule de Bethe et Bloch ou le pic de Bragg alors que les radiobiologistes préfèrent utiliser le transfert linéaire d'énergie (LET) qui est défini comme l'énergie moyenne déposée par unité de longueur de la trajectoire de la radiation. On distingue deux catégories de radiations :
- les radiations à faible LET qui correspondent aux radiations photoniques X ou gamma ;
- les radiations à LET élevé qui correspondent aux radiations particulaires tels que les hadrons.
Les particules chargées ont un LET plus élevé que les photons du fait d'un dépôt d'énergie plus important le long de la trajectoire. Ceci influe sur l'efficacité biologique relative (RBE), lorsque le LET croît le RBE croît également, les particules chargées ont donc un effet sur les cellules plus efficaces que les photons X ou gamma. Toutefois le RBE commence à décroître à partir d'une valeur seuil du LET (environ 100 keV μm−1) car l'énergie est supérieure à celle nécessaire pour détruire les cellules. Il n'est donc pas utile d'essayer d'irradier des cellules avec un LET trop élevé car les cellules ciblées meurent à partir du LET seuil et au-delà l'irradiation devient dangereuse pour les cellules saines environnantes. Pour des radiations à LET élevé les évènements induisant les pertes d'énergie des particules (ionisations, excitations) sont plus proches spatialement et la distance entre deux évènements atteint même la dimension d'une biomolécule facilitant ainsi les dommages. L'énergie déposée par les particules provoque des lésions de l'ADN et des dommages au niveau cellulaire provoquant la mort des cellules irradiées. L'hadronthérapie s'avère donc plus efficace d'un point de vue biologique et est donc un choix intéressant dans le cadre du traitement des cancers.
Approche thérapeutique
Il existe plusieurs manières de traiter un cancer, en particulier la chirurgie, la radiothérapie ou bien encore la chimiothérapie. Ces techniques sont souvent complémentaires et sont prescrites simultanément ou successivement lors du traitement d’un patient.
Dans le cadre de certaines tumeurs, l'hadronthérapie devient une méthode de choix. C’est le cas par exemple, pour le traitement de tumeurs localisées au niveau du cerveau lorsqu’une opération chirurgicale est impossible. La radiothérapie conventionnelle étant trop invasive il est nécessaire d'utiliser l'hadronthérapie qui est beaucoup plus précise et endommage moins les cellules saines autour de la tumeur à irradier.
La nécessité d'appliquer une dose précise de rayonnement de manière à ne pas détruire l'environnement sain de l'organe visé implique de nombreuses précautions préalables au traitement. L'imagerie médicale (PET, CT-PET…) permet d'avoir une image tridimensionnelle de la tumeur pour faire des simulations informatiques afin de déterminer la dose de rayonnement optimale à administrer au patient.
La protonthérapie : elle est notamment utilisée pour traiter les tumeurs ophtalmiques. Elle présente aussi des avantages pour soigner certaines tumeurs pédiatriques.
La carbonethérapie : elle est destinée spécifiquement au traitement d’un groupe défini et limité de tumeurs. Il s’agit des tumeurs inopérables ou incomplètement résécables et particulièrement radiorésistantes situées dans un contexte de tissus sains radiosensibles. Ces circonstances limitent l’efficacité des radiothérapies classiques, y compris la photonthérapie conformationnelle avec modulation d’intensité et la protonthérapie, quant aux techniques avancées de radiothérapie comme l’arcthérapie dynamique, la tomothérapie ou le Cyberknife, elles perdent leurs qualités balistiques dès que la cible dépasse 5 à 6 cm de diamètre moyen.
Avantages et inconvénients de l'hadronthérapie par rapport à la radiothérapie conventionnelle

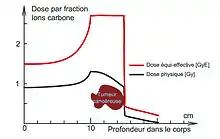
Les principaux avantages par rapport à la radiothérapie classique sont :
- une balistique plus précise. Lors de l'irradiation d'une zone cancéreuse, le rayonnement traverse les tissus en y déposant une certaine énergie (dose absorbée). Avec des photons ce dépôt en énergie est dégressif au travers du corps traversé alors que dans le cas des ions légers, les particules sont stoppées dans la matière et c'est en fin de parcours où leur dépôt d'énergie est le plus important. Ainsi, en hadronthérapie, et plus particulièrement en carbonethérapie, une grande partie de l'énergie de la particule est déposée sur une courte distance et en profondeur. Cette qualité balistique permet d'atteindre plus précisément des cibles localisées en profondeur et donc de traiter des tumeurs cancéreuses non opérables ou résistantes aux rayons X, tout en épargnant mieux les tissus sains environnants ;
- une efficacité biologique relative supérieure à celle des photons. Les dégâts causés par un rayonnement hadronique sur les cellules tumorales sont globalement supérieurs à ceux causés par des photons en radiothérapie et cela d'un facteur de 1,1 à 2 pour les protons et de 2 à plus de 5 pour les ions carbone (sachant que pour un même rayonnement les effets varient d'un organe à un autre);
- quand il s'agit d'ions carbone, l'efficacité en termes de destruction des cellules tumorale est, à dose équivalente, très supérieure à celle des photons ou des protons.
Ces avantages nécessitent en contrepartie un contrôle plus efficace du tir, faute de quoi, il endommagerait les cellules périphériques plus gravement que ne l'auraient fait les solutions classiques. Des moyens de contrôler du tir sont en cours de développement ou d'étude, avec notamment un projet de Gamma-caméra qui devrait permettre le contrôle en ligne et en temps réel de la dose déposée lors d’un traitement.
Déroulement d’un traitement par hadronthérapie
Afin de d'administrer une dose optimale aux patients il est nécessaire d’établir un plan de traitement pour l'hadronthérapie comme pour toute autre technique de radiothérapie. Le déroulement d’un traitement est constitué de 4 grandes étapes nécessitant l’intervention d’un radiothérapeute, d’un physicien médical, du dosimétrise et de techniciens manipulateurs :
- l'imagerie ;
- la planification du traitement ;
- le traitement ;
- le contrôle post-traitement.
Imagerie médicale
L'imagerie médicale est primordiale pour définir la taille et la forme de la tumeur, ces informations étant utiles pour connaître exactement le volume à irradier ainsi que la direction que le faisceau doit avoir pour éviter d’irradier des organes. Les techniques d'imagerie 2D et 3D les plus utilisées sont le scanner, la tomographie par émission de positons (TEP) et l'imagerie par résonance magnétique (IRM). Grâce aux images obtenues il est possible de planifier le traitement.
Plan de traitement
Une fois les images obtenues le médecin détermine le volume (zone(s) tumorale(s)) qui doit être traité. Pour des raisons techniques et préventives il est nécessaire de ne pas fixer la zone d'irradiation à la tumeur brute, il faut également prendre en compte plusieurs paramètres comme les marges techniques ou les tissus présentant des risques de développement de cancer. Les zones à définir pour le traitement sont les suivantes :
- le volume de tumeur brute qui définit le volume occupée par la tumeur ;
- le volume de tumeur suspectée qui correspond aux zones où un développement tumorale est mis en question, ce volume est irradié pour des raisons préventives ;
- le volume de marge interne qui définit le mouvement de la tumeur. Ce mouvement peut avoir différentes origines, il peut provenir d'un mouvement dit « instantané » de l'organe du à la respiration du patient, ou bien par un mouvement interne durant toute la durée du traitement du au déplacement plus ou moins important de l'organe dans le corps ;
- la marge de paramétrage qui prend en compte les erreurs techniques de l'appareil utilisé ;
- les organes à risques correspondant aux organes voisins de la tumeur pour lesquels la dose d’irradiation est volontairement limitée.
Une fois ces volumes définis par le médecin, une modélisation et des simulations informatiques sont pratiqués par le dosimétriste sous le contrôle du physicien médical. Le traitement d’une tumeur nécessite généralement la superposition de faisceau avec des incidences différentes. C’est aussi à ce moment-là qu’est fixé le nombre de séances de traitement. À l’issue de ce travail d’optimisation de la distribution de la dose, la planification du traitement est acquise.
Traitement
Le traitement consiste à appliquer le plan de traitement. Il se déroule en plusieurs séances de 10 à 30 minutes. À chaque séance, le patient est immobilisé sur la table de traitement puis précisément positionné grâce à un système d’imagerie. L’irradiation en tant que tel ne prend généralement que quelques minutes et est totalement indolore. La dose délivrée au patient est contrôlée en temps réel par des moyens techniques indépendants de la machine. Pour la plus grande partie des patients, le traitement ne nécessite pas d’hospitalisation.
Contrôle post-traitement
Postérieurement au traitement, le patient est suivi par l’oncologue qui l’a soigné. À court terme, l’objectif est de vérifier qu’il n’y a pas de complications post-traitement et que la tumeur est en rémission. À plus long terme, l’objectif est de surveiller la santé du patient.
Accélérateurs médicaux et centres de soin
Utilisation thérapeutique
La protonthérapie est principalement utilisée contre les cancers proches des voies optiques ainsi que ceux localisés dans le cou, proches de la moelle épinière. Dans certains cas la protonthérapie est utile pour le traitement du cancer de la prostate.
Il existe différents types d'accélérateurs de particules à usage médical, les plus fréquents étant les accélérateurs linéaires utilisés en radiothérapie. Le cyclotron est principalement utilisé pour la protonthérapie, car ils permettent d'accélérer les protons à une énergie idéale pour le traitement des tumeurs. De nouvelles machines ont vu le jour ces dernières années basées sur le principe du synchrocyclotron équipé de bobine supraconductrice.
| Nom | Ville | Pays |
|---|---|---|
| MGH Francis H. Burr Proton Therapy Center | Boston | |
| Institut Paul Scherrer | Villigen | |
| ISL | Berlin | |
| Rinecker Proton Therapy Center | Munich | |
| Proton Medical Research Center - Université de Tsukuba | Tsukuba | |
| Centre de protonthérapie de l'Institut Curie | Orsay | |
| Centre Antoine-Lacassagne | Nice | |
| Proton Therapy Institute - Université de Floride | Jacksonville | |
| ProCure Proton Therapy Center'' - Oklahoma City | Oklahoma City | |
| The Roberts Proton Therapy Center | Philadelphie | |
| Westdeutschen Protonentherapiezentrum | Essen | |
| Wanjie Proton Therapy Center | Zibo | |
| Hampton University Proton Therapy Institute | Hampton |
Le centre de protonthérapie d'Orsay
En 1937, Frédéric Joliot-Curie lance le projet de construire le premier cyclotron de France, et c'est dans les années 1950 que le laboratoire de physique et chimie nucléaire du Collège de France est implanté sur le site d'Orsay et que le cyclotron y est transporté. En 1958, le laboratoire fait l'acquisition d'un synchrocyclotron, plus performant que le précédent cyclotron, afin de faire de nouvelles recherches dans le domaine de la physique nucléaire. L'accélérateur est devenu ensuite obsolète par l'apparition de nouveaux appareils plus puissants, mais c'est dans les années 1980 qu'est décidé de recycler le synchrocyclotron dans le but de faire de la protonthérapie.
Le CPO a été inauguré en 1991 dans l'espoir de traiter les patients atteints de mélanomes malins de la choroïde. En , il réalise le premier traitement ophtalmologique et en le centre réalise son premier traitement intracrânien. En est mis en place une alternance rapide permettant de basculer le faisceau de proton d'une salle de traitement à une autre en un peu moins de 2 minutes. En , le centre réalise le premier traitement pédiatrique et se spécialise dans le traitement des cancers des jeunes enfants. Aujourd'hui le synchrocyclotron utilisé au Centre de Protonthérapie d'Orsay (CPO) permet de fournir une énergie maximale de 230 MeV aux protons optimisant ainsi la RBE nécessaire pour irradier les cellules cancéreuses. Le centre est équipé de trois salles de traitement permettant de répondre à une demande de traitement plus rapide. La future mise en place d'un bras isocentrique permettant d'orienter le faisceau de protons autour du patient va permettre en premier lieu de traiter des tumeurs qui n'étaient jusque-là pas atteignables mais en plus de réduire le volume de tissus sains irradié ce qui permettra de limiter les complications post-traitement.
Depuis sa création jusqu'en , le CPO a accueilli 5949 patient dont 4748 ont été traités pour une tumeur oculaire. Il est aujourd'hui encore en fonctionnement et compte améliorer sa structure afin de rendre les traitements encore plus performants[3].
Utilisation thérapeutique
Les ions carbones sont utilisés spécifiquement au traitement d’un groupe défini et limité de tumeurs. Il s’agit des tumeurs inopérables ou incomplètement résécables et particulièrement radiorésistantes situées dans un contexte de tissus sains radiosensibles. Ces circonstances limitent l’efficacité des radiothérapies classiques, y compris la photonthérapie conformationnelle avec modulation d’intensité et la protonthérapie. Quant aux techniques avancées de photonthérapie comme l’arcthérapie dynamique, la tomothérapie ou le Cyberknife, elles perdent leurs qualités balistiques dès que la cible dépasse 5 à 6 cm de diamètre moyen.
| Nom | Ville | Pays | Localisation | Commentaire |
|---|---|---|---|---|
| Helmholtzzentrum für Schwerionenforschung (Centre de recherche sur les ions lourds) | Darmstadt | 49° 55′ 54,71″ N, 8° 40′ 46,2″ E | Activité de soin transférée à HIT | |
| Heidelberger Ionenstrahl-Therapiezentrum (de) (HIT) | Heidelberg | 49° 24′ 58,87″ N, 8° 40′ 02,02″ E | Opérationnel | |
| Heavy Ion Medical Accelerator (HIMAC (ja)) | Chiba | 35° 38′ 09,84″ N, 140° 06′ 13,62″ E | Opérationnel | |
| Hyogo Ion Beam Medical Center (兵庫県立粒子線医療センター (ja)) | Hyogo | 34° 56′ 48,17″ N, 134° 25′ 49,54″ E | Opérationnel | |
| Centro Nazionale di Adroterapia Oncologica | Pavie | 45° 11′ 57,61″ N, 9° 08′ 26,03″ E | Opérationnel | |
| Espace de Traitement Oncologique par Ions Légers dans le cadre Européen | Lyon[4] | 45° 44′ 20,26″ N, 4° 53′ 22,47″ E | Projet suspendu[réf. souhaitée] | |
| Advanced Resource Centre for HADrontherapy in Europe | Caen | 49° 10′ 59″ N, 0° 22′ 10″ O | Projet[5], ouverture du centre de protonthérapie 2017 | |
| Austrian Ion Therapy & Cancer-Research Centre Project | Wiener Neustadt | 47° 49′ N, 16° 14′ E | En construction, ouverture en 2015 | |
| Heavy-Ion Medical Center | Gunma | Opérationnel | ||
| Heavy Ion Medical Accelerator | Tosu | Opérationnel | ||
| Kanagawa Cancer Center (en) | Yokohama | En construction, ouverture en 2015 |
Le Centre National d'Hadronthérapie Oncologique
La fondation CNAO (Centro Nazionale di Adroterapia Oncologica) est créée en 2001 dans l'optique de construire un synchrotron médical qui sera utilisé pour le traitement des tumeurs par ions carbone. De 2002 à 2004 la construction du centre se planifie et les travaux dureront 7 ans, de 2005 à 2012. Le synchrotron a un diamètre de 25 mètres soit un périmètre de 80 mètres. Les protons peuvent acquérir une énergie maximale de 250 MeV tandis que les ions carbone peuvent être accélérés jusqu'à une énergie de 480 MeV. Le centre est constitué de trois salles de traitement, deux ont un faisceau horizontal tandis que la troisième est reliée à deux sorties du synchrotron de manière à avoir un faisceau de particules horizontal et vertical.
Le premier patient est accueilli en et en le centre aura traité 42 patients atteints de tumeurs oculaires par protons et 3 patients par ions carbone. Le centre venant juste d'ouvrir ses portes les statistiques sont faibles mais en deux mois plus d'une quarantaine de patients ont déjà été traités[6].
Statistiques
On peut résumer les résultats des études cliniques par[7],[8] :
- environ 1 % des patients soignés par radiothérapie bénéficient avantageusement d'un traitement par protonthérapie ;
- environ 12 % des patients traités aujourd'hui avec des photons devraient profiter d'un traitement par protons mais d'autres études cliniques sont nécessaires pour quantifier, localisation par localisation, les avantages cliniques ;
- environ 3 % des patients traités aujourd'hui avec des photons pourraient avantageusement bénéficier d'un traitement par ions carbone. Pour environ 1 % de ces indications l'hadronthérapie par ions carbone a déjà fait la preuve de son intérêt médical, pour les autres, des essais d'escalade de dose et d'études cliniques sont en cours.
En , un total de 108 238 patients atteints d'un cancer ont été traités par hadronthérapie dont 2 054 par ions hélium, 1 100 par des pions, 10 746 par ions carbone, 93 895 par protons et 433 par d'autres types d'ions.
Recherche clinique et résultats des traitements par carbonethérapie
Les données médicales publiées dans la littérature scientifique rapportent des études de phase I/II, des phases II « poussées » évaluant l’efficacité du traitement, d’études observationnelles au long cours et de cohortes[9]. Ces données démontrent la supériorité de 20 à 25 % des traitements par carbonethérapie avec une bonne tolérance au traitement, une faible toxicité et un taux de cancers radio-induits quasi nul. Par ailleurs, les Japonais commencent à publier des résultats très prometteurs[réf. nécessaire] sur des pathologies relevant des indications prospectives telles que des sarcomes utérins, des carcinomes bronchiques et des cancers du pancréas résécables pour lesquels le taux de survie sans rechute est de 42 % à 5 ans (soit le double des meilleurs résultats actuels) sans effets secondaires sérieux observés.
Recherche et développement
Recherche en hadronthérapie
La recherche en hadronthérapie est active à l'échelle internationale. Elle vise à approfondir les connaissances fondamentales et à développer la technologique pour améliorer et étendre les applications médicales[10]. Les sujets de recherches sont variés et complémentaires, ils peuvent se résumer à 4 grands thèmes :
- le ciblage et l’évaluation de l’intérêt médical de l’hadronthérapie (recherche clinique) ;
- l’amélioration des plans de traitement (modélisation et simulation informatique) ;
- l’amélioration de la compréhension de l’effet des traitements (radiobiologie) ;
- l’amélioration de la qualité des traitements (instrumentation).
Des recherches ont été conduites au CERN pour pouvoir utiliser des faisceaux d’antiprotons, au lieu de protons ou de noyaux atomiques. Cette fois, c’est l’énergie dégagée par l’annihilation, entre les antiprotons injectés et les protons présents dans la cible, qui détruira la tumeur. Cette méthode serait plus avantageuse que les autres thérapies par faisceau de particules car moins dommageable pour les tissus sains. Les premiers résultats sont prometteurs, mais les applications médicales ne sont pas attendues avant de nombreuses années[11].
Le développement des nanoparticules d'or pour un traitement du cancer plus efficace est également en phase de recherche. Ces nanoparticules amplifient les dommages faits par les radiations grâce à une réaction en chaîne. Cela permettrait d'avoir d'infliger des dommages équivalents aux cellules cancéreuses tout en abaissant la dose radiative injectée et ainsi diminuer les dommages que subissent les cellules saines[12].
Hadronthérapie et applications spatiales
L'hadronthérapie est aussi un domaine intéressant pour les applications spatiales. Une fois dans l'espace, les premiers astronautes voyaient de temps en temps des flashs bleus sans en comprendre réellement l'origine[13]. Les patients ayant des tumeurs proches des voies optiques sont également victimes de ce phénomène lors du traitement. Ce phénomène s'avère provenir de l'effet Cerenkov. Lorsqu'une particule dépasse la vitesse que peut atteindre la lumière dans l'œil, elle émet des photons principalement de la longueur d'onde correspondant à la lumière bleue. La source des particules est différente dans les deux cas, le patient voit le rayonnement issu du faisceau de particules tandis que les astronautes voient les photons issus des rayonnements cosmiques. Les réactions des patients sont une source intéressante pour l'étude des particules cosmiques sur la santé, les industries et laboratoires spatiaux s'intéressent aux réactions des patients post-traitement pour déterminer les effets des rayonnements sur les astronautes et ainsi construire des vaisseaux blindés contre les rayonnements cosmiques[14].
Notes et références
- Victor Despeignes (1866–1937) : comment un hygiéniste devint le premier radiothérapeute de l’Histoire
- Robert R. Wilson, père de la protonthérapie.
- Site officiel Site de l'Institut Curie sur le Centre de Protonthérapie implanté à Orsay
- http://www.economie.grandlyon.com/recherche-sur-le-site-grand-lyon-economie-118.html?L=0&q=hadronthérapie
- « Najat Vallaud-Belkacem inaugure à Caen le Pôle des formations et de la Recherche en Santé », sur Paris-Normandie (consulté le ).
- (it) Site du CNAO Centro Nazionale di Adroterapia Oncologica
- (en) R. Mayer et al., « Epidemiological aspects of hadron therapy: a prospective nationwide study of the Austrian project MedAustron and the Austrian Society of Radio-oncology », Radiother Oncol., vol. 73, , S24–S28.
- (en) U. Amaldi et G. Kraft, « Radiotherapy with beams of carbon ions », Reports on Progress in Physics, vol. 68, , p. 1861-82 (DOI 10.1088/0034-4885/68/8/R04).
- Résultats constatés au Japon
- « La recherche en hadronthérapie »
- public.web.cern.ch ; ACE – Antiproton Cell Experiment, consulté en avril 2010.
- « Vaincre le cancer grâce aux nanoparticules d'or »
- Effet Cerenkov - Certains astronautes voient des flashs bleus.
- (en) M. Durante. « Heavy ion radiobiology for hadrontherapy and space radiation protection » Radiother Oncol. 2004;73 Suppl 2:S158-60.
- Portail de la physique
- Portail de la médecine