Diméthoate
Le diméthoate, ou 2-diméthoxy-phosphinothioylthio-N-méthylacétamide, ou ([O,O-Dimethyl S-(N-methylcarbamoylmethyl) phosphorodithioate]) est un composé organique neurotoxique de la famille des organophosphorés de formule C5H12NO3PS2. C'est un insecticide et acaricide à large spectre apparu en 1948 à action systémique ou par contact. Cette substance agit en inhibant les activités de la cholinestérase, enzyme essentielle pour le bon fonctionnement du système nerveux des insectes mais aussi chez l'être humain.
| Diméthoate | |||

| |||
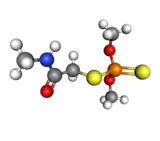 | |||
| Formule semi développée du diméthoate (haut) | |||
| Identification | |||
|---|---|---|---|
| Synonymes |
Phosphamide |
||
| No CAS | |||
| No ECHA | 100.000.437 | ||
| No CE | 200-480-3 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolores (produit pur), d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C5H12NO3PS2 [Isomères] |
||
| Masse molaire[2] | 229,257 ± 0,016 g/mol C 26,19 %, H 5,28 %, N 6,11 %, O 20,94 %, P 13,51 %, S 27,97 %, |
||
| Propriétés physiques | |||
| T° fusion | 51 à 52 °C[1] | ||
| T° ébullition | à 0,01 kPa : 117 °C[1], (décomposition >60 °C) |
||
| Solubilité | dans l'eau à 21 °C : 25 g·L-1[1], Soluble dans le chloroforme, le chlorure de méthylène, le benzène, l'alcool, les esters et les cétones. |
||
| Masse volumique | 1,3 g·cm-3[1] | ||
| Point d’éclair | 107 °C (coupelle fermée)[1] | ||
| Pression de vapeur saturante | à 25 °C : 0,001 Pa[1] | ||
| Précautions | |||
| SGH[3] | |||
 Attention |
|||
| Transport | |||
| Écotoxicologie | |||
| DL50 | 235 mg·kg-1 (rats, oral) | ||
| LogP | 0,5-0,8[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Utilisations

Le diméthoate est rapidement efficace contre de nombreuses espèces d'insectes, en particulier les insectes suceurs-piqueurs tels que pucerons, les thrips, les cicadelles et les aleurodes ainsi que contre les mineuses (larves de diptères creusant des galeries dans les feuilles). On l'a beaucoup utilisé en ville et en pulvérisation sur les murs des bâtiments agricoles contre la mouche domestique (en raison de sa vitesse de dégradation). On l'a également administré au bétail pour lutter contre certains diptères parasites (Oestridae).
Il présente certaines propriété de perturbateur endocrinien[4] En 2000, toutes ses autorisations d'usages non-agricoles ont été annulés (y compris comme insecticide domestique).
Rien qu'aux Etats-Unis, l'EPA a estimé qu'environ 816 466 kg d'ingrédient actif de ce produit étaient annuellement appliqués vers 2005 en agriculture dans le pays, principalement sur la luzerne, le blé, le coton et le maïs (US EPA, 2009 cité par Scoy & al (2016)[5]. En Californie, son utilisation sur la luzerne, les oranges et le raisin a diminué d'environ 90% entre 1990 et 2011[6].
Solubilité
Sa liposolubilité est nulle (impossibilité de bioaccumulation dans les tissus gras et absorption cutanée "très lente" selon une étude datant de 1964) mais sa solubilité dans l'eau très forte[7] (ce qui en fait un très bon nettoyant de la peau en cas de contact (un contact prolongé est source d'irritation de la peau[8]).
Métabolisation
Chez les mammifères (dont l'homme), absorbé, il est converti dans le foie en au moins quatre métabolites bioactifs Ce n'est pas la molécule de diméthoate pur qui est toxique mais tout ou partie de ses métabolites.
Ces produits de dégradation, hautement toxiques, ont une courte durée de vie dans l'organisme, et leurs produits d'hydrolyse sont rapidement excrétés (il s'agit principalement de theurine)[8].
Mise en garde
Le diméthoate est classé très toxique, nocif et dangereux.
Toxicité
Sa neurotoxicité est induite par son activité anticholinestérase indirecte (typique des organophosphorés), qui n'apparait qu'au delà de certaines doses et qui est toujours le premier effet détecté. Selon Sanderson et Edson (1964) ; pour une exposition orale de 3 semaines l'inhibition de la cholinestérase apparaîtrait chez l'homme adulte à partir de doses de 2 à 5 mg/j (et peut-être pas avant 18 mg ingérés quotidiennement pendant au moins trois semaines)[8] ce qui en fait un produit moins toxique que la plupart des autres organophosphorés.
Le principal métabolite retrouvé dans la plante traitée est identique à celui formé dans le foie. Selon Sanderson et Edson (1964), les tests comparatifs avec du diméthoate normal et partiellement métabolisés dans les végétaux ont montré que « l'analyse des résidus déterminait le risque total »[8].
Le produit est très soluble dans l'eau, mais les dangers de ses vapeurs sont en 1964 jugés "négligeables" par Sanderson et Edson[8].
Selon une étude produite en 1964, c'est-à-dire après les 5 premières années de mise sur le marché de cette molécule, sa toxicité cutanée est "faible"[8].
Signes d'empoisonnement : ils sont typiques de ceux induits par les inhibiteurs de l'acétylcholinestérase: fibrillation, salivation, larmoiement, incontinence urinaire, diarrhée et parfois dyspnée[8].
Chez l'animal de laboratoire, les symptômes de l'intoxication orale apparaissent de 0 à 5 heures après l'ingestion du produit, ce délai est d'autant plus long que le produit ingéré est pur, phénomène typique des inhibiteurs de la cholestérase : le produit est inactif tant qu'il n'est pas métabolisé. Il a été constaté qu'avec le diméthoate pur, une narcose a souvent précédé les effets cholinergiques.
Toujours chez l'animal de laboratoire, quand elle conclut l'intoxication, la mort survient généralement 3 à 30 heures après l'administration du produit, alors que le rétablissement des effets cholinergiques prend habituellement deux à quatre jours[8].
La dose orale toxique est difficile à établir pour l'homme, car le rat et le cobaye de laboratoire présentent une sensibilité très différente à ce produit : la cholinestérase est inhibée à partir de doses cumulées de 07 mg/kg/jour chez le rat mais de 4 mg/kg/jour chez le cobaye (dose près de 6 fois plus importante). Chez les rats en croissance l'exposition alimentaire entraine une inhibition de la cholinestérase à partir de 0-5 mg/kg/jour (et autre effet n'avaient été signalés par l'étude de 1964 à 10 fois cette dose)[8]. Le produit se montre en outre plus toxique pour le chien, et plus encore pour la vache que pour le rat de laboratoire[8].
Sa toxicité orale n’a été potentialisée par aucun de 17 autres insecticides envisagés par Sanderson et Edson en 1964[8], mais ils notent que la formulation peut interagir avec la toxicité. Une solubilisation dans certains solvants alcooliques (en particulier dans le 2-méthoxy et le 2-éthoxyéthanol et moindrement dans l’isopropanol) aggrave sa toxicité[8].
En 2016, selon l'EFSA interrogée par la commission européenne à la suite d'une saisine du ministre français Stéphane Le Foll, « le manque de données fournies par l’entreprise pour utiliser ce produit dans le traitement des cerises et conclut que le risque potentiel à long terme et le risque aigu du diméthoate sur la santé des consommateurs ne peuvent pas être exclus »[9].
Antidotes
En 1964, on estimait que les symptômes d'empoisonnement pourraient être traités efficacement par l'atropine, mais pas par l'oximethérapie alors utilisée pour soigner certaines intoxications aux organophosphorés[8].
Ecotoxicité
Une fois dans la nature, sa principale voie de dégradation. (majeure en conditions alcalines) est l'hydrolyse (qui peut être catalysée ou photocatalysée par la présence de certains métaux[10]). Bien que très soluble dans l'eau, il est peu volatile à partir de l’eau ou des sols humides[5]. Il semble montre aussi biodégradable dans les stations d'épuration, par des Aspergillus [11]ou de de Paracoccus[12], et en conditions anaérobies (sol tassé, vases, sédiments non aérés) avec alors des métabolites différents[13],[14], dont comme principal produit de dégradation, l'ométhoate[5].
Cet insecticide s'est révélé moins écotoxique que les autres organophosphoré, grâce notamment à une persistance et bioaccumulation généralement faible dans les sols (sauf cas particuliers liés au type de sol[15],[16],[17],[18]), mais il affecte un large spectre d'espèces (y compris végétales)[5]
Pour les animaux et l'écosystème
De par ses fonctions même (insecticides, acaricides) il est très écotoxique pour de nombreux organismes à sang froid. Il est également toxique pour tous les organismes à sang chauds à partir de doses qui varient beaucoup selon l'espèces et l'âge, mais sa durée de vie et sa toxicité sont moindre que pour d'autres organophosphorés. En 1964 sa toxicité aiguë par ingestion était considérée comme relativement faible pour les mammifères mais on notait déjà qu'elle était nettement plus élevée pour les oiseaux (ex : il s'était expérimentalement montré 10 fois plus toxique pour la poule que pour le rat et plus toxique encore pour le faisan (et son poussin[19]) que pour la poule[8]. On montrera ensuite qu'il inhibe chez les oiseaux l'activité d'enzymes cérébrales essentielles, avec chez eux des effets sublétaux sont évidents[5]. Ce produit pourrait donc participer au recul des populations d'oiseaux des champs (même non insectivores) constaté dans toutes les zones d'agriculture intensive.
Les organismes aquatiques (planctoniques jusqu'aux mammifère aquatiques, en passant par les mollusques, poissons[20], crustacés[21] [la crevette géante d'eau douce (Macrobrachium rosenbergii)] a servi d'animal de laboratoire vis-à-vis du diméthoate[22]), etc. y sont potentiellement exposés en aval des zones de traitement, car ce produit est très soluble dans l'eau[5]. Sa neurotoxicité induit chez eux des changements de comportement (dont natatoire[23]) qui peuvent leur être particulièrement dommageables[5],[24]. Le produit présente par exemple une toxicité cardiaque pour le crabe Carcinus maenas[25]
Outre par sa toxicité directe il peut affecter les populations d'insectivores (et de leur prédateurs donc) en les privant de proies[5].
Pour les pollinisateurs, abeilles domestiques notamment
Les études ont surtout concernés l'abeille domestique[5], mais des travaux de toxicologie ayant porté sur une coccinelle mangeuses de pucerons[5] ou sur des coléoptères[5] mangeurs d'invertébréss déprédateurs (deux autres groupes d'espèces considérées comme "utiles" à l'agriculture et fournissant un service agroécosystémique important peuvent aussi éclairer la connaissance dans ce domaine.
Comme tous les insecticides systémiques, le diméthoate est conçu pour pénétrer la plante et diffuser dans tous ces tissus, ce qui explique qu'on le retrouve aussi dans le nectar (ainsi le nectar produit par les fleurs d'une luzerne traitée au diméthoate (à 304 mg/L a.i.) contenait 16 mg/L de diméthoate le jour suivant l'application et en contenait encore 1 mg/L 15 jours plus tard[26]. Et à ces doses le nectar se montre toxique pour les larves d'abeilles ouvrières (Apis mellifera L.) nourries par ce nectar durant 7 jours (mortalité et inhibition de la cholinestérase) ; il n'est pas répulsif pour les abeilles ; « la survie des abeilles, le développement des colonies et la construction de rayons » sont affectés par ce produit, qui donné en solution avec du saccharose (jusqu'à 5 mg L) durant 3 semaines tue les abeilles dès la première semaine à la dose de 5 mg/L, et affecte fortement le comportement la colonie aux doses moindres (aucun nouveau rayonnage construit et chute de la production de miel)[5]. A 0,2 mg/L aucune toxicité n'était notée sur les abeilles elles-mêmes après 3 semaines d'exposition mais la production de rayonnages et d'œufs était réduite selon Waller et Barker en 1979[27]; les colonies ont été affectées à chacune des concentrations testées[5].
Jepson et al. (1995) ont montré que la coccinelle à 7 points adultes (Coccinella septempuncta) et les carabidés (Bembidion obtusum, Nebria brevicollis, Trechus quadristriatus et Demetrias atricapillus) sont aussi victimes de très faibles doses ce pesticide (quelques dizaines de nanogrammes, avec des DL50 (48 h) variant néanmoins de 17,7 à 98,8 ng/insecte. On note que plus l'insecte est grand, moins il semble vulnérable au produit (Les larves pourraient y être plus sensibles encore)[5]
Sans surprise pour un produit massivement utilisé, une résistance aux insecticides est notée chez certaines espèces, de moustiques notamment (les larves de chironomes résistaient à des doses atteignant 4,52 mg/L pour Chironomus riparius) ; et celles Kiefferulus calligaster ne mourrait pas jusqu'à des doses de à 7,12 mg/L [5]. Ces deux espèces manifestaient une inhibition significative de la cholinestérase mais l'activité de la glutathion S-transférase (GST) n'a pas été significativement affectée chez K. calligaster (par rapport à l'inhibition chez C. riparius)[5] ;
Vontas et al. ont montré en 2001 que le métabolisme oxydatif n'était pas chez la mouche de l'olive (Bactrocera oleae) le facteur principal de la résistance, c'est une acétylcholinestérase modifiée, ayant une faible efficacité catalytique, qui dans ce cas en constituait le principal facteur[28].
Pour les plantes
Paradoxalement, bien que vendu et utilisé comme "phytosanitaire" et "phytopharmaceutique" il se montre phytotoxique, affectant négativement la chlorophylle[29] et donc la photosynthèse et la croissance des végétaux[5].
Homologation en France
En France, cet insecticide est autorisé pour certaines spécialités commerciales pour plusieurs usages : traitement de légumes (asperges, carottes, chicorée) contre les mouches, pour le traitement des rosiers contre les acariens et pucerons[30].
Il est également homologué à la concentration de 400 g/l en oléiculture dans la lutte contre Bactrocera olea, à la dose de 0,075 l/hl. Il devait être employé comme larvicide curatif, pour viser la larve de la mouche de l'olive, à l'intérieur de l'olive.
Il était autorisé pour les cerises notamment contre le moucheron asiatique (Drosophila suzukii) jusqu'au , date de son retrait du marché pour cet usage, ce qui inquiète les producteurs[31]. Par arrêté du 18 avril[32] 2019, les importations de cerises traitées provenant de pays permettant l'utilisation du diméthoate (Autriche, Croatie, Turquie, Argentine, Chili) sont à nouveau interdites pour un an[33]. Le 8 avril 2020, cette interdiction est reconduite pour une année supplémentaire, cette interdiction ne concernant pas les productions issues de l'agriculture biologique exemptes du traitement par le diméthoate.
Bibliographie
- AFIDOL. Guide de l'oléiculteur 2015. AFIDOL, Aix-en-Provence, 2014, 8 p.
- EPA (United States Environmental Protection Agency) Office of Pesticide Programs (2008). Revised interim reregistration eligibility decisions for dimethoateUS Environmental Protection Agency Office of Prevention, Pesticides and Toxic Substances: Washington, D.C.
- Jepson PC, Efe E, Wiles JA (1995) The toxicity of dimethoate to predatory coleopteran: Developing an approach to risk analysis for broad-spectrum pesticides. Arch Environ Contam Toxicol 28:500-507
- Mirajkar N, Pope CN (2005) Dimethoate. Encyclopedia of Toxiocology pp. 47-49
- Schmalko ME, Ramallo LA, Ferreira D, Berlingheri RD (2002) Dimethoate degradation in plants and during processing of yerba mate leaves. Braz Arch Biol Techn 45(4):419-422
Références
- DIMETHOATE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Dogan D & Can C (2011) Endorcirne disruption and altered biochemical indices in male Oncorhynchus mykiss in response to dimethoate. Pestic Biochem Phys 99:157-161
- Van Scoy A, Pennell A & Zhang X (2016) Environmental fate and toxicology of dimethoate. Department of Pesticide Regulation, California Environmental Protection Agency, Sacramento, CA, 95812, USA, i Reviews of Environmental Contamination and Toxicology Volume 237 (pp. 53-70). Springer, Cham.
- CDPR (2014) Pesticide Use Reporting. Database. http://www.cdpr.ca.gov/docs/pur/purmain.htm consulté en aout 2014
- Source AFIDOL, conférence technique 1/12/2014.
- Sanderson D.M & Edson E.F (1964) Toxicological properties of the organophosphorus insecticide dimethoate. Occupational and Environmental Medicine, 21(1), 52-64.
- Lutte contre Drosophila Suzukii : l’avis rendu par l’EFSA pointe l’absence de données sur la santé des consommateurs dans le dossier du Diméthoate en traitement des cerises , communiqué du ministère de l'Agriculture, publié 11/04/2016
- Chen JQ, Wang D, Zhu MX, Gao CJ (2007) Photocatalytic degradation of dimethoate using nanosized TiO2 powder. Desalination 207:87-94
- Liu YH, Chung YC, Xiong Y (2001) Purification and characterization of a dimethoate-degrading enzyme of Aspergillus niger ZHY256, isolated from sewage. Appl Environ Microb 67(8):3746- 3749
- Li R, Zheng J, Wang R, Song Y, Chen Q, Yang X, Li S, Jiang J (2010) Biochemical degradation pathway of dimethoate by Paracoccus sp. Lgjj-3 isolated from treatment wastewater. Int Biodeter Biodegr 64:51-57
- DebMandal M, Mandal S, Pal NK, Aich A (2008) Potential metabolites of dimethoate produced by bacterial degradation. World J Microbiol Biotechnol 24:69-72
- Liang Y, Zeng F, Qiu G, Lu X, Liu X, Gao H (2009) Co-metabolic degradation of dimethoate by Raoultella sp. X1. Biodegradation 20:363-373
- Kolbe A, Bernasch A, Stock M, Schutte HR, Dedek W (1991) Persistence of the insecticide dimethoate in three different soils under laboratory conditions. Bull Environ Contam Toxicol 46:492-498
- El Beit IOD, Wheelock JV, Cotton DE (1977) Factors affecting the accumulation of dimethoate in soil. Intern J Environ Studies 11:187-196
- El Beit IOD, Wheelock JV, Cotton DE (1977b) Factors affecting the fate of dimethoate in soils. Int J Environ Stud 11:113-124
- El Beit IOD, Wheelock JV, Cotton DE (1978) Factors influencing the degradation of dimethoate in soils and solutions. Int J Environ Stud 11:253-260
- Martin PA, Johnson DL, Forsyth DJ (1996) Effects of grasshopper-control insecticides on survival and brain acetylcholinesterase of pheasant (Phasianus colchicus) chicks. Environ Toxicol Chem 15(4):518-524
- Pandey RK, Singh RN, Singh S, Singh NN, Das VK (2009) Acute toxicity bioassay of dimethoate on freshwater airbreathing catfish, Heteropneustes fossilis (Bloch). J Environ Biol 30(3):437-440
- Roast SD, Thompson RS, Donkin P, Widdows J, Jones MB (1999) Toxicity of the organophosphate pesticides chlorpyrifos and dimethoate to Neomysis integer (Crustacea: Mysidacea). Wat Res 33(2):319-326
- Satapornvanit K, Baird DJ, Little DC (2009) Laboratory toxicity test and post-exposure feeding inhibition using the giant freshwater prawn Macrobrachium rosenbergii. Chemosphere 74:1209- 1215
- Chen J, Wang Z, Li G, Guo R (2014) The swimming speed alteration of two freshwater rotifers Brachionus calyciflorus and Asplanchna brightwelli under dimethoate stress. Chemosphere 95:256-260
- Guo R, Ren X, Ren H (2012) Assessment the toxic effects of dimethoate to rotifer using swimming behavior. Bull Environ Contam Toxicol 89:568-571
- Lundebye AK, Curtis TM, Braven J, Depledge MH (1997) Effects of the organophosphorous pesticide, dimethoate, on cardiac and acetylcholinesterase (AChE) activity in the shore crab Carcinus maenas. Aquat Toxicol 40:23-36
- Barker RJ, Lehner Y, Kunzmann MR (1980) Pesticides and honey bees: Nectar and pollen contamination in alfalfa treated with dimethoate. Arch Environ Contam Toxicol 9:125-133
- Waller GD, Barker RJ (1979) Effects of dimethoate on honey bee colonies. J Econ Entomol 72:549-551
- Vontas JG, Cosmidis N, Loukas M, Tsakas S, Hejazi MJ, Ayoutanti A, Hemingway J (2001) Altered acetylcholinesterase confers organophosphate resistance in the olive fruit fly Bactrocera oleae. Pestic Biochem Phys 71:124-132
- Pandey JK, Gopal R (2011) Laser-induced chlorophyll fluorescence: A technique for detection of dimethoate effect on chlorophyll content and photosynthetic activity of wheat plant. J Fluoresc 21:785-791
- « Substance active: Diméthoate », sur e-phy (consulté le ).
- « Diméthoate: les producteurs de cerises inquiets après l'interdiction de cet insecticide », sur francesoir.fr, (consulté le )
- Le mois d'avril correspondant au début de la période de récolte et d'expédition des cerises fraîches.
- Arrêté du 18 avril 2019 portant suspension d'introduction, d'importation et de mise sur le marché en France de cerises fraîches destinées à l'alimentation produites dans un Etat membre de l'Union européenne ou un pays tiers dans lequel l'utilisation de produits phytopharmaceutiques contenant la substance active diméthoate est autorisée en traitement des cerisiers
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
- Portail de la protection des cultures