Agrégat atomique
Un agrégat atomique, souvent désigné par le terme anglais cluster, est un ensemble d'atomes liés de façon suffisamment étroite pour avoir des propriétés spécifiques, et de taille intermédiaire entre une molécule et un solide massif.
Cette définition très large recouvre deux réalités sensiblement différentes :
- Du point de vue chimique, elle désigne des composés chimiques, souvent des catalyseurs, constitués de quelques dizaines d'atomes avec généralement une forte proportion d'atomes métalliques.
- Du point de vue physique, les clusters s'appliquent à tous types d'atomes engagés dans des structures typiquement de plusieurs milliers d'atomes, formant par exemple des nanoparticules.
En chimie, il existe différentes sortes d'agrégats : le carbone et le bore peuvent ainsi constituer respectivement des agrégats tels que des fullerènes et des boranes, et les métaux de transition forment également des agrégats particulièrement stables[1].
Le terme cluster est introduit au début des années 1960 par le chimiste américain Frank Albert Cotton pour désigner les composés ayant des liaisons métal-métal. Plus précisément, cette définition se réfère aux composés contenant un groupe d'au moins deux atomes de métal liés par au moins une véritable liaison métal-métal[2]. Cette notion a depuis été étendue à toutes les structures d'au moins une demi-douzaine d'atomes (parfois, plusieurs centaines) dont la cohérence est assurée essentiellement par des liaisons non strictement covalentes.
On distingue les agrégats atomiques stabilisés par des ligands des agrégats « nus » (sans ligand) : les principaux ligands rencontrés dans ces structures sont le monoxyde de carbone, les halogénures, les isonitriles, les alcènes et les hydrures.
Historique
Au début des années 1970, Jean Farges et son équipe à l’Université d’Orsay a été un des premiers à mettre en évidence, par diffraction électronique, une différence de structure entre des agrégats d'argon et des cristaux d'argon de taille macroscopique[3].
Emploi des agrégats atomiques comme catalyseurs

Les clusters synthétiques de carbonyles de métaux ont été étudiés comme catalyseurs d'un grand nombre de réactions industrielles, particulièrement celles utilisant le monoxyde de carbone[4], mais il n'en existe encore aucune application industrielle. Les clusters Ru3(CO)12 et Ir4(CO)12 catalysent la production d'hydrogène par la réaction du gaz à l'eau (également catalysée par l'oxyde de fer(II,III) Fe3O4), tandis que le Rh6(CO)16 catalyse la conversion du monoxyde de carbone en hydrocarbures, une réminiscence du procédé Fischer-Tropsch, bien que, là encore, les catalyseurs à base d'oxydes de fer soient utilisés industriellement.
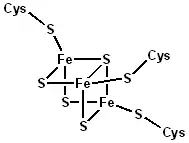
Les clusters naturels sont en revanche très présents parmi les catalyseurs biologiques. Les plus répandus sont ceux des protéines fer-soufre, comme la ferrédoxine, une protéine qui intervient notamment comme transporteur d'électrons dans la photosynthèse, ou encore la nitrogénase, une enzyme qui réduit l'azote en ammoniac à l'aide d'un cluster fer-molybdène-soufre dans son site actif ; le CO est oxydé en CO2 au niveau du cluster fer-nickel-soufre de la CO déshydrogénase, tandis que les hydrogénases utilisent plutôt des clusters Fe2 et FeNi[5].
Structure électronique
Les agrégats métalliques sont, la plupart du temps, constitués de métaux réfractaires. Ceux qui ont de grandes orbitales d forment des clusters stabilisés par le recouvrement favorable des orbitales de leurs électrons de valence. Les métaux de transition de la quatrième période forment ainsi des clusters stables avec un faible état d'oxydation, tandis que les métaux de transition des périodes suivantes en constituent aux états d'oxydation un peu plus élevés ; ces derniers forment l'essentiel des carbonyles de métaux polynucléaires, avec des états d'oxydation modérés.
La règle de Wade permet de prévoir assez justement la structure et la stabilité de la plupart des agrégats métalliques.
Notes et références
- James E. Huheey, « Inorganic chemistry : principles of structure and reactivity », Harper & Row 3e édition, New York, 1983. (ISBN 978-0-06-042987-4).
- D. M. P. Mingos et David J Wales, « Introduction to cluster chemistry », 1990. (ISBN 978-0-13-479049-7)
- Dictionnaire de Physique, de Jean-Pierre SARMANT (1981, éditions Hachette, p.41, article "agrégats")
- (en) Cluster Chemistry : Introduction to the Chemistry of Transition Metal and Main Group Element Molecular Clusters, (ISBN 978-0-387-56470-8 et 978-3-642-85926-7)
- (en) Bioorganometallics : Biomolecules, Labeling, Medicine, Gerard Jaouen, , 462 p. (ISBN 978-3-527-30990-0 et 9783527607693, DOI 10.1002/3527607692)