Addition nucléophile conjuguée
Une addition nucléophile conjuguée est un type de réaction organique. Les additions nucléophiles habituelles, ou additions nucléophiles 1,2, sont essentiellement des additions sur des composés carbonylés. Les alcènes simples ne présentent pas de réactivité 1,2 en raison de leur faible polarisation, à moins qu'ils soient activés par des substituants particuliers. Avec les composés carbonylés α,β-insaturés comme la cyclohexénone, on peut déduire des structures en résonance que la position β est un site électrophile susceptible de réagir avec un nucléophile. La charge négative de ces structures est présente sous forme d'un anion alcoolate. Ce type d'addition nucléophile est appelée addition nucléophile conjuguée ou addition nucléophile 1,4. Les principaux alcènes actifs sont les carbonyles –CH=CH–C(R)=O cités plus haut ainsi que les acrylonitriles –CH=CH–C≡N.
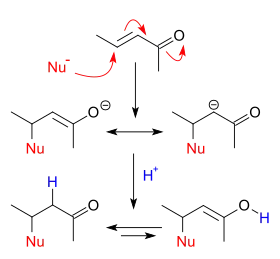
Mécanisme réactionnel
L'addition conjuguée est l'équivalent vinylogue de l'addition nucléophile directe. Un nucléophile réagit avec un composé carbonylé α,β-insaturé en position β. La charge négative portée par le nucléophile est délocalisée par résonance dans l'anion alcoolate et le carbanion sur le carbone α. La protonation conduit à la formation du composé carbonylé saturé par équilibre céto-énolique. En remplaçant le proton par un second électrophile dans la réaction précédente, on réalise une difonctionnalisation vicinale (en).
Réactions
Les composés carbonylés conjugués réagissent avec les amines secondaires pour former des 3-aminocarbonyles ; par exemple, l'addition conjuguée de la méthylamine CH2NH2 sur la cyclohexèn-2-one donne la 3-(N-méthylamino)-cyclohexanone. Ils réagissent également avec le cyanure d'hydrogène HCN pour former des 1,4-cétonitriles (hydrocyanation) ; par exemple, la source de cyanure de la réaction de Nagata est le cyanure de diéthylaluminium ((C2H5)2AlCN)n.
D'une manière générale, les organocuprates lithiés sont des nucléophiles efficaces pour les additions 1,4 sur les carbonyles conjugués. Parmi les réactions notables, l'addition de Michael fait intervenir l'addition conjuguée d'énolates sur des carbonyles conjugués. L'alkylation des énamines de Stork fait intervenir l'addition conjuguée de d'énamines sur des carbonyles conjugués.
Applications
L'addition conjuguée est efficace pour former de nouvelles liaisons carbone–carbone à l'aide de réactifs organométalliques comme illustré ci-dessous à partir d'un iodure organique en présence de méthylvinylcétone CH2=CH–CO–CH3 et d'un couple zinc-cuivre Zn(Cu)[1] :
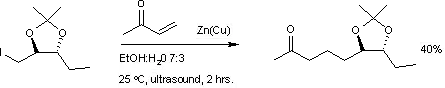
La synthèse de la (R)-3-phénylcyclohexanone à partir de cyclohexénone, d'acide phénylboronique, d'un catalyseur d'acétylacétone au rhodium et du ligand chiral BINAP est un exemple de synthèse asymétrique par addition conjuguée[2] :
-3-phenyl-cyclohanone.png.webp)
Dans un autre exemple de synthèse asymétrique, le composé carbonylé α,β-insaturé réagit d'abord avec un catalyseur et auxiliaire chiral imidazolidinone en donnant un iminium qui réagit de manière énantiosélective avec un furane nucléophile. Le produit immédiat de la réaction est une énamine nucléophile, puis la réaction se poursuit en éliminant un atome de chlore d'une quinone chlorée. Après élimination du catalyseur aminé, la cétone est fonctionnalisée avec un nucléophile et un électrophile dans un ratio syn:anti de 8:1 et un excès énantiomérique de 97 %[3].
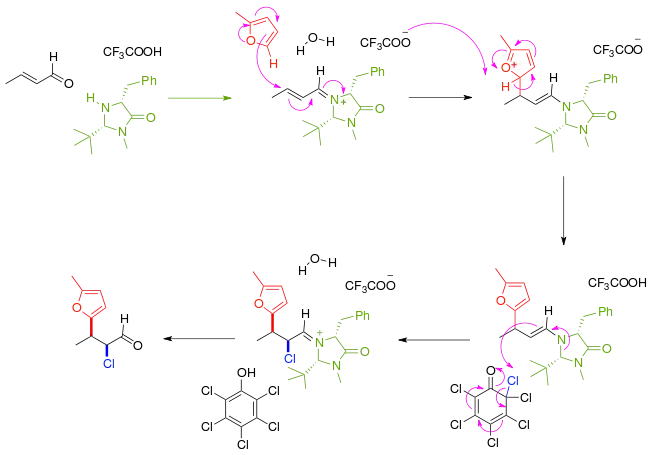
Ce principe s'applique également à une addition conjuguée multicomposants énantiosélective en cascade de thiols comme le benzylmercaptan C6H5CH2SH et l'azodicarboxylate de diéthyle CH3CH2O2CN=NCO2CH2CH3[4], un électrophile.

Notes et références
- (en) Andréa L. de Sousa et Inês S. Resck, « Asymmetric Synthesis of exo-Isobrevicomin and exo-Brevicomin via Conjugated Addition of Primary Alkyl Iodides to a,b-Unsaturated Ketones », Journal of the Brazilian Chemical Society, vol. 13, no 2, (DOI 10.1590/S0103-50532002000200015, lire en ligne)
- (en) Tamio Hayashi, Makoto Takahashi, Yoshiaki Takaya, Masamichi Ogasawara, Timothy B. Durham et Marvin J. Miller, « (R)-3-Phenylcyclohexanone », Organic Syntheses, vol. 79, , p. 84 (DOI 10.15227/orgsyn.079.0084, lire en ligne)
- (en) Yong Huang, Abbas M. Walji, Catharine H. Larsen et David W. C. MacMillan, « Enantioselective Organo-Cascade Catalysis », Journal of the American Chemical Society, vol. 127, no 43, , p. 15051-15053 (PMID 16248643, DOI 10.1021/ja055545d, lire en ligne)
- (en) Mauro Marigo, Tobias Schulte, Johan Franzén et Karl Anker Jørgensen, « Asymmetric Multicomponent Domino Reactions and Highly Enantioselective Conjugated Addition of Thiols to α,β-Unsaturated Aldehydes », Journal of the American Chemical Society, vol. 127, no 45, , p. 15710-15711 (PMID 16277506, DOI 10.1021/ja055291w, lire en ligne)
- Portail de la chimie