ATPase
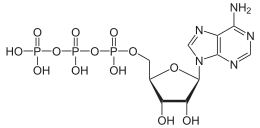
Les ATPases membranaires sont une classe d'enzymes liées au métabolisme énergétique, qui hydrolysent ou synthétisent les molécules d'adénosine-triphosphate (ATP) tout en transférant des ions d'un côté à l'autre de la membrane. Il en existe plusieurs classes, selon qu'elles synthétisent ou hydrolysent l'ATP, selon le type d'ion qu'elles transportent…
Leur implication centrale dans les transferts d'énergie au sein de la cellule en fait une classe de protéine ubiquitaire. Les ATPases de type F et P sont présents aussi bien chez les eucaryotes que chez les procaryotes, les ATPases de type V uniquement chez les eucaryotes.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Bioénergétique
- La synthèse d'ATP à partir d'ADP et de phosphate inorganique nécessite de l'énergie chimique. Cette énergie est fournie par la diffusion à travers le complexe enzymatique de certaines ATPases d'ions (protons) selon le potentiel électrochimique de membrane établi par ailleurs par une chaîne de transport d'électron. Les ATP ainsi produits sont la source d'énergie la plus courante dans le cytoplasme. Son hydrolyse, réaction exothermique, est couplée à des réactions chimiques endothermiques qui n'auraient pas lieu sinon.
- Les ATPases qui hydrolysent l'ATP utilisent son énergie pour transporter des ions contre leur gradient de concentration :
ATPase de type F ou F1-F0 ATP-synthase
Ces enzymes, situées dans une sphère pédonculée, sont activées lors du passage des protons (H+) de l'espace intermembranaire à la matrice (tout cela se situe dans la mitochondrie ou dans le chloroplaste, organites productrices d'énergie).
L'ATP synthase des mitochondries et chloroplastes est une enzyme anabolique qui utilise l'énergie d'un gradient transmembranaire de protons comme source d'énergie pour ajouter un groupe phosphate inorganique à une molécule d'adénosine diphosphate (ADP) pour former une molécule d'adénosine triphosphate (ATP).
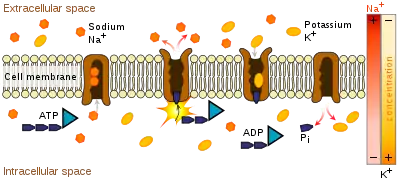
ATPase de type P
Les ATPases de type P (P' pour phosphorylation) participent au maintien d'un potentiel électrochimique de membrane en transportant des ions contre leurs gradients de potentiel au cours d'un cycle où un ATP est hydrolysé (voir l'article pompe sodium-potassium pour les détails du cycle). On les appelle aussi pompes ioniques (voir l'article transporteur membranaire). On peut distinguer les ATPases de types P selon qu'elles transportent une seule ou bien deux espèces ioniques :
ATPase de type P Uniport
Les ATPase de type P Uniport sont conductrices pour un seul ion dans un seul sens.
- Les Ca2+-ATPases
par exemple transportent le calcium hors du cytoplasme, soit vers le milieu extracellulaire, soit vers des réticulum endoplasmique lisse spécialisés appelés calciosomes. Ils assurent une faible concentration de calcium intracellulaire ([Ca2+]i). Toute libération de calcium est en effet un signal cellulaire en soi, capable de provoquer des chaînes de réactions métaboliques. Le [Ca2+]i est un second messager.
- Chez les bactéries (notamment Escherichia coli), il existe également une K+-ATPase qui pompe le potassium vers l'intérieur de la cellule.
ATPase de type P Antiport
Les ATPase de type P Antiport conduisent dans des directions opposées deux espèces ioniques, toujours contre leur gradient de concentration respectif.
Sous certaines conditions expérimentales, les Ca2+-ATPases peuvent devenir ATP-synthétases, ce qui soutient la pertinence de rassembler toutes les ATPases dans la même famille d'enzymes.
ATPase de type V
Elles créent un gradient de protons en hydrolysant de l'ATP. Elles sont présentes chez les eucaryotes seulement, dans la membrane des vésicules d'exocytose et d'endocytose, dans celle des lysosomes, des endosomes et des vésicules de l'appareil de Golgi. On les trouve également dans les membranes de la vacuole des plantes et des levures. Elles maintiennent un pH acide dans cet organite. Il s'agit de complexes protéiques de 12 à 14 sous-unités: le complexe V0 forme le canal; le complexe V1 catalyse l'hydrolyse de l'ATP en ADP et phosphate inorganique. Il y a une homologie structurelle avec les ATPases de type F.
Notes et références
- (en) Bjørn P. Pedersen, Morten J. Buch-Pedersen, J. Preben Morth, Michael G. Palmgren et Poul Nissen, « Crystal structure of the plasma membrane proton pump », Nature, vol. 450, , p. 1111-1114 (lire en ligne) DOI:10.1038/nature06417