ATP citrate lyase
L’ATP citrate lyase est une acyltransférase importante de la biosynthèse des acides gras qui clive le citrate en oxaloacétate et acétyl-CoA avec hydrolyse concomitante d'une molécule d'ATP en ADP et Pi :
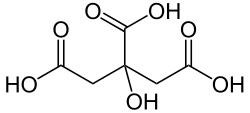
+ Coenzyme A + ATP ADP + Pi + 
+ 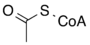
Citrate Oxaloacétate Acétyl-CoA
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Cette réaction correspond à la réciproque de la première étape du cycle de Krebs, catalysée par la citrate synthase, mais avec l'hydrolyse de l'ATP pour la rendre thermodynamiquement possible ; elle fait ainsi partie du cycle de Krebs inverse, utilisé par certains organismes pour la fixation du carbone.
Cette enzyme se trouve dans le cytosol des plantes et des animaux pour son rôle dans la lipogenèse.
Son gène est ACLY situé sur le chromosome 17 humain.
Cet enzyme intervient dans le métabolisme du cholestérol et son inhibition entraîne une baisse du taux du LDL cholestérol[1].
En médecine
Certains variants du gène entraînent une baisse de l'activité enzymatique, avec un taux de LDL cholestérol abaissé et un risque moindre de développer une maladie cardio-vasculaire[2].
Des molécules, inhibitrices de cet enzyme, sont en cours de test comme hypolipémiant[3]. Ainsi, l'acide bempédoïque permet une diminution de plus de 15 % du taux sanguin du LDL[4].
Notes et références
- (en) Pinkosky SL, Newton RS, Day EA, Lalwani ND et al., « Liver-specific ATP-citrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis », Nat Commun, vol. 7, , p. 13457. (PMID 27892461, PMCID PMC5133702, DOI 10.1038/ncomms13457, lire en ligne)
- (en) Ference BA, Ray KK, Catapano AL, Nichols SJ et al., « Mendelian randomization study of ACLY and cardiovascular disease », N Engl J Med, vol. 380, no 11, , p. 1033-42. (PMID 30865797, DOI 10.1056/nejmoa1806747, lire en ligne)
- (en) Ballantyne CM, Davidson MH, Macdougall DE, Newton RS et al., « Efficacy and safety of a novel dual modulator of adenosine triphosphate-citrate lyase and adenosine monophosphate-activated protein kinase in patients with hypercholesterolemia: results of a multicenter, randomized, double-blind, placebo-controlled, parallel-group trial », J Am Coll Cardiol, vol. 62, no 13, , p. 1154-62. (PMID 23770179, DOI 10.1016/j.jacc.2013.05.050, lire en ligne)
- (en) Ray KK, Bays HE, Catapano AL, Ballantyne CM , Clear Harmony Trial et al., « Safety and efficacy of bempedoic acid to reduce LDL cholesterol », N Engl J Med, vol. 380, no 11, , p. 1022-32. (PMID 30865796, DOI 10.1056/nejmoa1803917, lire en ligne)
- Portail de la biochimie
- Portail de la médecine