Érythème migrant
L'érythème migrant est l'une des manifestations externes, (présente dans 50 % des cas environ) mais non obligatoire[1] du début de la maladie de Lyme (autrefois aussi nommée « érythème chronique migrant de Lipschutz »). Il s'étend autour du point de piqûre par une tique, et est plus souvent (chez l'adulte surtout) situé sur la moitié basse du corps.
Ce symptôme est causé par une ou plusieurs (co-infections possibles) des bactéries spirochètes du genre Borrelia quand elles infectent l'Homme.
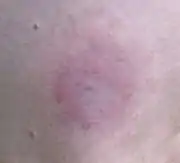

Le diagnostic de la maladie est facilité par l'érythème migrant, qui est cependant absent chez 20 % des patients [2]
De plus, il est souvent invisible sur la peau noire[3].
Description

L’érythème migrant apparaît de 3 à 32 jours après la morsure d'une tique et se manifeste par une tache rougeâtre qui grandit lentement autour du point de morsure de tique. Il prend ensuite parfois la forme d'un anneau ou d'une tache entourée d'un anneau, avec un possible stade primo-secondaire de début de diffusion systémique. il mesure de 1 à 2 cm (grandissant parfois ensuite jusqu'à plus de 10 cm de diamètre).
Quand l'infection n'est pas totalement asymptomatique, c'est le signe le plus classique et le plus précoce d'un début d'infection par des borrélies agents de la maladie de Lyme.
Histoire
En 1909, un dermatologue suédois (Afzelius) décrit médicalement une lésion cutanée qu’il nomme erythema chronicum migrans (ECM), consécutif à une morsure de tique[4].
En France, à partir de 1922, Garin et Bujadoux décrivent des troubles neurologiques faisant suite à un ECM[4].
En 1955, Binder prouve que cet érythème particulier est induit par un agent infectieux sensible à la pénicilline, et qu'il pense transmis par la tique Ixodes ricinus (on montrera plus tard que d'autres tiques sont également capables de transmettre des bactéries pouvant causer un ECM), mais il n'identifie pas l'agent microbien[4].
En 1982, le professeur américain Burgdorfer, zoologiste, parasitologiste et bactériologiste initialement formé à Bâle, a cultivé des spirochètes prélevés dans l'intestin de tiques collectées en zone d'endémie de la maladie de Lyme, et il les a inoculé à des lapins. 10 à 12 semaines après, ces lapins ont développé un érythème migrant, ce qui a été le premier indice fort d'un lien entre ce spirochète et la maladie de Lyme[5].
En 1983 des borrélies sont isolées dans le sang et la peau de victimes de la maladie de Lyme[6],[7].
La culture in vitro de ces spirochètes a ensuite permis des études bactériologiques plus fines, expérimentales, moléculaires et immunochimiques. Le spirochète fut en 1984 nommé Borrelia burgdorferi[8], et on a compris qu'il en existait différentes variétés et espèces de borrélies provoquant des symptômes différents.
Variations géographiques

En Europe où la maladie est plus souvent due à B. afzelii ou B. garinii, l'inflammation est à ce stade généralement moins intense qu'en Amérique du Nord, et la croissance (migration) de l'érythème y est souvent plus lente. De même, selon la littérature, les patients ont souvent moins de symptômes systémiques[9].
À ce stade, une période de quelques heures de fièvre (souvent discrète, mais exceptionnellement importante) apparaît parfois, plus rarement accompagnée de maux de tête, d'une raideur de la nuque, d'arthralgie, de myalgie ou fatigue, voire de symptômes neurologiques. Une arthralgie précoce peut apparaître après la piqûre avec des douleurs qui persistent de quelques heures à quelques jours sur une ou plusieurs articulations (dont souvent le genou).
Toutes les sortes de borrélies n'en produisent pas, et même pour les borrélies qui sont connues pour induire, tous les patients ne le développent pas, pour des raisons encore mal comprises ; Par exemple aux États-Unis, selon les CDC pour les cas observés sur 14 ans (de 1992 à 2006), seuls un peu plus de 65 % des patients atteints de la maladie de Lyme ont eu un érythème migrant. Et les 10-14 ans représentaient le plus faible pourcentage d'érythème migrant (58,2 % seulement en ont déclaré), mais inversement, ils représentaient le pourcentage le plus élevé d'arthrite (38,7 %). Chapot F. (2020)[source insuffisante] hypothèse, au vu de la haute prévalence de sérologies postives dans la population générale, que l'erythème migrant puisse ne se produire qu'en cas de rééxposition, par une réaction d'infiltration lymphoplasmocytaire dirigée par l'immunité spécifique. Ceci expliquerait le très faible taux d'erythème migrant chez les enfants et la quasi certitude d'une infection lors de l'apparition du pathognomonique erythème migrant, qui signerait au moins deux expositions.
Ceci explique que les symptômes diffèrent aussi selon les régions. En Europe où le nombre de borrélies est plus élevé qu'en Amérique du Nord, la manifestation initiale dermatologique de la borréliose de Lyme est aussi l'érythème migrant, qui est principalement causée par Borrelia afzelii, mais il n'est pas toujours présent. L'attaque du système nerveux est habituellement associée à une autre borrélie (Borrelia garinii[10]).
On a comparé les profils protéiques de B. afzelii et B. garinii respectivement isolées de la peau de patients ayant manifesté un érythème migrant, et de bactéries isolées dans le liquide céphalo-rachidien (LCR) de patients victimes d'une neuroborréliose de Lyme[10].
187 souches de Borrelia ont été trouvées (74 de B. afzelii et 113 de B. garinii)[10]. Les profils protéiques ont porté sur la flagelline et trois protéines de surface (A, B et C) de la bactérie. L'étude a montré une grande hétérogénéité dans le nombre, le taux et la masse moléculaire des protéines analysées, ce qui invite les auteurs à penser que les variations de synthèse des protéines de la surface externe de la bactérie pourraient jouer un rôle dans les patterns de dispersion de Borrelias, dans et entre les réservoirs animaux, et vers les tiques vectrices, ainsi que dans la pathogenèse de la borréliose de Lyme chez l'Homme [10].
Variation selon l'âge ?
Dans l'Est du Canada (Nouvelle-Ecosse) où la maladie de Lyme se développe, une étude (publiée en 2015) s'est basée sur l'analyse de tous les cas diagnostiqués de 2006 à 2013 chez des enfants (par une clinique de rhumatologie pédiatrique)[11]. Dans ce cas, 15 enfants (ou leur famille) sur 17 cas diagnostiqués sérologiquement n'avaient pas observé d'érythème migrant avant l'apparition de l'arthrite de Lyme[12] (et comme seuls 4 de ces enfants se souvenaient avoir été piqués par une tique, dans 63 % de ces cas diagnostiqués le médecin traitant n'a pas envisagé la maladie de Lyme avant qu'une sérologie la révèle[11]).
Nature de l'érythème migrant
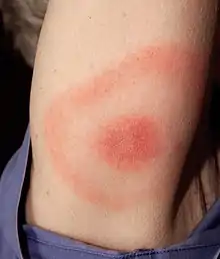
C'est une éruption inflammatoire cutanée (érythème). La tache rouge est parfois chaude (ce qui traduit l'inflammation), mais souvent indolore et non prurigineuse (pas de démangeaisons). Elle s'étend de façon centrifuge, en pouvant parfois migrer pour former un anneau, qui entoure la tache centrale qui reste centrée sur le point de la piqûre de la tique (d'où le nom érythème migrant ou EM) [13]. Souvent, la partie centrale reste rouge ou foncée et devient plus indurée. Son bord externe reste également rouge, mais plus rarement, la portion de peau située entre le centre et le bord retrouve une couleur normale (dans 9 % des cas). Parfois (notamment chez des personnes qui se font souvent piquer, et qui semblent développer des réactions allergiques), une nécrose centrale, ou une vésicule[14] apparaît à l'emplacement de la morsure, éventuellement accompagnée d'un prurit intense pouvant persister plusieurs semaines à plusieurs mois, voire plusieurs années si la maladie n'a pas été soignée précocement.
Dumas & al. ont signalé en 2015 un cas qui pourrait aider à expliquer la physiopathologie de la réponse inflammatoire cutanée lors d'une maladie de Lyme. Il s'agit d'une toxidermie induite 7 jours après le début d'un traitement antibiotique (à l'amoxicilline prescrit pour traiter la maladie de Lyme a épargné une plaque d’érythème chronique migrant de Lyme chez une patiente de 60 ans (sans antécédent ni allergie notable). Ce phénomène est dit phénomène de Renbök)[15]. Dans ce cas, la toxidermie se présentait comme un exanthème morbiliforme diffus quasi-érythrodermique[15].
Valeur pour le diagnostic
L'érythème migrant est la manifestation la plus connue et la plus sûre de la maladie de Lyme. Depuis 2012, en Allemagne notamment, l'érythème migrant est considéré comme « pathognomonique et ne nécessitant pas de recherches plus poussées »[16].
Cependant quand l'érythème migrant existe, il est fréquent que le patient n'ait pas eu conscience d'avoir été piqué par une tique. Ainsi sur 43 personnes de 12 communes contiguës du Connecticut ayant présenté un érythème migrant ou une arthrite de Lyme ou les deux, en été ou automne 1977, 9 seulement (21 %) se souvenaient d'avoir été mordues par une tique au point de lésion initiale (3 à 20 jours avant les symptômes, 12 jours en moyenne), et un seul patient avait pu identifier la tique (qui était Ixodes scapularis)[17].
Parce que l'érythème n'apparait pas toujours, la maladie de Lyme a peut-être été sous-diagnostiquée ; en effet ses autres symptômes ne sont pas spécifiques et varient selon les individus, les bactéries parasites et peut-être les co-infections ; ils peuvent donc facilement être confondus avec ceux d'autres maladies. Dans certains cas l'érythème lui-même est discret (dans les cheveux parfois) et non douloureux, pouvant passer inaperçu.
Curieusement, lors des recherches d'anticorps ciblant Borrelia burgdorferi, l'érythème migrant a été associé à des taux très variables de séropositivité[18]. Les outils de dosages sérologiques visant à détecter ces anticorps sont plus ou moins sensibles, mais ceci ne suffit pas à expliquer ces variations. Une étude (2008) a utilisé 3 tests sérologiques différents appliqués à des sérums venant de 175 patients (en phase aiguë) non traités, mais avec un érythème migrant confirmé par culture[18]. Elle visait à explorer les effets de quatre variables cliniques sur la séropositivité[18] :
- durée de l'érythème migrant ;
- présence de lésions cutanées uniques ou multiples ;
- sexe du patient ;
- âge du patient.
Conclusions : quel que soit le test sérologique utilisé, le taux de séropositivité augmentait avec la durée de l'érythème migrant chez les patients présentant des lésions uniques, mais pas chez les patients présentant des lésions cutanées multiples. Mais ni le sexe, ni l'âge du patient, n'influençaient les taux de séropositivité. La durée et le nombre de lésions cutanées ont donc un impact profond sur les taux de séropositivité, quel que soit le test sérologique, pour des raisons encore à élucider[18].
Facteurs influençant l'aspect clinique de l'érythème migrant
Ils ont été étudiés, notamment dans le sud de la Suède (de à sur un groupe de 118 patients de 18 ans (54 femmes, soit 45,8 % du lot et 64 hommes, soit 54,2 %), ayant tous développé un érythème migrant. N'ont été retenus dans ce panel que les patients pour lesquels une PCR (réaction en chaîne par polymérase) a bien confirmé une borréliose de Lyme (4 % étaient infectés par Borrelia afzelii et 26 % par Borrelia garinii (p <0,001)). Toutes les lésions ont été photographiées, et classées comme « annulaires » ou « non annulaires ».
Un modèle de régression logistique a été utilisé pour étudier les relations entre le type d'érythème migrant (c'est-à-dire annulaire ou non-annulaire) et les facteurs qui pourraient expliquer ou influencer l'aspect clinique de l'érythème.
- 45 % des érythèmes (soit 38 sur 85) étaient annulaires ;
- 46 % (39 sur 85) étaient non-annulaires ;
- 9,4 % (8 sur 85) ont été classés atypiques.
L'étude a montré que :
- le sexe des patients infectés par B. afzelii a une forte influence sur l'apparition de l’érythème ;
- B. garinii provoque plus souvent un érythème migrant non-annulaire, souvent accompagné une infection plus virulente et avec plus de patients présentant de la fièvre, avec des taux élevés de protéine C-réactive et une séropositivité marquée dans le sérum de convalescence[19].
Voir aussi
Articles connexes
Liens externes
- Tiquatac, Informations sur les tiques et la maladie de Lyme, avec Liste des 46 symptômes plus fréquents (pouvant orienter le médecin quand un patient en présente au moins 15 sur les 46).
- Lymeinfo, Informations la maladie de Lyme
Bibliographie
- Smith RP, Schoen RT, Rahn DW, et al. (2002) Clinical characteristics and treatment outcome of early Lyme disease in patients with microbiologically confirmed erythema migrans. Ann Intern Med ;136:421-8.
Références
- Steere, AC, Sikand, VJ, Schoen, RT, Nowakowski, J. Asymptomatic infection with Borrelia burgdorferi. Clin. Infect. Dis. 2003. 37:528-532.
- (de)Baumann D, Pusterla N, Peter O, Grimm F, Fournier PE, Schar G et al. Fieber nach Zeckenstich: Klinik und Diagnostik von akuten Zeckenstich-assoziierten Infektionskrankheiten in der Nordostschweiz. Dtsch Med Wochenschr. 2003; 128 (19) : 1042-7. Texte complet et résumé.
- Weinstein A, Britchkov M (2002), “Lyme arthritis and post-Lyme disease syndrome” ;. Curr Opin Rheumatol. 2002 Jul; 14(4):383-7 (résumé)
- Lamouraux, Cécile (2005), La borréliose de Lyme chez le cheval, thèse de doctorat vétérinaire soutenue à la faculté de médecine de Créteil ; École nationale vétérinaire d'Alfort
- (en) Burgdorfer W, Barbour AG, Hayez SF. et al. « Lyme disease - A tick-borne spirochetosis? » Science 1982;216:1317-1319.
- Benach JL, Bosler EM, Hanrahan JP, et al. Spirochetes isolated from the blood of two patients with Lyme disease. N Engl J Med 1983;308:740--2.
- Steere AC, Grodzicki RL, Kornblatt AN, et al. The spirochetal etiology of Lyme disease. N Engl J Med 1983;308:733-40
- Johnson, R. C., F. W. Hyde, G. P. Schmid, and D. J. Brenner. 1984. Borrelia burgdorferi sp. nov.: etiological agent of Lyme disease. Int J Syst Bacteriol 34:496-497.
- (en)Strle F, Nadelman RB, Cimperman J, Nowakowski J, Picken RN, Schwartz I, et al. Comparison of culture-confirmed erythema migrans caused by Borrelia burgdorferi sensu stricto in New York State and by Borrelia afzelii in Slovenia. Ann Intern Med. 1999;130:32-6.
- Urška Glinšek, Tina Udovič, Tjaša Cerar, Franc Strle and Eva Ružić-Sabljić (2009); Protein profile determination of Borrelia afzelii and Borrelia garinii isolated from skin and cerebrospinal fluid ; World Journal of Microbiology and Biotechnology Volume 25, Number 7, 1287-1296, DOI: 10.1007/s11274-009-0015-5
- Glaude, Pier Diane, Adam M Huber, Timothy Mailman, Suzanne Ramsey, Bianca Lang, and Elizabeth Stringer. (2015). "Clinical characteristics, treatment and outcome of children with Lyme arthritis in Nova Scotia." Paediatrics & Child Health (1205-7088) 20, no. 7: 377-380. Academic Search Complete, EBSCOhost (accessed December 13, 2015).(résumé)
- Ogden NH, Lindsay LR, Morshed M, Sockett PN, Artsob H. (2009) The emergence of Lyme disease in Canada. CMAJ ;180:1221-4
- Fauci, Anthony S. (2008). Harrison's Principles of Internal Medicine: Editors, Anthony S. Fauci ... [Et Al.]. McGraw-Hill Medical Publishing. chapitre 166 (ISBN 0-07-159991-6).
- Smith RP, Schoen RT, Rahn DW, Sikand VK, Nowakowski J, Parenti DL, Holman MS, Persing DH, Steere AC (March 2002) ; Clinical characteristics and treatment outcome of early Lyme disease in patients with microbiologically confirmed erythema migrans; Ann. Intern. Med. 136 (6): 421–428. (voir notamment la Fig 3)
- Dumas, M., Begon, E., & Blum, L. (2015, December). Une toxidermie à l’amoxicilline épargnant une plaque d’érythème chronique migrant de Lyme: phénomène de Renbok. In Annales de Dermatologie et de Vénéréologie (Vol. 142, No. 12, pp. S613-S614). Elsevier Masson (résumé).
- Huppertz HI, Bartmann P, Heininger U, Fingerle V, Kinet M, Klein R, Korenke GC, Nentwich HJ., Rational diagnostic strategies for Lyme borreliosis in children and adolescents: recommendations by the Committee for Infectious Diseases and Vaccinations of the German Academy for Pediatrics and Adolescent Health. ; Eur J Pediatr. 2012 Jul 11; (résumé)
- Steere AC, Broderick TF, Malawista SE. Erythema chronicum migrans and Lyme arthritis: epidemiologic evidence for a tick vector. Am J Epidemiol. 1978 Oct; 108 (4): 312-321 (Résumé)
- (en) Gary P. Wormser, John Nowakowski, Robert B. Nadelman et Paul Visintainer, « Impact of Clinical Variables on Borrelia burgdorferi-Specific Antibody Seropositivity in Acute-Phase Sera from Patients in North America with Culture-Confirmed Early Lyme Disease », Clinical and Vaccine Immunology, vol. 15, no 10, , p. 1519–1522 (ISSN 1556-6811 et 1556-679X, PMID 18716009, PMCID PMC2565926, DOI 10.1128/CVI.00109-08, lire en ligne, consulté le )
- Louise Bennet, Carl-Johan Fraenkel, Ulf Garpmo, Anders Halling, Mikael Ingman, Katharina Ornstein, Louise Stjernberg and Johan Berglund ; Clinical appearance of erythema migrans caused by Borrelia afzelii and Borrelia garinii – effect of the patient's sex ; Wiener Klinische Wochenschrift Volume 118, Numbers 17-18, 531-537, DOI: 10.1007/s00508-006-0659-1 (Résumé)
- Portail de la médecine