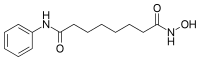
Vorinostat
Le Vorinostat commercialisé sous le nom de Zolinza est un inhibiteur d'histone désacétylase (HDAC) utilisé dans le traitement des lymphomes cutanés à cellules T.
| Vorinostat | |
 | |
| Identification | |
|---|---|
| Nom UICPA | N-hydroxy-N'-phényl-octanediamide |
| Synonymes |
Zolinza |
| No CAS | |
| No ECHA | 100.207.822 |
| Code ATC | L01 |
| DrugBank | DB02546 |
| PubChem | 5311 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C14H20N2O3 [Isomères] |
| Masse molaire[1] | 264,3202 ± 0,0139 g/mol C 63,62 %, H 7,63 %, N 10,6 %, O 18,16 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
En France, il bénéficie d'une autorisation temporaire d'utilisation nominative (ATUn) depuis 2007 et est commercialisé par la firme Merck Sharp & Dohme - Chibret[2].
Le vorinostat est également en essais cliniques afin d'éradiquer le virus du SIDA chez des patients séropositifs.
Indication
Le vorinostat a été le premier inhibiteur d'histone désacétylase approuvé aux États-Unis par la FDA en octobre 2006 pour le traitement des lymphomes cutanés à cellules T.
En France, il est indiqué comme traitement des lymphomes cutanés à cellules T qui persistent, progressent ou récidivent après deux traitements systémiques.
Histoire
À New-York, en 1971, Charlotte Friend découvre par hasard qu'un solvant organique largement utilisé, le diméthylsulfoxyde (DMSO), induit la différenciation d'érythrocytes leucémiques provoquant la réversion du phénotype cancéreux[3],[4]. Afin de comprendre le mécanisme d'action du DMSO, une collaboration entre d'un côté les biologistes Paul A Marks et Richard Rifkind basés au Memorial Sloan-Kettering Cancer Center et de l'autre le chimiste Ronald Breslow de l'Université Columbia a permis d'établir en 1975 que la polarité du DMSO est responsable de son action différenciante[5]. Par ailleurs, il a été montré que des petites molécules telles que des amides avaient une action plus forte que le DMSO bien que modeste. Il a ainsi été décidé de lier 2 groupes amide ce qui aboutit à l'hexaméthylène bisacétamide (HMBA)[6]. Des études in vitro ont confirmé l'action de ce composé comme inducteur de la différenciation et après des études chez le rongeur et le chien, des essais cliniques chez l'homme ont montré un effet mineur sur le syndrome myélodysplasique et la leucémie aiguë myéloïde[7],[8],[9],[10].
Au cours des années 1990, une seconde génération de composés a été développée afin d'aboutir à l'acide subéroylanilide hydroxamique (SAHA) ou vorinostat présentant une action 6 fois plus puissante que l'HMBA[11],[4]. Par la suite, Victoria Richon, membre associé du laboratoire ayant pris connaissance du travail d'un groupe de l'université de Tokyo concernant le mécanisme d'action de la trichostatine A, un composé chimiquement proche du vorinostat, a émis l'hypothèse que ce dernier serait un inhibiteur d'histone désacétylase[12]. Cette hypothèse a été validée en 1998 et la liaison du vorinostat à une histone désacétylase révélée par cristallographique aux rayons X[13],[14].
En 2001, une société montée par Paul A Marks, Richard Rifkind, Ronald Breslow et Victoria Richon, dénommée Aton Pharma basée à Tarrytown, NY a été créée afin de développer le vorinostat . Après un essai clinique de phase II concluant chez des patients atteints de lymphome cutané à cellules T, le laboratoire Merck rachète la société en avril 2004. La firme engage alors une étude de phase IIb qui se révèle positive et dont les résultats sont présentés en 2006 au congrès de l'ASCO puis publiés en 2007[15],[16]. Entre-temps, la FDA a approuvé le 6 octobre 2006 le vorinostat comme médicament indiqué dans le traitement des lymphomes cutanés à cellules T.
Depuis la fin des années 2000, des scientifiques américains ont montré que le vorinostat réactivait l'expression du virus du SIDA et permettait à terme d'éradiquer le réservoir de virus [17],[18].
Mode d'action
Il a été montré que le vorinostat se lie sur les sites actifs des histones désacétylases et qu'il agissait comme chélatant des ions zinc présents dans ces sites actifs[19].
Le vorinostat inhibe les HDAC de classe I et II pour une concentration d'environ 50 nM[20]. Les HDAC de classe I étant principalement nucléaires et ubiquitaires et celles de classe II plus spécifiques de certains tissus et faisant la navette entre le noyau et le cytoplasme.
Il empêche la croissance de cellules transformée pour des concentrations de 2,5 à 5 µM. L'inhibition des histones désacétylases par le vorinostat a pour conséquences l'accumulation d'histones acétylées et de protéines acétylées, notamment des facteurs de transcriptions cruciaux impliqués dans les mécanismes de différenciation cellulaire.
Essais Cliniques
Lymphomes T cutanés
Phase II-a
Le vorinostat a été testé chez des patients présentant des lymphomes cutanés à cellules T (CTCL).
Phase II-b
[15],[16]
Patients séropositifs pour le VIH
Effets indésirables
Les effets indésirables les plus fréquemment rapportés sont : fatigue, diarrhées, nausées, thrombocytopénie, dysgueusie, bouche sèche, perte de poids, vomissement et anorexie.
Bibliographie
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « ATU nominative - Liste des spécialités autorisées - ANSM : Agence nationale de sécurité du médicament et des produits de santé », sur ansm.sante.fr (consulté le 27 décembre 2017)
- Charlotte Friend, William Scher, J. G. Holland et Toru Sato, « Hemoglobin Synthesis in Murine Virus-Induced Leukemic Cells In Vitro: Stimulation of Erythroid Differentiation by Dimethyl Sulfoxide », Proceedings of the National Academy of Sciences of the United States of America, vol. 68, no 2, , p. 378–382 (ISSN 0027-8424, PMID 5277089, lire en ligne)
- Paul A. Marks et Ronald Breslow, « Dimethyl sulfoxide to vorinostat: development of this histone deacetylase inhibitor as an anticancer drug », Nature Biotechnology, vol. 25, no 1, , p. 84–90 (ISSN 1087-0156, PMID 17211407, DOI 10.1038/nbt1272, lire en ligne)
- M. Tanaka, J. Levy, M. Terada et R. Breslow, « Induction of erythroid differentiation in murine virus infected eythroleukemia cells by highly polar compounds », Proceedings of the National Academy of Sciences of the United States of America, vol. 72, no 3, , p. 1003–1006 (ISSN 0027-8424, PMID 165480, lire en ligne)
- R C Reuben, R L Wife, R Breslow et R A Rifkind, « A new group of potent inducers of differentiation in murine erythroleukemia cells. », Proceedings of the National Academy of Sciences of the United States of America, vol. 73, no 3, , p. 862–866 (ISSN 0027-8424, PMID 1062798, lire en ligne)
- V. M. Richon, R. G. Ramsay, R. A. Rifkind et P. A. Marks, « Modulation of the c-myb, c-myc and p53 mRNA and protein levels during induced murine erythroleukemia cell differentiation », Oncogene, vol. 4, no 2, , p. 165–173 (ISSN 0950-9232, PMID 2648254, lire en ligne)
- P. A. Marks, M. Sheffery et R. A. Rifkind, « Induction of transformed cells to terminal differentiation and the modulation of gene expression », Cancer Research, vol. 47, no 3, , p. 659–666 (ISSN 0008-5472, PMID 3542191, lire en ligne)
- P. A. Marks et R. A. Rifkind, « Erythroleukemic differentiation », Annual Review of Biochemistry, vol. 47, , p. 419–448 (ISSN 0066-4154, PMID 354501, DOI 10.1146/annurev.bi.47.070178.002223, lire en ligne)
- M. Andreeff, R. Stone, J. Michaeli et C. W. Young, « Hexamethylene bisacetamide in myelodysplastic syndrome and acute myelogenous leukemia: a phase II clinical trial with a differentiation-inducing agent », Blood, vol. 80, no 10, , p. 2604–2609 (ISSN 0006-4971, PMID 1421378, lire en ligne)
- V. M. Richon, Y. Webb, R. Merger et T. Sheppard, « Second generation hybrid polar compounds are potent inducers of transformed cell differentiation », Proceedings of the National Academy of Sciences of the United States of America, vol. 93, no 12, , p. 5705–5708 (ISSN 0027-8424, PMID 8650156, lire en ligne)
- M. Yoshida, M. Kijima, M. Akita et T. Beppu, « Potent and specific inhibition of mammalian histone deacetylase both in vivo and in vitro by trichostatin A », The Journal of Biological Chemistry, vol. 265, no 28, , p. 17174–17179 (ISSN 0021-9258, PMID 2211619, lire en ligne)
- V. M. Richon, S. Emiliani, E. Verdin et Y. Webb, « A class of hybrid polar inducers of transformed cell differentiation inhibits histone deacetylases », Proceedings of the National Academy of Sciences of the United States of America, vol. 95, no 6, , p. 3003–3007 (ISSN 0027-8424, PMID 9501205, lire en ligne)
- M. S. Finnin, J. R. Donigian, A. Cohen et V. M. Richon, « Structures of a histone deacetylase homologue bound to the TSA and SAHA inhibitors », Nature, vol. 401, no 6749, , p. 188–193 (ISSN 0028-0836, PMID 10490031, DOI 10.1038/43710, lire en ligne)
- E. Olsen, Y. H. Kim, T. Kuzel et T. R. Pacheco, « Vorinostat (suberoylanilide hydroxamic acid, SAHA) is clinically active in advanced cutaneous T-cell lymphoma (CTCL): Results of a phase IIb trial », Journal of Clinical Oncology, vol. 24, no 18_suppl, , p. 7500–7500 (ISSN 0732-183X, DOI 10.1200/jco.2006.24.18_suppl.7500, lire en ligne)
- Madeleine Duvic, Rakshandra Talpur, Xiao Ni et Chunlei Zhang, « Phase 2 trial of oral vorinostat (suberoylanilide hydroxamic acid, SAHA) for refractory cutaneous T-cell lymphoma (CTCL) », Blood, vol. 109, no 1, , p. 31–39 (ISSN 0006-4971, PMID 16960145, PMCID PMC1785068, DOI 10.1182/blood-2006-06-025999, lire en ligne)
- Nancie M. Archin, Amy Espeseth, Daniel Parker et Manzoor Cheema, « Expression of latent HIV induced by the potent HDAC inhibitor suberoylanilide hydroxamic acid », AIDS research and human retroviruses, vol. 25, no 2, , p. 207–212 (ISSN 1931-8405, PMID 19239360, PMCID PMC2853863, DOI 10.1089/aid.2008.0191, lire en ligne)
- N. M. Archin, A. L. Liberty, A. D. Kashuba et S. K. Choudhary, « Administration of vorinostat disrupts HIV-1 latency in patients on antiretroviral therapy », Nature, vol. 487, no 7408, , p. 482–485 (ISSN 1476-4687, PMID 22837004, PMCID PMC3704185, DOI 10.1038/nature11286, lire en ligne)
- (en) V. M. Richon, « Cancer biology: mechanism of antitumour action of vorinostat (suberoylanilide hydroxamic acid), a novel histone deacetylase inhibitor », British Journal of Cancer, vol. 95, , S2–S6 (ISSN 0007-0920, DOI 10.1038/sj.bjc.6603463, lire en ligne)
- Oscar Moradei, Christiane R. Maroun, Isabelle Paquin et Arkadii Vaisburg, « Histone deacetylase inhibitors: latest developments, trends and prospects », Current Medicinal Chemistry. Anti-Cancer Agents, vol. 5, no 5, , p. 529–560 (ISSN 1568-0118, PMID 16178777, lire en ligne)
- Portail de la pharmacie
- Portail de la chimie
- Portail de la médecine