Rythme circadien bactérien
Les rythmes circadiens bactériens, comme d'autres rythmes circadiens sont endogènes.
Récemment découverts, ils constituent une des manifestations de ce qu'on appelle horloge circadienne ou horloge biologique ou horloge interne.
Importance biologique
La coordination et l'optimisation temporelle des processus biologiques et l'adaptation aux fluctuations quotidiennes jouent un rôle important dans la survie de la plupart des organismes ;
Jusqu'au milieu des années 1980, on pensait que seules les cellules d'eucaryotes bénéficiaient d'un rythme circadien endogène, mais on a depuis démontré que les cyanobactéries (bactéries photosynthétique du phylum des Eubacteria étaient également dotées d'un système de rythme biologique endogène répondant aux trois critères du rythme circadien (voir ci dessous).
Chez ces bactéries, trois protéines-clés dont les structures sont maintenant connues peuvent former l'équivalent d'une horloge moléculaire contrôlant ou orchestrant l'expression globale des gènes et qui peut – même in vitro (à condition de disposer d'ATP) – se comporter comme un « oscillateur ».
Ce système permet à ces bactéries de mieux s'accorder aux grands rythmes environnementaux qui caractérisent les écosystèmes exposés aux cycles jour/nuit.
Définition
Pour le biologiste, un « vrai » rythme circadien doit - dans les limites normales de l'environnement naturel de l'organisme) présenter trois caractéristiques :
- Osciller avec une périodicité constante (proche de 24 heures, mais pas tout à fait de 24 h) dans des conditions environnementales constantes (température constante, lumière artificielle constante, ou obscurité totale constante).
Chez l'homme et d'autres espèces placées durant un temps long – plusieurs dizaines de jour par exemple – en condition d'isolement sensoriel (c'est-à-dire par exemple pour l'Homme : seul, sans communication et sans moyen de savoir l'heure ou le jour qu'il est), on peut néanmoins observer une dérive de ce rythme endogène, avec une période qui tend à s'allonger ; - En cas de variation de température, un mécanisme de compensation réajuste ce rythme (même chez les bactéries cyanophycées), malgré d'importantes variations de métabolisme des cellules ou de l'individu ;
- Ce rythme va permettre une synchronisation avec des cycles environnementaux particuliers (saisons par exemple, via des stimuli que sont les variations de lumière, température, durée du jour et photopériodisme, etc.).
Histoire de la découverte et compréhension de ces rythmes
Les procaryotes sont-ils capables de rythmicité circadienne ? Avant le milieu des années 1980s, cela semblait peu probable[1], notamment parce qu'on ne voyait pas en quoi un rythme endogène et en particulier un périodisme de 12 ou 24 h serait utile à des espèces apparemment aussi « simples » et primitives, d'autant qu'en condition idéales, elles sont capables de se reproduire plusieurs fois par jour. Autrement dit : « Pourquoi disposer d'une horloge interne indiquant un temps et un cycle plus longue que son cycle de vie? » Cette question n'a en réalité pas de sens, car ces bactéries sont unicellulaires et se reproduisent essentiellement par simple division et non via une reproduction sexuée ;
En fait, une grande population bactérienne peut être comparée à un protoplasme en croissance, voire parfois considérée comme un « super-organisme » ; dans cette perspective, un programme temporel de 12 ou 24 heures pourrait effectivement améliorer l'adaptation de ces bactéries à un environnement rythmé par les alternances jour/nuit et par des changements de température et d'intensité de la lumière. Ces derniers sont en effet particulièrement importants pour les bactéries photosynthétiques.
En 1985-86, plusieurs équipes scientifiques ont découvert chez des cyanobactéries des rythmes quotidiens de fixation de l'azote, invariants en condition de lumière permanente, ou d'obscurité constante.
Huang et ses collègues ont été les premiers à démontrer chez les cyanobactéries Synechococcus sp. RF-1 (bactérie vivant en eau douce) des rythmes circadiens. Dans des articles publiés à partir de 1986, les trois principales caractéristiques des rythmes circadiens ont été décrites dans un même organisme[2],[3]. Une autre étude fondatrice est celle de Sweeney et Borgese[4]. cette équipe a aussi été la première à démontrer la compensation par la température d'un rythme quotidien chez la cyanobactérie marine, Synechococcus WH7803.
À cette époque, seuls deux gènes « circadiens » avaient pu être caractérisés ; le premier était responsable d'une période chez la drosophiles et le second était responsable d'une fréquence chez Neurospora crassa. Un autre gène fut identifié un an après chez la mouche, plusieurs années avant qu'un premier gène soit découvert chez un mammifère. Dans les années 1980, on pouvait encore penser que toutes les formes de vie utilisaient le même mécanisme d'horloge interne, comme toutes les espèces connues utilisent l'ATP pour le stockage d'énergie et l'ADN pour le stockage d'une grande partie de l'information génétique. En fait, il n'en est rien, et l'évolution, au sein de chaque règne, semble avoir développé des solutions différentes.
Au début des années 1990, on a génétiquement modifié une souche de la cyanobactérie Synechococcus elongatus en lui insérant d'un gène de luciférase. Ce gène a permis de suivre temporellement et quantitativement, avec une grande précision, et de manière « non-invasive », l'expression des «gènes du rythme» (qui en l'occurrence faisaient rythmiquement «briller» les cellules quand il s'y exprimaient[5],[6]).
Ce système a permis de mesurer les rythmes biologiques de populations entières[5], ou de cyanobactéries isolées[7].
Les rythmes de la luminescence exprimés par ces bactéries S. elongatus génétiquement modifiées répondaient bien aux trois critères essentiels des rythmes circadiens : la persistance d'une oscillation de 24 heures (en conditions constantes), la compensation de température, et un effet chronobiologique.
L'étude en laboratoire de diverses espèces de Synechococcus a fermement établi que les bactéries procaryotes étaient capables de rythmicité circadienne, contrairement au dogme qui voulaient que seuls les eucaryotes en soient dotés. De plus, les cellules d'une souche de cyanobactéries conservent leur rythme de manière stable sur plusieurs générations, même sous une faible lumière constante[8]. Cependant, des preuves convaincantes de l'existence de « programmes » circadien similaires et innés chez les bactéries autres que les cyanobactéries font encore défaut ; Il est possible que seules des bactéries photosynthétiques aient développé cette compétence en raison de leur dépendance (pour la photosynthèse) à la lumière. Néanmoins des gènes jouant des fonctions proches pourraient peut-être exister chez d'autres groupes de microbes et bactéries.
Relations avec la division cellulaire
Malgré les affirmations prédictives voulant que l'horloge circadienne ne serait pas exprimée par des cellules qui se dédoublent plus souvent qu'une fois par 24 heures[9], des chronicités sont maintenues chez des cyanobactéries élevées dans de bonnes conditions en cultures se développant assez vite pour doubler toutes les 5-6 heures[10],[11],[12].
Ces bactéries sont même apparemment capables de tenir compte simultanément et avec précision de deux processus de synchronisation calés sur des périodes très différentes.
Signification adaptative
Une question importante était de savoir si ce « chronomètre endogène » circadien peut améliorer la fitness d'organismes croissant dans des conditions naturelles ?
On estime généralement que les horloges circadiennes peuvent améliorer l'aptitude d'organismes à s'adapter à l'environnement par l'amélioration de leur capacité à s'adapter à des facteurs environnementaux majeurs tels que les cycles jour-nuit. En réalité il ne semblait pas y avoir eu de tests rigoureux permettant d'étayer cette hypothèse (pour ce type d'organisme en particulier).
Dans les années 2000, on a cherché à tester une éventuelle valeur adaptative des cyanobactéries munies des horloges endogènes les plus précises. Une expérience a consisté à cultiver un mélange de différentes souches de cyanobactéries caractérisées par des propriétés circadiennes différentes (certaines présentaient une forte rythmicité et d'autres une arhythmicité, les périodes du rythme variaient également…). Ce mélange a été cultivé dans un environnement permettant la concurrence des différentes souches entre elles, dans des conditions environnementales différentes.
L'idée était de voir si les bactéries disposant d'une horloge circadienne fonctionnelle étaient favorisées.
Le résultat fut que les souches possédant une horloge biologique fonctionnelle ont effectivement concurrencé les souches « arythmique », mais uniquement dans des environnements caractérisés par un éclairage rythmé (par exemple culture éclairée durant 12 h puis maintenue dans le noir 12h et ainsi de suite).
Inversement ; dans un environnement « constant » (par exemple milieu de culture maintenu sous une lumière artificielle ininterrompue), les souches rythmiques et arythmique se sont reproduites à un rythme comparable[13]
De même, au sein du groupe des souches présentant un rythme chronobiologique, mais avec des périodes différentes, celles dont la « période » endogène correspondait le mieux à la période du cycle de l'éclairage supplantaient les souches dont la durée ne correspond pas à celle de cet environnement[14]. Par conséquent, dans des environnements fortement « rythmés » tels que ceux soumis aux cycles solaire et lunaire, l'aptitude à survivre des cyanobactéries semble réellement améliorée quand leur horloge interne est active et plus encore quand leur période circadienne est similaire à celle du cycle de l'environnement. Cette expérience fut l'une des premières à apporter la preuve d'une avantage sélectif conféré à une espèce par une horloge interne circadienne, même pour des organismes à croissance rapide se divisant plus d'une fois par jour.
Régulation globale de l'expression des gènes et topologie chromosomique
Chez les eucaryotes, 10 à 20 % des gènes sont activés de manière rythmique (comme le montrent les variations cycliques de l'abondance des ARNm). Toutefois, chez les cyanobactéries, une part bien plus élevé des gènes est contrôlé par l'horloge circadienne bactérienne.
- Par exemple, l'activité de presque tous les promoteurs est rythmique[15]. Le mécanisme par lequel cette régulation génique globale est mécaniquement liée à l'horloge circadienne reste inconnu, mais il pourrait être liée à des changements rythmiques de la topologie du chromosome entier de la cyanobactérie[16],[17]
Mécanismes moléculaires de l'horloge interne des cyanobactéries
Les bactéries S. elongatus génétiquement modifiées par ajout d'un gène luciférase ont été utilisés pour rechercher des mutations du ou des gènes responsables de l'horloge interne, dont beaucoup semblent avoir été isolés[18]. À la fin des années 1990, l'étude de souches mutantes a permis d'identifier un groupe de trois gènes, dénommés kaiA, kaiB and kaiC[19] ; “kai” signifiant « rotation » ou « cycle de nombre » en japonais. Ces gènes codent les protéines Kaia, käib, et Kaic, qui se sont montrés essentiels à la fonction « horloge interne » de S. elongatus. Ils constituent le cœur de l'oscillateur circadien bactérien.
Aucune similarité significative n'a été constatée entre ces gènes kai et tout autre gène déjà identifié chez des eucaryotes, mais il existe des homologues potentiels dans les séquences génomiques d'autres bactéries (tant chez des eubactéries que chez des Archaea).
On a d'abord cru que le mécanisme de l'horlogerie interne des cyanobactéries était une boucle de rétroaction de type transcription et une traduction où les protéines de l'horloge autorégulaient l'activité de leurs propres promoteurs via un procédé similaire (du point de vue des concepts) au système responsable des horloges circadiennes des eucaryotes[20],[21].
Plus tard, plusieurs faisceaux d'indices laissaient penser que la transcription et la traduction n'étaient pas nécessaires pour que les rythmes circadiens des protéines Kai s'expriment[22],[23],[24]. L'indice le plus spectaculaire est que les trois protéines « Kai » purifiées peuvent reconstituer une oscillation circadienne compensée en température dans un tube à essai[25],[26].
Le rythme qui est observable et qui peut être mesuré in vitro est celui de l'état de phosphorylation de la protéine dite KaiC. Il s'agit du premier (et jusqu'ici du seul) exemple de reconstitution in vitro d'une horloge circadienne[25].
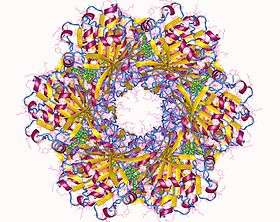
Visualisation des engrenages de l'horloge interne bactérienne (biologie structurale des protéines)
À ce jour, le système circadien de cyanobactéries est unique en ce qu'il est le seul système circadien dans lequel la structure protéique en cause est connue et reproductible. Les structures de chacune des trois protéines « Kai » (signifiant cycle en japonais) de Synechococcus elongatus ont été déterminés par analyse cristallographique et analyse des souches mutées.
- KaiA présente deux formes dimères où les domaines N-terminaux sont échangés avec les domaines C-terminaux[29],[30].
- KaiB a bien cristallisée avec succès à partir de trois espèces différentes de cyanobactéries et des formes dimères ou tétramères[31],[32].
- KaiC forme un hexamère qui ressemble à un beignet double avec un pore central partiellement fermé à une extrémité[33]. Il y a douze site ligants (ponts chimiques) pour l'ATP - dans KaiC.
Les résidus qui sont phosphorylées au cours de la phosphorylation en jeu lors de l'apparition d'un rythme in vitro ont été identifiés[34],[35]. Il est encore mal compris (Les systèmes biologiques primaires sont théoriquement intrinsèquement stochastiques, mais l'oscillation de 24 h donnée par 3 protéines semble ici capable d'être régulé et régulier dans la durée ; et le mécanisme moléculaire compensant les effets de la température est encore inconnu. Une équipe a pu en 2007, à partir de modélisations in silico et de vérification en laboratoire d'apporter de premières réponses[36].
La connaissance de ces structures tridimensionnelles a néanmoins été utile pour élucider le mécanisme basique de l'horloge cyanobactérienne, en fournissant des modèles concrets de la façon dont les trois protéines Kai (A, B et C) pouvaient interagir et s'influencer mutuellement[33],[30],[31],[37],[38],[39],[40].
Une approche structurale a également permis au complexe protéique KaiA / Kaib / Kaic d'être compris et visualisé comme une fonction du temps, ce qui a permis une modélisation mathématique sophistiquée du rythme de la phosphorylation in vitro[41],[42].
Les composants de l'horloge interne des cyanobactéries et leurs interactions peuvent donc maintenant être visualisés en quatre dimensions (trois dans l'espace, l'autre représentant le temps), ce qui pourrait peut être aussi ouvrir des perspectives pour les ordinateurs biologiques ou une compréhension affinée des perturbations discrètes de l'éclairage artificiel dans le phénomène dit « pollution lumineuse ».
Prospective
Depuis la fin des années 1990, la connaissance des composants de l'horloge interne de quelques espèces bactériennes photosynthétique (cyanobactéries) et la compréhension et modélisation de leurs interactions a beaucoup progressé. Chez une des bactéries étudiées, ces mécanismes peuvent maintenant être visualisés en quatre dimensions (trois dans l'espace, l'autre représentant le temps)[41], ce qui pourrait peut être aussi ouvrir des perspectives nouvelles, par exemple :
- pour les ordinateurs biologiques ou d'autres systèmes biologiques nécessitant un rythme interne auto-entretenu ou capable de s'accorder avec les rythmes jour/nuit.
- pour explorer des perturbations discrètes et encore non-comprises de l'éclairage artificiel dans le phénomène dit « pollution lumineuse » ;
- pour mieux comprendre certains symptômes « rythmés » de maladies bactériennes...
Notes et références
- Johnson, C.H., S.S. Golden, M. Ishiura, and T. Kondo (1996) Circadian clocks in prokaryotes. Mole. Microbiol. 21: 5-11.
- Huang T-C and Grobbelaar N (1995) The circadian clock in the prokaryote Synechococcus RF-1. Microbiology 141: 535–540.
- Lin R-F, and Huang, T-C (2009) Circadian rhythm of Cyanothece RF-1 (Synechococcus RF-1). Chapter 3 in: Bacterial Circadian Programs, J.L. Ditty, S.R. Mackey, C.H. Johnson, eds. (Springer), pp. 39-61.
- Sweeney BM, and Borgese MB (1989) A circadian rhythm in cell division in a prokaryote, the cyanobacterium Synechococcus WH7803. J. Phycol. 25: 183-186.
- Kondo, T., Strayer, C.A., Kulkarni, R.D., Taylor, W., Ishiura, M., Golden, S.S., and Johnson, C.H. (1993). Circadian rhythms in prokaryotes: luciferase as a reporter of circadian gene expression in cyanobacteria. Proc. Natl. Acad. Sci. USA 90, 5672-5676.
- Johnson, C.H., and Y. Xu (2009) The Decade of Discovery: How Synechococcus elongatus became a model circadian system 1990–2000. Chapter 4 in: Bacterial Circadian Programs, J.L. Ditty, S.R. Mackey, C.H. Johnson, eds. (Springer), pp. 63-86.
- Mihalcescu, I., Hsing, W., and Leibler, S. (2004). Resilient circadian oscillator revealed in individual cyanobacteria. Nature 430, 81-85.
- Mihalcescu I, Hsing W, Leibler S (2004) Resilient circadian oscillator revealed in individual cyanobacteria. Nature 430: (Résumé/article, en anglais)
- Pittendrigh, C.S. (1993). Temporal organization: reflections of a Darwinian clock-watcher. Annu. Rev. Physiol. 55, 17-54.
- Mori, T., Binder, B., and Johnson, C.H. (1996) Circadian gating of cell division in cyanobacteria growing with average doubling times of less than 24 hours. Proc. Natl. Acad. Sci. USA 93, 10183-10188.
- Kondo, T., Mori, T., Lebedeva, N.V., Aoki, S., Ishiura, M., and Golden, S.S. (1997). Circadian rhythms in rapidly dividing cyanobacteria. Science 275, 224-227.
- Mori, T., and Johnson, C.H. (2001). Independence of circadian timing from cell division in cyanobacteria. J Bacteriol. 183, 2439-2444.
- Woelfle, M.A., Ouyang, Y., Phanvijhitsiri, K., and Johnson, C.H. (2004). The adaptive value of circadian clocks: An experimental assessment in cyanobacteria. Current Biol. 14, 1481–1486.
- Ouyang, Y., Andersson, C.R., Kondo T., Golden S.S., and Johnson C.H. (1998). Resonating circadian clocks enhance fitness in cyanobacteria. Proc. Natl. Acad. Sci. USA 95, 8660-8664.
- Liu, Y., Tsinoremas, N.F., Johnson, C.H., Lebedeva, N.V., Golden, S.S., Ishiura, M., and Kondo, T. (1995). Circadian orchestration of gene expression in cyanobacteria. Genes Dev. 9, 1469-1478.
- Smith, R.M., and Williams, S.B. (2006). Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Natl. Acad. Sci. USA 103, 8564-8569.
- Woelfle, M.A., Xu, Y., Qin, X., and Johnson, C.H. (2007). Circadian rhythms of superhelical status of DNA in cyanobacteria. Proc. Natl. Acad. Sci. USA 104, 18819-18824.
- Kondo, T., N. F. Tsinoremas, S. S. Golden, C. H. Johnson, S. Kutsuna, and M. Ishiura (1994) Circadian clock mutants of cyanobacteria. Science 266: 1233-1236.
- Ishiura et al., 1998
- Ishiura, M., Kutsuna, S., Aoki, S., Iwasaki, H., Andersson, C.R., Tanabe, A., Golden, S.S., Johnson, C.H., and Kondo, T. (1998). Expression of a gene cluster kaiABC as a circadian feedback process in cyanobacteria. Science 281, 1519-1523.
- Dunlap, J.C., Loros, J.J., and DeCoursey, P.J. (eds.) (2004). Chronobiology: Biological Timekeeping. Sinauer, Sunderland, MA.
- Xu, Y., Mori, T., and Johnson, C.H. (2003). Cyanobacterial circadian clockwork: roles of KaiA, KaiB and the kaiBC promoter in regulating KaiC. EMBO J. 22, 2117-2126.
- Nakahira, Y., Katayama, M., Miyashita, H., Kutsuna, S., Iwasaki, H., Oyama, T., and Kondo, T. (2004). Global gene repression by KaiC as a master process of prokaryotic circadian system. Proc. Natl. Acad. Sci. USA 101, 881-885.
- Tomita, J., Nakajima, M., Kondo, T., and Iwasaki, H. (2005). No transcription-translation feedback in circadian rhythm of KaiC phosphorylation. Science 307, 251-254.
- Nakajima, M., Imai, K., Ito, H., Nishiwaki, T., Murayama, Y., Iwasaki, H., Oyama, T., and Kondo, T. (2005). Reconstitution of circadian oscillation of cyanobacterial KaiC phosphorylation in vitro. Science 308, 414-415.
- Tyson JJ, Chen KC, Novak B (2003) Sniffers, buzzers, toggles and blinkers: dynamics of regulatory and signaling pathways in the cell. Curr Opin Cell Biol 15: 221
- (en) Rekha Pattanayek, Jimin Wang, Tetsuya Mori, Yao Xu, Carl Hirschie Johnson et Martin Egli, « Visualizing a Circadian Clock Protein: Crystal Structure of KaiC and Functional Insights », Molecular Cell, vol. 15, no 3, , p. 375-388 (PMID 15304218, DOI 10.1016/j.molcel.2004.07.013, lire en ligne)
- (en) Rekha Pattanayek, Jimin Wang, Tetsuya Mori, Yao Xu, Carl Hirschie Johnson et Martin Egli, « Erratum: Visualizing a Circadian Clock Protein: Crystal Structure of KaiC and Functional Insights », Molecular Cell, vol. 15, no 5, , p. 841 (DOI 10.1016/j.molcel.2004.08.027, lire en ligne)
- Williams SB, Vakonakis I, Golden SS, LiWang AC (2002) Structure and function from the circadian clock protein KaiA of Synechococcus elongatus: a potential clock input mechanism. Proc Natl Acad Sci USA 99: 15357-62.
- Ye, S., Vakonakis, I., Ioerger, T.R., LiWang, A.C., and Sacchettini J.C. (2004). Crystal structure of circadian clock protein KaiA from Synechococcus elongatus. J. Biol. Chem. 279, 20511-20518.
- Garces R.G., Wu N., Gillon W., and Pai E.F. (2004). Anabaena circadian clock proteins KaiA and KaiB reveal potential common binding site to their partner KaiC. EMBO J.. 23, 1688-1698.
- Hitomi, K., Oyama, T., Han, S., Arvai, A.S., and Getzoff, E.D. (2005). Tetrameric architecture of the circadian clock protein KaiB. A novel interface for intermolecular interactions and its impact on the circadian rhythm. J. Biol. Chem. 280, 19127-19135.
- Pattanayek, R., Wang, J., Mori, T., Xu, Y., Johnson, C.H., and Egli, M. (2004). Visualizing a circadian clock protein: crystal structure of KaiC and functional insights. Mol. Cell 15, 375-388.
- Xu, Y., Mori, T., Pattanayek, R., Pattanayek, S., Egli, M., and Johnson, C.H. (2004). Identification of key phosphorylation sites in the circadian clock protein KaiC by crystallographic and mutagenetic analyses. Proc. Natl. Acad. Sci. USA 101, 13933-13938.
- Nishiwaki, T., Satomi, Y., Nakajima, M., Lee, C., Kiyohara, R., Kageyama, H., Kitayama, Y., Temamoto, M., Yamaguchi, A., Hijikata, A., Go, M., Iwasaki, H., Takao, T., and Kondo, T. (2004). Role of KaiC phosphorylation in the circadian clock system of Synechococcus elongatus PCC 7942. Proc. Natl. Acad. Sci. USA 101, 13927-13932.
- Sébastien Clodong, Ulf Dühring, Luiza Kronk, Annegret Wilde, Ilka Axmann, Hanspeter Herzel & Markus Kollmann ; Functioning and robustness of a bacterial circadian clock ; Molecular Systems Biology 3:90 ; doi:10.1038/msb4100128 ; online: 13 March 2007
- Vakonakis, I., and LiWang, A.C. (2004). Structure of the C-terminal domain of the clock protein KaiA in complex with a KaiC-derived peptide: implications for KaiC regulation. Proc. Natl. Acad. Sci. USA 101: 10925-10930.
- Pattanayek, R., Williams, D.R., Pattanayek, S., Xu, Y., Mori, T., Johnson, C.H., Stewart, P.L., and Egli, M. (2006). Analysis of KaiA-KaiC protein interactions in the cyano-bacterial circadian clock using hybrid structural methods. EMBO J. 25, 2017-2028.
- Kim YI, Dong G, Carruthers CW Jr, Golden SS, LiWang A (2008) The day/night switch in KaiC, a central oscillator component of the circadian clock of cyanobacteria. Proc Natl Acad Sci USA 105: 12825-30.
- Pattanayek, R, Williams, DR, Pattanayek, S, Mori, T, Johnson, CH, Stewart, PL, Egli, M. (2008) Structural model of the circadian clock KaiB-KaiC complex and mechanism for modulation of KaiC phosphorylation. EMBO J. 27: 1767-78.
- Mori, T., D.R. Williams, M.O. Byrne, X. Qin, H.S. Mchaourab, M. Egli, P.L. Stewart, and C.H. Johnson (2007) Elucidating the Ticking of an in vitro Circadian Clockwork. PLoS Biology 5: e93.
- Chang, Y., Cohen, S., Phong, C., et al. Circadian rhythms. A protein fold switch joins the circadian oscillator to clock output in cyanobacteria. Science 2015, 349:324-8.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bacterial circadian rhythms » (voir la liste des auteurs).
Voir aussi
Bibliographie
- J. L. Ditty, S. R. Mackey et C. H. Johnson, Bacterial Circadian Programs, Springer, 2009, 333 pages.
- Dunlap JC, Loros J et DeCoursey PJ, Chronobiology: Biological Timekeeping, Sinauer, Sunderland, 2004.
Articles connexes
- Horloge circadienne
- Rythme
- Cyanobacteria
- Pollution lumineuse
- Environnement nocturne
- Biologie de synthèse
- Portail de la biologie