Phosphorylation au niveau du substrat
La phosphorylation au niveau du substrat est un type de réaction chimique du métabolisme cellulaire consistant en la phosphorylation de l'adénosine diphosphate (ADP) ou de la guanosine diphosphate (GDP) par transfert direct d'un groupe phosphate à partir d'une petite molécule phosphorylée ou d'une molécule de phosphate inorganique pour former respectivement de l'adénosine triphosphate (ATP) ou de la guanosine triphosphate (GTP). De telles réactions requièrent une quantité d'énergie équivalente à celle libérée par l'hydrolyse de l'ATP, soit une variation d'enthalpie libre ΔG°′ = −30,5 kJ·mol-1, et sont catalysées par des enzymes qui réalisent le couplage avec une réaction exergonique libérant une quantité d'énergie au moins égale à cette valeur : ainsi, l'hydrolyse du groupe phosphate du phosphoénolpyruvate (PEP) libère ΔG°′ ≈ −61 kJ·mol-1[1], ce qui permet à la pyruvate kinase de phosphoryler une molécule d'ADP en ATP.

Outre la phosphorylation au niveau du substrat, les cellules peuvent produire de l'ATP par phosphorylation oxydative. Il s'agit cependant d'un processus totalement différent, dans lequel l'énergie provient de la chaîne respiratoire et le couplage avec la phosphorylation de l'ADP est réalisé par chimiosmose. Si l'essentiel de l'ATP d'une cellule est produit par la phosphorylation oxydative en environnement aérobie, la phosphorylation au niveau substrat permet de fournir rapidement une certaine quantité d'ATP en l'absence d'oxygène, comme c'est le cas par fermentation lactique dans le muscle en condition anaérobie transitoire.
Dans le cytosol
Les réactions de phosphorylation au niveau du substrat se déroulent principalement dans le cytosol au cours de la glycolyse et, chez les eucaryotes, dans les mitochondries au cours du cycle de Krebs, aussi bien en conditions aérobies qu'anaérobies.
Au cours de la troisième phase de la glycolyse — celle où l'énergie investie dans les phosphorylations préliminaires est récupérée sous forme d'ATP — deux réactions font intervenir une phosphorylation au niveau du substrat :
- la phosphoglycérate kinase (EC ) convertit le 1,3-bisphosphoglycérate en 3-phosphoglycérate avec phosphorylation concomitante d'une molécule d'ADP en ATP ;
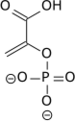
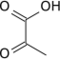
- la pyruvate kinase (EC ) convertit le phosphoénolpyruvate en pyruvate avec phosphorylation concomitante d'une molécule d'ADP en ATP.
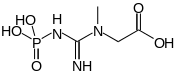
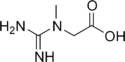
La créatine kinase (EC ) est un autre exemple de phosphorylation au niveau du substrat, cette enzyme étant capable de phosphoryler l'ADP en ATP tout en convertissant la phosphocréatine en créatine : cette dernière réaction est accompagnée d'une variation d'enthalpie libre standard de ΔG°′ = −43,1 kJ·mol-1[2], ce qui permet la formation d'ATP.
Dans les mitochondries
L'ATP produit par les mitochondries en conditions aérobies provient essentiellement du gradient électrochimique généré à travers la membrane mitochondriale interne par la chaîne respiratoire. C'est ce gradient électrochimique qui fournit l'énergie nécessaire à l'ATP synthase pour phosphoryler l'ADP en ATP.
Cependant, deux enzymes de la matrice mitochondriale contribuent à la production d'ATP par phosphorylation au niveau du substrat, c'est-à-dire de manière totalement indépendante de la force proton-motrice générée par la chaîne respiratoire :
- la phosphoénolpyruvate carboxykinase (EC ) convertit l'oxaloacétate en phosphoénolpyruvate avec dégagement de CO2 et phosphorylation concomitante d'ADP en ATP ;
- la succinyl-CoA synthétase (EC / EC ) convertit la succinyl-CoA en succinate avec phosphorylation concomitante d'une molécule d'ADP ou de GDP en ATP ou GTP.
La première de ces deux enzymes intervient dans le cycle de Krebs et on pense qu'elle contribue aux échanges de potentiel de phosphorylation entre le cytosol et la matrice mitochondriale[3],[4],[5],[6],[7]. La seconde est peut-être la seule enzyme susceptible de pouvoir maintenir un certain taux d'ATP dans la matrice mitochondriale en l'absence de la force proton-motrice générée par la chaîne respiratoire, par exemple au cours d'un épisode d'hypoxie temporaire.
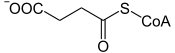 |
+ GDP / ADP + Pi GTP / ATP + CoA + | |
| Succinyl-CoA | Succinate | |
| Succinyl-CoA synthétase – formant du GDP EC / formant de l'ADP EC | ||
Notes et références
- (en) Geoffrey M. Cooper, The Cell – A Molecular Approach, Sunderland (MA), Sinauer Associates, , 2e éd. (ISBN 0-87893-106-6, lire en ligne), The Generation of ATP from Glucose
- (en) Variation d'enthalpie libre, sur le site de Marc Kirschner (en), Harvard Medical School.
- (en) David O. Lambeth, Kristin N. Tews, Steven Adkins, Dean Frohlich and Barry I. Milavetz, « Expression of Two Succinyl-CoA Synthetases with Different Nucleotide Specificities in Mammalian Tissues », Journal of Biological Chemistry, vol. 279, no 35, , p. 36621-36624 (PMID 15234968, DOI 10.1074/jbc.M406884200, lire en ligne)
- (en) J. H. Ottaway, J. A. McClellan et C.L. Saunderson, « Succinic thiokinase and metabolic control », International Journal of Biochemistry, vol. 13, no 4, , p. 401-410 (PMID 6263728, DOI 10.1016/0020-711X(81)90111-7, lire en ligne)
- (en) David O. Lambeth, « What is the function of GTP produced in the Krebs citric acid cycle? », IUBMB Life, vol. 54, no 3, , p. 143-144 (PMID 12489642, DOI 10.1080/15216540214539, lire en ligne)
- (en) D. F. Wilson, M. Erecińska et V. L. Schramm, « Evaluation of the relationship between the intra- and extramitochondrial [ATP]/[ADP] ratios using phosphoenolpyruvate carboxykinase », Journal of Biological Chemistry, vol. 258, no 17, , p. 10464-10473 (PMID 6885788, lire en ligne)
- (en) James D. Johnson, James G. Mehus, Kristin Tews, Barry I. Milavetz et David O. Lambeth, « Genetic Evidence for the Expression of ATP- and GTP-specific Succinyl-CoA Synthetases in Multicellular Eucaryotes », Journal of Biological Chemistry, vol. 273, no 42, , p. 27580-27586 (PMID 9765291, DOI 10.1074/jbc.273.42.27580, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire