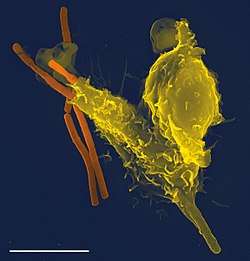
Granulocyte neutrophile
Les granulocytes neutrophiles ou polynucléaires neutrophiles (PNN) (ou simplement « les neutrophiles ») sont des cellules sanguines appartenant à la lignée blanche. En effet, ce sont des globules blancs (leucocytes) qui ont un rôle majeur dans le système immunitaire. Le passage des polynucléaires neutrophiles dans le sang est rapide et bref car ils jouent leur rôle essentiellement dans les tissus, où ils sont le principal agent cellulaire anti-bactérien. La durée de vie du polynucléaire neutrophile est très courte car il est entièrement consommé par sa fonction, ce qui contribue à faire de lui une cellule anti-infectieuse, absolument non-spécifique ; il peut en effet combattre une très nombreuse variété de menaces différentes.
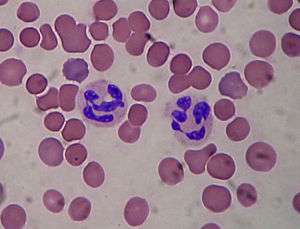
On les appelle polynucléaires en raison d'une erreur historique : de par le caractère plurilobé de leur noyau (de deux à cinq lobes en général), on a longtemps cru que ces cellules possédaient plusieurs noyaux.
Le qualificatif de « neutrophile » vient aussi d'une caractéristique visible en microscopie optique : après ajout des colorants vitaux usuels (May-Grünwald Giemsa ou MGG), ces cellules restent neutres (elles fixent mal les colorants acides et basiques).
Les autres granulocytes sont les granulocytes éosinophiles et basophiles. Les neutrophiles représentent à eux seuls environ 65 % de l'ensemble des leucocytes du sang, et 99 % des granulocytes.
Morphologie
Le polynucléaire neutrophile est une cellule sphérique, possédant un noyau segmenté en plusieurs lobes qui réfléchit la lumière (à cause des nombreuses granulations). Il se déplace de manière adhérente sur la paroi d'autres cellules en projetant des extensions nommées lamellipodes.
Ce mode de déplacement est appelé amœboïde.
Origine : la lignée granulocytaire neutrophile
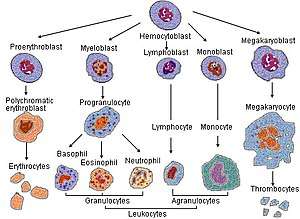
Les neutrophiles proviennent de la moelle osseuse.
Le granulocyte neutrophile provient de la maturation d'un myéloblaste, lors d'une maturation qui dure 3 jours.
Les myéloblastes proviennent des hémocytoblastes eux-mêmes provenant d'une cellule souche hématopoïétique.
La lignée granulocytaire[1] se subdivise en trois types d'éléments, les neutrophiles, les éosinophiles et les basophiles. Les neutrophiles sont issus des CFU-GM (progéniteur des granulocytes et des monocytes). Lorsque la cellule souche se différencie dans la voie des granulocytes, il devient un myéloblaste et mature en suivant les divers stades suivants, qui correspondent aux précurseurs :
- Myéloblaste
- Promyélocyte
- Myélocyte
- Métamyélocyte
- Stab ou Band selon la littérature
- Neutrophile
Biochimie
- Dépenses énergétiques : celles-ci sont assez considérables pour assurer les mouvements amiboïdes et la phagocytose.
- Appareil moteur : microfilaments de type actine-myosine (ces éléments sont visibles en microscopie électronique).
- Métabolisme : celui-ci est en grande partie anaérobie (transformation du glycogène en acide lactique). Ceci constitue un avantage : ces éléments cellulaires survivent facilement en milieu anaérobie ou mal oxygéné tel le tissu nécrosé. Les neutrophiles possèdent également un métabolisme oxydatif leur permettant notamment de consommer des lipides (mitochondries d'ailleurs peu nombreuses).
- Granules : un neutrophile possède dans son cytoplasme de 50 à 200 granules. On distingue les granules primaires ou précoces, azurophiles (contenant la myéloperoxydase, et des agents de la bactéricidie non oxydative comme les défensines, la cathepsine G...), et les granules spécifiques secondaires (contenant la lactoferrine, beaucoup de lysozymes, la phosphatase alcaline, et le cytochrome b 558). Ceux-ci doivent être considérés comme des lysosomes. On a décrit dans les neutrophiles de nombreux enzymes lysosomiaux : nucléase, nucléotidase, bêta-glucuronidase, élastase, collagénase, etc.
- Il existe une troisième catégorie de granulation : particulièrement riche en gélatinase (collagénase).
Fonctions
Cette section ne cite pas suffisamment ses sources (août 2017). Pour l'améliorer, ajoutez des références vérifiables [comment faire ?] ou le modèle {{Référence nécessaire}} sur les passages nécessitant une source. |
Les neutrophiles ont un rôle primordial de phagocytose lorsqu'ils rencontrent une cellule étrangère ou infectée. La phagocytose se déroule juste après la stimulation du neutrophile par un antigène porté par la cellule cible (cet antigène étant le plus souvent un fragment de membrane bactérienne ou un fragment de virus, reconnu comme étranger) avec l'émission de pseudopodes (longs prolongements cytoplasmiques) qui vont entourer la cellule cible, et finir par l'inclure dans le corps cellulaire du neutrophile. Là, des vacuoles contenues dans les neutrophiles fusionnent avec la vacuole de phagocytose : leur contenu (lysozyme et granulations sécrétoires) détruit la cellule cible par un mécanisme toxique. Ce processus entraîne la mort du neutrophile, car elle épuise toutes ses réserves en glucose. La phagocytose est favorisée par la mobilité de ces cellules : elles sont capables de se déplacer dans le sang puis dans les tissus vers les foyers d'infection, où elles sont attirées par chimiotactisme (lors d'une infection, les cellules endothéliales, mastocytes et macrophages à proximité libèrent des substances chimiques appelées cytokines, qui attirent les polynucléaires).
Les neutrophiles sont bien plus nombreux que d'autres cellules douées de phagocytose (les macrophages), mais survivent dans le sang bien moins longtemps. Certains spécialistes [Qui ?] du système immunitaire pensent que cette courte durée de vie (qui se termine dès la première phagocytose) est une adaptation évolutive qui permet d'éviter la propagation de pathogènes capables de parasiter les phagocytes. La durée de vie des neutrophiles a été mesurée au moyen de globules blancs marqués par des isotopes radioactifs. Dans la circulation, les neutrophiles ne vivent guère plus de 10 à 12 heures. Dans les tissus, cette durée de vie semble être plus longue (2 à 3 jours). Lorsqu'un neutrophile sort de la circulation, p. ex. pour se rendre vers un foyer inflammatoire, il n'y retourne plus jamais. Lorsqu'un neutrophile meurt, ses fragments sont repris par phagocytose dans le S.R.E.
Après de nouvelles recherches, il semblerait que les neutrophiles possèdent une fonction inédite dans le contrôle immunitaire. En effet, ils auraient la capacité d'expulser leur propre matériel génétique, en direction de l'agent pathogène afin de les neutraliser et de les dégrader plus facilement (NETose). Les propriétés de l'ADN sont bien connues, molécule très longue (quand elle se condense) et surtout très collante, son action sur les parasites pourrait fonctionner en effet. Lors de l'action des neutrophiles ceux-ci expulsent en direction des bactéries (surtout) une substance très visqueuse et très collante, leur ADN. Les bactéries sont ainsi engluées et elles ne peuvent plus bouger, leur destruction est plus facile.
En pathologie humaine
Une baisse de la valeur absolue des neutrophiles est appelée « neutropénie ». Celle-ci peut être congénitale, ou bien plus souvent liée à des facteurs acquis (infection sévère, chimiothérapie, etc.).
Les anomalies fonctionnelles sont le plus souvent héréditaires : les neutrophiles peuvent être incapables de phagocytose.
Le déficit congénital en alpha-1-antitrypsine entraîne un défaut d'inactivation de l'élastase, une des enzymes contenues dans les neutrophiles. L'élastase est une enzyme capable de détruire certains tissus, et cette maladie entraîne des dégâts tissulaires, en particulier dans le poumon (emphysème pulmonaire). Une intoxication tabagique entraîne une inhibition de l'alpha-1-antitrypsine qui a pour rôle de moduler l'action des élastases des neutrophiles. Ceci entraîne une destruction accrue des fibres élastiques du poumon ce qui augmente sa compliance, provoquant un emphysème qui gêne la mécanique ventilatoire.
Le neutrophile peut être sujet à diverses autres anomalies, ces anomalies peuvent être transitoires comme les granulations toxiques, la présence de vacuole dans le cytoplasme ou la présence de corps de Döhle souvent signe d'un état infectieux ou plus sérieuse comme la présence de neutrophile hypersegmenté (le noyau contient 5 lobes ou plus).
Phases successives d'une hyperleucocytose neutrophile
1) Mobilisation des granulocytes marginaux et séquestrés
C'est ce qu'on constate, par exemple après injection d'adrénaline ou à la suite d'un exercice musculaire.
2) Largage des réserves de la moelle osseuse
Hyperleucocytose transitoire.
3) Hyperproduction de neutrophiles par la moelle osseuse
Dans ce cas, l'hyperleucocytose se maintient de manière soutenue ; la proportion des neutrophiles dépasse souvent 80 % ; il y a toujours apparition de formes jeunes (monolobées).
Références
- « Laboratoire d'Hématologie Cellulaire du CHU d'Angers », sur hematocell.univ-angers.fr (consulté le 28 octobre 2015)