Légionellose
La légionellose est une maladie infectieuse due à une bactérie d'origine hydro-tellurique de la famille des Legionellaceae (Brenner et al. 1979) dont la plus connue est Legionella pneumophila. La bactérie se développe dans les réseaux d'eau douce naturels ou artificiels et dans un milieu organique favorable à leur développement (stations thermales, climatiseurs[note 1], etc.) riche en fer, zinc, aluminium.
| Spécialité | Infectiologie (en) et pneumologie |
|---|---|
| Symptôme | Céphalée, fièvre, toux et myalgie |
| CISP-2 | R81 |
|---|---|
| CIM-10 | A48.1 |
| CIM-9 | 482.8 |
| DiseasesDB | 7366 |
| MedlinePlus | 000616 |
| eMedicine | 220163 |
| MeSH | D007876 |
![]()
Également connue sous le nom de « maladie du légionnaire » car le premier cas connu est apparu lors d'un congrès de l'American Legion, elle atteint les poumons et fait partie des maladies à déclaration obligatoire en France, en Belgique et au Canada depuis 1986[1]. Son incidence en France est de 1 540 cas en 2010 selon l'institut de veille sanitaire[2], en augmentation de 28 % par rapport à 2009.
Agent causal
Les agents infectieux sont des bactéries appartenant à la classe des légionelles, bacille à Gram négatif ; il existe au moins 53 espèces, mais Legionella pneumophila est la bactérie la plus fréquemment en cause en pathologie humaine en Occident. D'autres espèces de Legionella ont été isolées : L. longbeachae, L. micdadei, L. bozemanii, etc. En Australie, L. longbeachae est plus souvent l'agent causal de la légionellose que L. pneumophila.
Mode de contamination
La contamination a lieu par inhalation de gouttelettes d'eau contenant des bactéries, en suspension dans l'air. Les installations d'eau en cause sont : douche, robinets, spas, fontaines, nébuliseurs et surtout les tours aéroréfrigérantes. La fréquence des légionelloses est plus élevée au cours de l'été.
La bactérie se développe principalement dans les eaux dont la température est comprise entre 25 et 47 °C. C'est pourquoi il est recommandé de régler son chauffe-eau à une température de 55°C pour empêcher la prolifération du bacille (des températures supérieures favorisent l'entartrement des canalisations).
La transmission interhumaine et l'infection par ingestion d'eau contaminée n'ont jamais été décrites. Les cas de légionellose chez l'enfant sont extrêmement rares.
La maladie doit son nom à une épidémie (en) de pneumonie parmi des anciens combattants participant à une convention de l'American Legion dans un hôtel de Philadelphie en 1976.
Formes
Il existe 2 formes de la maladie :
- une forme bénigne, appelée fièvre de Pontiac, analogue à un syndrome grippal. La guérison est spontanée en 2 à 5 jours. Elle représenterait 95 % des cas et est probablement sous-diagnostiquée ;
- une forme grave, appelée légionellose, qui survient chez l'hôte susceptible. Les facteurs de risque identifiés à l'heure actuelle étant l'âge avancé, l'immunodépression et le tabagisme.
Elle se caractérise par une infection pulmonaire aiguë et sévère pouvant entraîner le décès dans 11 % des cas. Sous cette forme, elle fait partie des maladies infectieuses à déclaration obligatoire.
Transmission
Une épidémie récente [3], fin 2003-début 2004, provoquant 85 cas (dont 17 décès) de légionelloses dans un arrondissement de Lens et incriminant comme l’une des sources possibles une tour aéroréfrigérante d’une entreprise, nous montre que l’urbanisation et les progrès technologiques ont donné la possibilité à des bactéries antédiluviennes de la famille des Légionelles, de se développer dans nos installations techniques, d’être diffusées sous forme d’aérosols, puis inhalées. L’inhalation étant la voie de contamination communément admise. Les nombreux travaux menés depuis les premiers cas de légionellose en 1976 à Philadelphie ont montré que l’environnement aquatique naturel et artificiel (lacs, rivières, étangs et même dans les sols) était le réservoir de la grande famille des légionelles dont seules quelques espèces voire sérogroupes sont majoritairement responsables d’affections respiratoires.
L’une des particularités de cette famille de bactéries est qu’elle est détectable dans des eaux ou des réseaux d’eau, à des températures allant de 5,7 à 63 °C[4] même si son optimum thermique est compris entre 25 °C et 43 °C. L’autre grande particularité de cette bactérie thermophile est son mode de survie basé sur un parasitisme naturel de divers protozoaires de la microflore aquatique (ciliés et amibes libres de type Naegleria, Acanthamoeba).
Cette double propriété écologique, thermophilie et parasitisme, font des légionelles de redoutables bactéries ubiquitaires de notre environnement expliquant leur présence dans 30 à 60 % des prélèvements d'eau chaude sanitaire réalisés dans les hôpitaux, hôtels, bâtiments et lieux d'habitation (immeubles ou maisons individuelles). Par ailleurs de nombreux réseaux d’eaux peuvent être contaminés, à côté des classiques eaux chaudes sanitaires domestiques ou tours aéroréfrigérantes, sont aussi concernés les équipements de stations thermales, les fontaines décoratives, les bains à remous et plus surprenant de rares machines à glace et fontaines réfrigérantes.
La prévention et la surveillance des légionelloses, notamment dans les établissements de santé ont fait l’objet en France depuis 1997 d’un renforcement réglementaire, justifié par l’évolution des connaissances. La dernière circulaire du 22 avril 2002 relative à la prévention du risque lié aux légionelles précise, entre autres, des mesures de prévention à mettre en œuvre pour lutter contre les légionelloses[5]. Compte tenu de la faible production d’aérosols lors de l’utilisation normale de l’eau à un robinet, les dispositions préventives ont été menées prioritairement dans les lieux pourvus de douches ou douchettes. Jusqu’en 2002, les systèmes de distribution d’eau chaude étaient à l’origine du plus grand nombre de cas de légionelloses dans les établissements de santé mais depuis la mise en application de cette circulaire, les tours aéro-réfrigérantes semblent être le principal responsable.
Par ailleurs, le Centre National de Référence des Légionelles recueille et effectue le typage de toutes les souches cliniques isolées en France. Cette surveillance épidémiologique permet le recensement et la comparaison des souches.
Symptômes
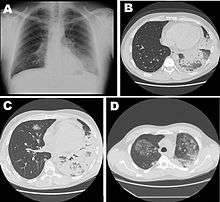
La période d'incubation (temps écoulé entre le contact avec le microbe et l'apparition des premiers signes) est de 2 à 10 jours (et jusqu'à 19 jours).
Il n'y a pas de signe clinique spécifique de la légionellose, la maladie se manifeste principalement par une pneumopathie sévère et progressive accompagnée de nombreux symptômes extra-pulmonaires :
au niveau général
- altération de l'état général,
- malaise,
- céphalées,
- fièvre (la température dépasse 40 °C chez plus de la moitié des malades) et frissons ;
au niveau pulmonaire
- toux sèche ou non (c'est-à-dire produisant une expectoration) assez fréquemment,
- dyspnée (difficulté à respirer) pouvant faire croire à une embolie pulmonaire,
- hémoptysies (crachats de sang de faible abondance),
- douleur thoracique ;
au niveau extra-pulmonaire
- manifestations neurologiques : confusion, désorientation, obnubilation, léthargie, coma, délire et hallucinations,
- myalgies (douleurs musculaires),
- troubles digestifs : diarrhée, nausées et vomissements, douleurs abdominales.
Physiopathologie
Après inhalation, dans les poumons, les bactéries sont phagocytées par les macrophages alvéolaires. La légionelle va ensuite utiliser les mécanismes du trafic intracellulaire de la cellule-hôte qu'elle va exploiter afin de créer une vacuole (Legionella-containing vacuole) au sein de laquelle elle est protégée des mécanismes de défense de l'hôte (pas de fusion avec les lysosomes), modifiant l’expression de plus de 4800 gènes (dont ceux codant l’interleukine 6 ou le récepteur extra-cellulaire TLR5 (en), directement impliqués dans l’immunité innée) de la cellule hôte grâce notamment à la protéine RomA qui change la conformation de son ADN[6]. Dans cette vacuole, Legionela va changer de phénotype et passer de sa forme flagellée virulente à sa forme réplicative. Après multiplication, la bactérie détruit la cellule-hôte et contamine les cellules avoisinantes, permettant à l'infection de s'étendre. Le déroulement successif de ces étapes est orchestré par un facteur de virulence essentiel de la bactérie : le système de sécrétion de type IV (aussi appelé Dot/Icm). La défense de l'organisme hôte repose sur le rôle décisif d'acteurs de l'immunité innée que sont les récepteurs de type Toll et de type NOD. Ceux-ci reconnaissent des éléments bactériens (lipopolysaccharide, flagelline) conservés au cours de l'évolution et mettent en jeu des voies de défense (inflammation, pyroptose) aboutissant à la mort cellulaire et ainsi à la restriction de l'infection.
Diagnostic
Seuls les examens microbiologiques permettent d'affirmer la maladie. Parmi les nombreuses méthodes de détection la recherche d'antigènes solubles urinaires est la méthode qui a révolutionné la prise en charge de la légionellose. Cependant, elle ne permet de détecter qu'un antigène de Legionella pneumophila de sérogroupe 1. Le développement de la PCR en fait un outil d'avenir.
Traitement
Le traitement doit être mis en route rapidement. Compte tenu de la localisation intracellulaire de la bactérie les antibiotiques recommandés sont les macrolides, les fluoroquinolones et la rifampicine (qui doit toujours être utilisée en association). La durée du traitement vient d'être revue à la baisse par l'Ansm ; elle est de huit à quatorze jours mais peut être allongée à 21 jours voire plus dans les cas graves et chez les sujets fragilisés. Dans ces cas, le traitement sera utilisé par voie intraveineuse et la bithérapie sera favorisée.
Mesures générales de prévention
Pour limiter le développement des légionelles, il est nécessaire d’agir à trois niveaux :
- éviter la stagnation et assurer une bonne circulation de l’eau ;
- lutter contre l’entartrage et la corrosion par une conception et un entretien adapté à la qualité de l’eau et aux caractéristiques de l’installation ;
- maintenir l’eau à une température élevée (60 à 70°C) dans les installations, depuis la production et tout au long des circuits de distribution et mitiger l’eau au plus près des points d’usage.
La mise en œuvre de ces actions limite, voire supprime, la nécessité de réaliser des interventions curatives ponctuelles sur les réseaux telles que des chocs chlorés ou thermiques, lesquelles ne garantissent pas une réduction de la contamination sur le long terme. En effet de telles mesures peuvent parfois avoir pour conséquences, un déséquilibre de la flore microbienne, et la dégradation des installations, favorisant ainsi la création de nouveaux gîtes favorables à la prolifération des légionelles.
Il ne faut pas oublier qu’un réseau d’eau n’est pas uniquement constitué d’un contenant, la canalisation, et d’un contenu, l’eau transportée, mais d’un écosystème très complexe. La face interne des canalisations est quasi systématiquement recouverte d’un biofilm, c’est-à-dire d’une matrice complexe de polymères extracellulaire et de sels minéraux dans laquelle se fixent des bactéries comme les légionelles. Ce biofilm joue un rôle protecteur prépondérant des bactéries hébergées. Dans un réseau de distribution d’eau, seules les bactéries fixées prolifèrent, car la croissance bactérienne est négligeable pour les bactéries en suspension (cas des légionelles libres). Malheureusement, les bactéries des biofilms résistent à des températures ou à des concentrations de désinfectants 1000 à 1500 fois supérieures à celles qui tuent les cellules planctoniques des mêmes espèces[7]. L’augmentation de cette résistance est liée à la consommation des désinfectants par le biofilm. En conséquence, les résultats des essais de désinfectants menés in vitro sont très différents de ceux obtenus in situ.
De plus, l’évolution de la teneur en bactéries cultivables dans le biofilm au cours des traitements de désinfection montre qu’un traitement répétée de manière séquentielle (alternance de désinfection de quelques heures et de phase de recolonisation de quelques jours) avec différents désinfectants (chlore, monochloramine, ozone, acide peracétique, ammonium quaternaire ou choc thermique + choc chloré) a pour conséquence que la deuxième désinfection est moins efficace que la première et la recolonisation bactérienne est plus rapide.
Pour éviter de désinfecter, il est nécessaire d’avoir un réseau bien conçu et de réaliser un entretien rigoureux et régulier de celui-ci. Le contrôle de la température de l’eau chaude sanitaire de la production à la distribution est un facteur clé de la maîtrise des légionelles. Les actions préventives concernent les traitements qui visent à prévenir un développement important de légionelles et à maintenir la concentration en légionelles, éventuellement présentes en suspension dans l’eau chaude sanitaire, à un niveau acceptable. Ces actions préventives peuvent être discontinues et consistent, à intervalle régulier, par exemple tous les mois, en un traitement comprenant une désinfection choc précédée à un rythme semestriel ou annuel, d’un nettoyage. Ce traitement discontinu n’a été actuellement validé que sur des petits réseaux. Les actions préventives continues mettent en œuvre un procédé ou une injection de produits de manière permanente, permettant la maîtrise continuelle des bactéries en suspension. L’utilisation des désinfectants en continu dans de l’eau chaude sanitaire est à éviter, autant que possible : corrosion, vieillissement prématuré de certains matériaux, « accoutumances » possible de certaines souches bactériennes…
Stratégies de désinfection
Dogme : l’efficacité des désinfectants est incertaine voire hasardeuse dans le temps sur les bactéries hydriques et plus particulièrement sur les légionelles.
Les actions curatives correspondent aux traitements à caractère momentané qui peuvent être nécessaires à la suite de la mise en évidence dans l’eau de concentrations excessives en légionelles[8],[9],[10].
Réseaux d’eau chaude sanitaire
Quand
Plusieurs conditions sont obligatoires :
- niveau d’action atteint ;
- échec des interventions techniques : température et débit satisfaisants ;
- espèce L. pneumophila en cause et non l’ensemble des espèces de légionelles.
Il existe différentes méthodes que le Ministère de la Santé a testées et validées pour les réseaux d'eau potable. Ces méthodes figurent dans la circulaire 2002/243 d'avril 2002. On y trouve notamment :
Choc Peroxyde d'Hydrogène et Argent (H2O2+Ag)
Mise en circulation de la solution dans l'ensemble du réseau et points contaminés (hors utilisation). Concentration allant de 100 à 1000 mg/l de peroxyde d'hydrogène + Ag pour un temps de contact pouvant aller jusqu'à 12 heures. À l'issue du temps de contact, on pratique une vidange complète du réseau avant réutilisation.
- Avantages :
- élimination du biofilm,
- décomposition du produit en eau et oxygène, pas de pollution,
- pas d'accoutumance des bactéries ;
- Inconvénients :
- manipulation du produit, ces traitements sont bien souvent réalisés par des professionnels.
Choc thermique
- Avantages :
- pas d’équipements spéciaux (intérêt en cas d’épidémies),
- coût acceptable ;
- Inconvénients :
- procédure longue et difficile à mettre en œuvre (70 °C/30 minutes dans tout le réseau),
- risque de brûlure (une seconde à 70 °C),
- recolonisation bactérienne inéluctable (pas de caractère rémanent),
- impossibilité de mise en œuvre avec certains matériaux (aciers galvanisés, certains polymères...),
- augmentation des phénomènes d'entartrage et de corrosion.
Ultraviolets
Les rayons ultraviolets sont utilisés lors de la désinfection en terminal (au point d’usage) ou même sur des systèmes complets (eau d'appoint ainsi que dans le système).
- Avantages :
- facile à installer,
- sans produit, pas de manipulation,
- pas d’interférence avec eau et plomberie,
- retour sur investissement,
- sécurité de désinfection ;
- Inconvénients :
- pas d’activité résiduelle, d’où utilisation continue uniquement (coût à l'usage mais un coût qui s'avère moindre comparé aux produits utilisés normalement...),
- les UV, dans certaines conditions d’utilisation, peuvent dégrader certains oxydants (peroxyde d'hydrogène).
Hyperchloration
Deux approches : choc chloré (15 à 100 mg/l selon la procédure) et hyperchloration en continu (au moins 1 mg/l de chlore libre)
- Avantages : activité désinfectante résiduelle si traitement discontinu, traitement simple à mettre en œuvre.
- Inconvénients : corrosion et dommages sur plomberie, recolonisation bactérienne inéluctable après choc chloré, formation d’organo-chlorés.
Dioxyde de chlore
Gaz instable produit in situ, soluble dans l’eau, puissant oxydant (1 mg/l en continu)
- Avantages : activité rémanente importante, activité corrosive moins grande qu’avec les hypochlorites, pas de goût à l’eau, bon pouvoir pénétrant des biofilms, pas de formation d’organo-chlorés.
- Inconvénients : processus difficile, coûteux, générateur de chlorite et chlorate (potentiellement toxique).
Ozone
Gaz instable produit in situ. La vitesse de décomposition augmente avec la chaleur. Agit par oxydation et réaction radicalaire (inhibée par carbonates et phosphates et activée par les UV)
- Avantages : diminue de 1 à 2 logarithmes décimaux le nombre de légionelles, pas de corrosion, pas de tri-halo méthane.
- Inconvénients : pas d’effet rémanent, formation de sous-produits d’oxydation, process onéreux, production complexe.
Ionisation par cuivre-argent
Électrodes génératrices d’ions Cu2+ = 0,2-0,8 mg/l et Ag+ = 0,02-0,08 mg/l monitorage par spectrométrie d’absorption atomique
- Avantages : coût, installation et maintenance acceptables. Pas d’interférence avec eau à haute température, chlore et UV
- Inconvénients : Aucune société autorisée en France sauf AquaLyse[11] (du Canada) dont la technologie est installée en France sous condition par la DASS et l'AFSA.
Autres
- mélange peroxyde d’hydrogène – argent,
- mélange acide peracétique-eau oxygénée : 200-1000 mg/l
Aux États-Unis, tous les produits sus-cités sont autorisés pour la pratique de désinfection des circuits d’eau, mais dans les dernières recommandations du CDC publiées en 2003, pour le contrôle des infections liées à l’environnement dans les hôpitaux, en l’absence de preuve scientifique et de consensus sur leur efficacité, le traitement de l’eau par des désinfectants n’est pas recommandé[12].
Les tours aéroréfrigérantes
Quand
- niveau cible < 1 000 UFC/L Legionella Pneumophila
- niveau d’alerte ≥ 1 000 à < 10 000 UFC/L Legionella Pneumophila = nettoyage et désinfection
- niveau d’action ≥ 10 000 UFC/L Legionella Pneumophila = vidange puis nettoyage et désinfection (l'arrêt des installations n'est plus obligatoire)[13].
Comment traiter
Les traitements indiqués dans l'arrêté du puis renforcés dans les nouveaux arrêtés 2014 () relatif aux installations de refroidissement par dispersion d'eau dans un flux d'air sont principalement des actions préventives de traitement d'eau en continu, discontinu ou en choc, de nettoyage et de désinfection de l'installation. Ces traitements sont détaillés et expliqués dans des guides mis à disposition sur le site du ministère de l'écologie, du développement durable et de l'énergie[14].
Épidémies
La première épidémie reconnue de cette maladie, celle qui lui a donné son nom, est survenue en juillet 1976 à l'hôtel Bellevue-Stratford à Philadelphie aux États-Unis, durant un congrès de l'American Legion[15],[16]. Avec 34 décès, c'est à ce jour l'épidémie de légionellose qui a causé le plus de mortalité.
Une importante éclosion de légionellose (176 cas et 12 décès au ) est survenue dans la ville de Québec (Canada) à l'été 2012, amenant les autorités publiques à procéder à une inspection systématique des tours à refroidissement de la capitale provinciale et au nettoyage de celles-ci[17].
Conclusion
En conclusion, la prévention de la colonisation d’un réseau d’eau par Legionella pneumophila reste l’approche la plus sûre de la prévention des légionelloses ; la procédure de désinfection des circuits d’eau est beaucoup trop aléatoire d’autant plus que le réseau est âgé et donc corrodé et recouvert d’un biofilm bactérien. Les succès à court terme des procédures de désinfection sous forme de choc chimique ou thermique ne doivent pas masquer la recolonisation inéluctable à moyen terme.
Notes et références
Notes
- http://www.doctissimo.fr/html/dossiers/legionellose/1948-legionellose-climatisation.htm
- UFC/L = Unité formant colonie par litre d'eau
Références
- Légionellose, sur le site de l'Agence de santé publique du Canada, consulté le 5 janvier 2015
- La légionellose fait son retour en 2010, sur le site lequotidiendumedecin.fr du 19 juillet 2011
- http://www.cite-sciences.fr/fr/ressources/science-actualites/detail/news/legionellose-toujours-plus-depidemies/?tx_news_pi1%5Bcontroller%5D=News&tx_news_pi1%5Baction%5D=detail&cHash=d107bd00f4a9ed7a674c08a206984c6b
- (en) C.B. Fliermans, W.B. Cherry, H. Orrison, S.J. Smith, D.L. Tison, D.H. Pope, « Ecological distribution of Legionella pneumophila », Applied and Environmental Mictobiology, vol. 4, no 1, (lire en ligne)
- Circulaire DGS/SD7A/SD5C/DHOS/E4 n° 2002/243 du 22 avril 2002 relative à la prévention du risque lié aux légionelles dans les établissements de santé
- (en) Monica Rolando, Serena Sanulli, Christophe Rusniok, Laura Gomez-Valero, Clement Bertholet, Tobias Sahr, Raphael Margueron et Carmen Buchrieser, « Legionella pneumophila Effector RomA Uniquely Modifies Host Chromatin to Repress Gene Expression and Promote Intracellular Bacterial Replication », Cell Host & Microbe, vol. 13, no 4, , p. 395-405 (DOI 10.1016/j.chom.2013.03.004)
- (en) J.W. Costerton, « Introduction to biofilm », International Journal of Antimicrobial Agents, vol. 11,
- (en) Y. Lin, J.E. Stout, V.L. Yu, R.D. Vidic, « Disinfection of water distribution systems for Legionella », Seminars in Respiratory Infections, vol. 2, no 13,
- L. Simon, Ch. Rabaud, P. Di Majo, M.F. Blech, Ph. Hartemann, « Les procédures chimiques de désinfection d’un circuit d’eau à l’hôpital : avantages et inconvénients », Hygiènes, vol. VI, no 6,
- (en) L. Franzin, D. Cabodi, C. Fantino, « Literature review : efficacy of various disinfectants against Legionella in water systems », Water Research, no 36, (lire en ligne)
- (en) Facility Potable Water Energy Savings & Legionella Prevention since 2002, sur le site aqualyse.ca, consulté le 5 janvier 2015
- (en) Lynne Sehulster & Raymond Y.W. Chinn, « Guidelines for environnemental infection control in health-care facilities », M.M.W.R., vol. 52, no RR10, , p. 1-42 (lire en ligne)
- Guide comparatif des arrêtés 2004-2014 - évolution de la rubrique 2921 - Gestion du risque légionelle sur les tours de refroidissement (Anexo - coauteur Olivier DAUPTAIN)
- « Arrêté du 14 décembre 2013 relatif aux installations de refroidissement par dispersion d'eau dans un flux d'air soumises à autorisation au titre de la rubrique n° 2921 »(Archive • Wikiwix • Archive.is • Google • Que faire ?), sur le site anexo.fr, consulté le 5 janvier 2015
- (en) Fraser DW, Tsai TR, Orenstein W, Parkin WE, Brachman PS et al., « Legionnaires' disease: description of an epidemic of pneumonia », N Engl J Med, vol. 297, no 22, , p. 1189-97. (PMID 335244, DOI 10.1056/NEJM197712012972201)
- (en) « Legionnaires' Disease History », sur archive.org (consulté le 11 septembre 2012)
- Direction régionale de santé publique, « Éclosion de légionellose » [[https://web.archive.org/web/20121017100521/http://www.dspq.qc.ca/legionellose.html archive du <time class="nowrap" datetime="2012-10-17" data-sort-value="2012-10-17">17 octobre 2012</time>]] (consulté le 11 septembre 2012)
Voir aussi
Articles connexes
Liens externes
- blog sur la légionelle, la réglementation et les responsabilités
- Institut de veille sanitaire
- CHU de Rouen
- Une page de synthèse sur le sujet
- WHO | Legionella and the prevention of legionellosis
- Portail de la médecine
- Portail des maladies infectieuses