Insuffisance mitrale
L'insuffisance mitrale (ou fuite mitrale ou régurgitation mitrale) est une des maladies les plus fréquentes parmi les pathologies des valves cardiaques chez l'Homme et quelques autres espèces animales. Il s'agit d'une dysfonction de la valve mitrale consistant en un défaut de coaptation des deux feuillets de cette dernière, entraînant un reflux de sang du ventricule gauche dans l'atrium gauche pendant la phase d'expulsion du sang (systole) (voir schéma), au lieu d'aller dans l'aorte.
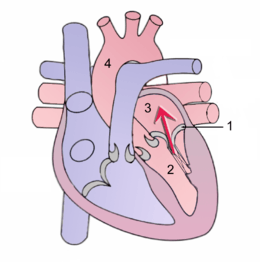
1. Valve mitrale — 2. Ventricule gauche — 3. Atrium gauche — 4. Aorte
| Spécialité | Génétique médicale |
|---|
| CIM-10 | I05.1, I34.0, Q23.3 |
|---|---|
| CIM-9 | 394.1, 424.0, 746.6 |
| DiseasesDB | 8275 |
| MedlinePlus | 000176 |
| eMedicine | 758816 |
| eMedicine | emerg/314 |
| MeSH | D008944 |
![]()
Les formes légères d'insuffisance mitrale sont très souvent découvertes lors d'examens cardiaques par échographie (échocardiographie), et sont en général sans conséquence. Les formes sévères nécessitent un examen approfondi, voire, dans certaines conditions, une opération chirurgicale.
Dans le passé, l’insuffisance mitrale était souvent la conséquence d'une infection à streptocoques, dans le cadre d'un rhumatisme articulaire aigu, maladie devenue rare dans les pays développés grâce à l'utilisation des antibiotiques. Dans les pays développés, les principales causes sont la maladie coronarienne, les cardiomyopathies, ou le prolapsus mitral. En outre, l'insuffisance mitrale peut survenir dans le contexte d'autres malformations congénitales du cœur, ou à la suite de maladies congénitales du tissu conjonctif.
L'insuffisance mitrale aiguë sévère, survenant comme complication d'un infarctus du myocarde, ou d'une inflammation des valves cardiaques, est un tableau clinique rare, mais dramatique, qui nécessite un traitement d'urgence, et qui ne peut souvent être maîtrisé que par une intervention chirurgicale en urgence.
Épidémiologie
Bien que ce soit l'une des maladies des valves les plus souvent diagnostiquées chez l'homme, sa fréquence ne peut être qu'estimée. Il n'existe que peu de statistiques basées sur des études de cohortes nombreuses d'hommes sains. Les données suivantes permettent une évaluation de l’ordre de grandeur avec lequel il faut compter :
- 8,6 % des enfants turcs sans symptôme cardiaque de moins de 18 ans ont présenté à l'échocardiographie une insuffisance mitrale[1].
- Dans les maladies rhumatismales chez les enfants et les jeunes des pays en développement, l’insuffisance mitrale est l'atteinte cardiaque la plus fréquente[2].
- Une étude prospective en Grande-Bretagne a donné chez les enfants et jeunes de 3 à 18 ans une prévalence de 1,82 %. Aucun des enfants diagnostiqués n'avait moins de 7 ans[3]. D'autres enquêtes (États-Unis) ont donné une prévalence de 2,4 % chez les enfants et jeunes de 0 à 14 ans sans symptômes cardiaques[4].
- Presque un cinquième des 3,589 personnes qui ont été étudiées dans le cadre de l'étude de Framingham avaient une insuffisance mitrale. Il n'y avait pas de différence entre les sexes : une insuffisance de la valve au moins légère se montrait à l'échocardiographie chez 19 % des hommes et 19,1 % des femmes[5].
- Chez 11 à 59 % de tous les patients après un infarctus du myocarde a été démontrée une insuffisance mitrale [6].
- Chez 89 % des patients de plus de 79 ans avec une insuffisance cardiaque (fraction d'éjection < 40 %), il a été établi une insuffisance mitrale, atteignant chez 20 % une importance substantielle (degré de sévérité III ou IV)[7].
- Avec 31 % de toutes les opérations sur les valves cardiaques, l'insuffisance mitrale arrive en second rang de toutes les insuffisances des valves cardiaques.
- Une étude japonaise sur 211 volontaires sains de 6 à 46 ans a montré une prévalence de l'insuffisance mitrale de 38 à 45 % dans toutes les tranches d'âge étudiées, sans distinction de degré de sévérité et de conséquences adverses sur la physiologie[8].
Anatomie et physiopathologie
La valve mitrale est une valve constituée de deux feuillets, un « petit » ou « postérieur » et un « grand » ou « antérieur ». Elle sépare l'atrium gauche du ventricule gauche, et fonctionne comme une soupape.
Elle est constituée d'un anneau fibreux, des feuillets proprement dits, reliés au muscle du ventricule gauche par des piliers musculaires, par l'intermédiaire de cordages fibreux.
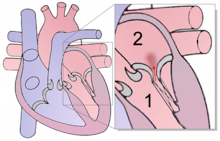
L'ombre au bout de la flèche rouge symbolise le reflux sanguin
1 Ventricule gauche — 2 Atrium gauche
Il s'agit d'un élément passif, dont l'ouverture ou la fermeture est réglée par la différence de pression entre l'atrium gauche et le ventricule gauche. Quand cette différence est positive (pression supérieure dans l'atrium gauche), ce qui correspond à la phase de dilatation du ventricule (diastole) la valve est ouverte permettant le passage du sang de l'atrium vers le ventricule. Au début de la contraction de ce dernier (systole), la pression y remonte soudain, la valve se ferme, garantit l'étanchéité de l'atrium, et empêche le reflux. De cette manière, il ne règne dans l’atrium qu'une pression d'environ 8 mmHg (11 mbar), tandis que la pression systolique d'environ 120 mmHg (160 mbar) envoie le sang dans son trajet physiologique normal, l’aorte.
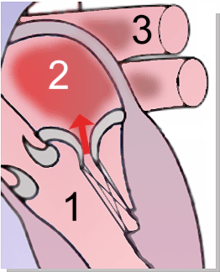
1 Ventricule gauche — 2 Atrium gauche — 3 Veine pulmonaire
En cas de légère insuffisance mitrale, ces processus physiologiques ne sont que faiblement affectés. Ni la taille du manque d'étanchéité, ni le volume de sang refluant (volume de régurgitation) n'atteignent des niveaux significatifs, si bien que la pression dans l'atrium gauche et dans les veines pulmonaires qui y débouchent restent aussi normales que le rendement du cœur.
En cas de fuite mitrale sévère, la surface de la valve restant ouverte dépasse 4 mm2, une partie importante du sang éjectée, lors de la systole ventriculaire, reflue dans l'atrium gauche, au lieu d'aller dans l'aorte. Le volume de reflux est de plus de 60 ml, et diminue d'autant le débit cardiaque. Par conséquent, pour un même débit dans l’aorte, le travail du muscle cardiaque va être supérieur.
Au stade aigu, avec une taille normale du ventricule gauche et de l’atrium gauche, celui-ci va se distendre, avec une augmentation de sa pression qui peut se répercuter plus en amont, dans les veines pulmonaires. Elle peut monter jusqu’à 100 mmHg (130 mbar), ce qui, pour une constitution normale des vaisseaux pulmonaires, conduit immédiatement à un œdème pulmonaire. En outre, ce reflux exagéré de sang provoque une baisse du débit cardiaque, et donc une circulation insuffisante dans tous les organes.
Si le stade aigu est vaincu, ou si l'insuffisance mitrale se développe sur un temps assez long, il se produit une série chronique d'adaptations (mécanismes de compensation) du cœur et des vaisseaux pulmonaires. D'abord, la charge permanente de pression et de distension de l’atrium conduit à sa dilatation, et son volume, au cours des mois et des années peut atteindre trois ou quatre fois sa valeur initiale. Cette dilatation, dans le temps, réduit aussi l'effet d'accroissement de pression du volume de régurgitation dans la circulation pulmonaire. En outre, la surcharge volumique conduit aussi à une dilatation du ventricule gauche, qui, à chaque battement du cœur, doit fournir, outre la quantité de sang nécessaire à l'organisme, également le volume de la régurgitation. Cette dilatation peut d'une part augmenter le volume des battements, par le mécanisme de Frank-Starling, mais elle conduit d'autre part à un cercle vicieux, parce que l'agrandissement du ventricule change la géométrie de la valve mitrale, et augmente encore de cette façon son insuffisance.
Classification et nomenclature
La classification des insuffisances mitrales n'est pas adoptée de manière uniforme, en raison de considérations et de découvertes sans cesse renouvelées, si bien que la nomenclature dans chaque cas peut être inappropriée. Dans la dernière décennie, la différence entre insuffisances mitrales « fonctionnelle » et « organique » a gagné de l'importance[9]. Les déficiences dont la cause est identifiée comme conséquence des modifications de la valve elle-même sont classées ainsi comme organiques (ou valvulaires). Une déficience fonctionnelle, par contre, est la conséquence de modifications des structures environnantes, en particulier du ventricule gauche, sans anomalie de la valve elle-même.
Une faible fuite mitrale, sans conséquence clinique, peut être détectée au moyen de procédés sensibles chez presque 90 % des adultes sains sur le plan cardiaque. Il est souvent appelé « insuffisance mitrale physiologique » ou « régurgitation mitrale minime ». Chez l'enfant et le jeune, la différence peut être faite par le moment de la régurgitation : dans la véritable insuffisance mitrale, la régurgitation a lieu après la fermeture de la valve, tandis que la régurgitation pendant la fermeture est considérée comme physiologique. Cette distinction est parfois non valable, car la régurgitation pendant la fermeture de la valve peut atteindre des valeurs importantes.
Les « vraies » insuffisances mitrales sont usuellement classées par degré de sévérité: légère, moyenne ou sévère, ou en quatre valeurs (du degré I au degré IV).
Les insuffisances mitrales primaires ou primitives sont également diagnostiquées, par lésion de la valve, et les insuffisances secondaires, sans atteinte visible de la valve. Parmi les causes d'insuffisance primaire sont le rhumatisme articulaire aigu et les causes dégénératives. Les principales causes secondaires sont l'insuffisance cardiaque (par dilatation de l'anneau) et les cardiopathies ischémiques, par dysfonction d'un pilier.
Une autre classification fait intervenir le niveau du défaut de coaptation des deux feuillets : au-dessous du plan de l'anneau (c'est-à-dire dans le ventricule gauche), il est question d'insuffisance mitrale restrictive. Au niveau du plan de l'anneau, le mécanisme le plus fréquent est une dilatation de l'anneau, comme lors d'une cardiomyopathie dilatée. Au-dessus du plan de l'anneau, il est alors question de prolapsus mitral.
Causes
L’insuffisance mitrale congénitale, comme la fissuration du feuillet antérieur et l’insuffisance mitrale rhumatismale, conséquence d'un rhumatisme articulaire aigu, sont devenues assez rares dans les pays développés, bien qu'elles restent importantes dans les pays en développement. Dans les pays développés, les causes incluent :
- l'insuffisance mitrale après infarctus du myocarde
- l'insuffisance mitrale ischémique en raison de la nécrose de pilier mitral ou de dilatation post-ischémique du ventricule gauche.
- l'insuffisance mitrale relative ou fonctionnelle, à la suite d'une dilatation du ventricule gauche et
- l'insuffisance mitrale par prolapsus mitral, souvent congénital.
En outre, une endocardite souvent bactérienne, mais pas toujours, peut conduire à une destruction par déchirure ou perforation ou encore à un rétrécissement cicatriciel du tissu de la valve, et ainsi à une insuffisance mitrale.
Un cas particulier est la survenue d'une obstruction systolique de la valve aortique par un bourrelet cicatriciel sur le septum inter-ventriculaire, à la suite d'une cardiomyopathie hypertrophique obstructive.
L'insuffisance mitrale aiguë a pour principales causes l'endocardite infectieuse, et la rupture d'un cordage ou d'un pilier le plus souvent sur une valve déjà malade, mais aussi lors d'un infarctus du myocarde.
L'insuffisance mitrale congénitale peut être dans certains cas la suite d'une fissure du feuillet antérieur, ou d'une conformation défectueuse (dysplasie) de la valve, mais plus souvent comme un aspect de la conformation pathologique globale du cœur, avec par exemple une transposition des gros vaisseaux, une transposition corrigée des gros vaisseaux, un ventricule droit à double sortie, une communication inter-auriculaire ou inter-ventriculaire[10]. Des cordages accessoires superflus peuvent conduire au déplacement d'un feuillet mitral vers le ventricule et provoquer ainsi une insuffisance mitrale.
Une insuffisance mitrale peut aussi être la conséquence de maladies congénitales du tissu conjonctif, comme le syndrome de Marfan ou celui d'Ehlers-Danlos[11]. D'autres maladies congénitales du métabolisme (Syndrome de Hurler, ou Mucopolysaccharidose de type I) peuvent aussi conduire à une insuffisance mitrale[12].
Une forme relativement fréquente d'insuffisance mitrale est provoquée par des médicaments cardiotoxiques (toxiques pour le cœur). Le dommage primaire au cœur est une cardiomyopathie, par exemple dans les chimiothérapies contre le cancer avec utilisation d'anthracyclines comme la doxorubicine ou la daunorubicine. À l'échocardiographie, l'insuffisance mitrale est souvent le premier signe diagnostic d'une atteinte au myocarde : 11,6 % des enfants et jeunes traités avec une anthracycline développent une insuffisance mitrale asymptomatique contre 1,8 % des non-traités. Tous les patients concernés possédaient une fonction ventriculaire gauche normale au moment de l’examen : mais 4 sur les 34 présentèrent une insuffisance cardiaque gauche manifeste dans les 5 à 27 mois après le diagnostic de l'insuffisance mitrale[13]. Les irradiations du médiastin, comme dans le cas de la radiothérapie de la maladie de Hodgkin peuvent aussi conduire à une insuffisance mitrale[14].
Tableau clinique
La fuite mitrale peut ne présenter aucun signe (asymptomatique) ou se manifester par une fatigabilité et un essoufflement en rapport avec une insuffisance cardiaque débutante. Souvent, lors d'insuffisance mitrale, peuvent se manifester des troubles du rythme cardiaque : extrasystoles ou tachycardie.
Examen clinique
Le signe le plus important et indicatif lors de l’auscultation cardiaque thoracique est un souffle cardiaque systolique, qualifié de doux, neutre, dans la bande des hautes fréquences. Il est systolique, typiquement débutant au premier bruit du cœur et s'achevant au deuxième bruit (« holosystolique »), plus perceptible vers la pointe du cœur, mais qui se poursuit jusque vers l'aisselle gauche. Il n'irradie pas dans les carotides. Il se distingue ainsi par ses caractéristiques du souffle de rétrécissement aortique. En outre, s'il y a dilatation du ventricule gauche, le souffle peut être déplacé par rapport à sa position physiologique, jusqu'à sous l'aisselle, suivant le choc de pointe.
En cas d'œdème pulmonaire, des râles pulmonaires crépitants sont également audibles à l'auscultation, et s'il y a une insuffisance cardiaque droite secondaire, une congestion des veines jugulaires externes (turgescence jugulaire) et des œdèmes sont constatées, notamment au niveau des membres inférieurs.
Chez les enfants, les symptômes d'insuffisance mitrale ne diffèrent pas de ceux des adultes et la sévérité des symptômes est corrélée avec celle de la fuite. Mais ils sont d'autant plus graves et d'évolution plus rapide que l’enfant est jeune. Chez les petits enfants et nouveau-nés, il peut exister un retard de croissance ou même l'interruption de la croissance malgré une alimentation suffisante. En outre, des infections récurrentes pulmonaires peuvent faire penser à une insuffisance mitrale, la bronche souche gauche pouvant être comprimée par l'accroissement de volume de l'atrium gauche, réduisant la ventilation du poumon gauche.
Examens para-cliniques
Ces examens permettent de confirmer le diagnostic suspecté par l'auscultation cardiaque et de quantifier (ou d'avoir une appréciation semi quantitative) de la sévérité de la fuite et de son retentissement sur les cavités cardiaques.
Échocardiographie
 Insuffisance sévère |
 Légende |
| 1 : Atrium gauche – 2 : Jet de régurgitation
LV : Ventricule gauche – RV : Ventricule droit – RA : Atrium droit | |
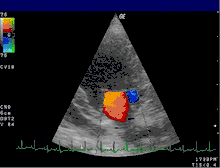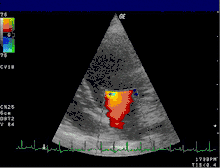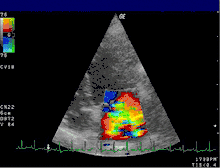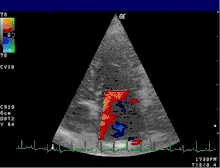
L'échocardiographie reste l'examen clé. Il permet de visualiser la valve (épaisseur, présence d'un prolapus...) et d'évaluer le retentissement de la fuite sur les différentes cavités : dilatation de l'atrium gauche et/ou du ventricule gauche, altération de la fonction systolique avec diminution de la fraction d'éjection. En outre, l'échocardiographie permet le plus souvent d'étayer les hypothèses sur le mécanisme de l’insuffisance (dilatation de l’anneau, fermeture incomplète de la valve, endocardite, prolapsus, retournement du bord du feuillet (flail leaflet), et la localisation des éventuelles anomalies. Si besoin, l'examen peut être complété d'une échographie transœsophagienne permettant de mieux visualiser les différentes structures composant la valve.
L'échocardiographie Doppler (voir figure) permet de visualiser les vitesses du sang sous forme de codage en couleurs. Il permet ainsi de visualiser le jet de l'insuffisance mitrale dans l'atrium gauche. Les dimensions de ce jet permettent déjà une estimation grossière du degré de sévérité de l'insuffisance.
| Degré | Légère | Moyenne | Sévère |
|---|---|---|---|
| Largeur atrium | ≤ 4,0 cm | >4 cm | |
| Surface jet | < 4 cm2 | 4 à 8 cm2 | >8 cm2 |
| Longueur jet/largeur atrium | < 0,2 | 0,2 – 0,4 | >0,4 |
| Longueur jet/longueur atrium | <1/3 | 1/3 – 2/3 | > 2/3 |
| Largeur proximale jet | <0,3 cm | 0,3 à 0,69 cm | ≥0,7 cm |
| Volume régurgité | < 30 ml | 30 – 59 ml | ≥ 60 ml |
| Ouverture régurgitation | < 0,2 cm2 | 0,2 à 0,39 cm2 | ≥ 0,4 cm2 |
L'échocardiographie permet en outre d'examiner la taille du ventricule gauche et son fonctionnement en tant que pompe. Ces caractéristiques importantes sur la fonction cardiaque sont nécessaires pour déterminer le moment optimal d'une opération éventuelle sur la valve.
La détermination du degré de sévérité d'une insuffisance mitrale au moyen de l'échocardiographie a gagné dans les 20 dernières années une fiabilité considérable. L'échocardiographie permet en règle générale de mesurer divers paramètres corrélés de manière plus ou moins bonne avec le degré de la fuite. Dans les insuffisances organiques, en particulier dans le cas de prolapsus mitral, son étendue est régulièrement estimée avec la méthode de la zone de convergence[16].
Chez les enfants également, l'échocardiographie est le moyen diagnostic de choix. La division en degrés de sévérité au moyen de paramètres mesurés par l'échocardiographie n'a pas été validée de manière comparable à celle des adultes.
Autres méthodes
Les autres méthodes d'investigation ne sont nécessaires que pour l'analyse de complications éventuelles, ou dans le cadre du bilan pré-opératoire. C'est ainsi que l'électrocardiogramme, ou éventuellement l’électrocardiogramme à longue durée (Holter) peuvent aider au diagnostic de perturbations du rythme cardiaque, ou montrer des anomalies pouvant évoquer une cause à la fuite mitrale (infarctus du myocarde par exemple). l'électrocardiogramme peut cependant être strictement normal, même en cas de fuite importante.
La radiographie du thorax ne montre pas de signe spécifique : éventuellement augmentation de la taille du cœur et surcharge vasculaire suivant le retentissement de la fuite mitrale.
La coronarographie permet de compléter le bilan si une solution chirurgicale est envisagée. Elle est obligatoire chez le patient âgé ou ayant des facteurs de risque cardio-vasculaire afin de dépister une maladie coronarienne pouvant être traité dans un même temps par pontage aorto-coronarien. L'injection d'un produit de contraste dans le ventricule gauche (ventriculographie) permet de visualiser la fuite mitrale et d'en faire une estimation semi quantitative. Un cathétérisme cardiaque peut également être appliqué pour diagnostiquer et quantifier l'insuffisance mitrale.
Évolution
L'évolution d'une insuffisance mitrale est extrêmement variable et difficilement prévisible. Même une insuffisance sévère peut rester pendant de nombreuses années stabilisée (inchangée), comme c'est la règle pour les insuffisances légères. Des examens de contrôle réguliers, par exemple annuels, peuvent seuls donner une indication sur l'évolution individuelle. Le degré de sévérité de l'insuffisance, la taille et la fonction de pompe du ventricule gauche ainsi que d'autres signes prémonitoires d'une surcharge cardiaque seront surtout examinés pour reconnaître à temps les signes d'une dégradation. Ces « paramètres de suivi » sont des points d'appui importants pour la planification optimale d'un traitement.
Chez les enfants, en particulier les tout-petits et nouveau-nés, l'insuffisance mitrale évolue plus gravement et plus rapidement que chez l'adulte ou le jeune. La plupart du temps, dans les trois ans suivant le diagnostic d'une insuffisance mitrale, apparaît une insuffisance cardiaque manifeste.
Traitement
La prise en charge de l'insuffisance mitrale a fait l'objet de la publication de recommandation par des sociétés savantes. Celles, américaines, datent de 1998 révisées en 2014[17].
Le traitement dépend de l'importance de la fuite, de son retentissement sur le ventricule gauche et du terrain.
Tous les patients avec une insuffisance mitrale vraie (et pas seulement physiologique) courent un risque supérieur de développer une endocardite bactérienne. C'est pour cette raison que les sociétés médicales recommandent depuis des décennies une prévention (prophylaxie) de l'endocardite avant des interventions telles qu'une coloscopie ou une extraction dentaire, pendant lesquelles des bactéries peuvent pénétrer dans la circulation sanguine. Alors que les lignes directrices européennes et allemandes contiennent cette recommandation, elle est limitée depuis 2007 par l'American Heart Association (AHA) aux patients à haut risque, avec une valve artificielle, ou qui présentent des antécédents d'endocardite[18].
Une fuite minime ou modérée n'a aucune conséquence, il n'y a pas besoin de traitement, mais une simple surveillance.
Dans l'enfance, des examens de contrôle réguliers par échocardiographie tous les 6 à 12 mois sont indiqués.
Traitement médicamenteux
Une fuite moyenne ou sévère avec des symptômes d'insuffisance cardiaque justifie d'un traitement médicamenteux selon les lignes directrices de la lutte contre cette dernière (inhibiteurs de l'enzyme de conversion ou Antagoniste des récepteurs de l'angiotensine II). Le bénéfice d'un traitement à long terme avec ces médicaments lourds pour des patients asymptomatiques et à faible insuffisance cardiaque est encore discuté. Dans le cas de perturbations du rythme cardiaque, il peut être intéressant de proposer des antiarythmiques pour, au moins, améliorer la qualité de vie.
Selon l'accroissement de volume de l’atrium gauche, il peut être nécessaire de procéder à un traitement anticoagulant pour éviter la formation d'un caillot à l’intérieur de l’atrium gauche agrandi.
En cas d'insuffisance cardiaque sévère, le traitement doit être pratiqué en urgence. Le but de la thérapie médicamenteuse est dans ce cas la minimisation du volume de régurgitation, pour augmenter le flux utile, et éviter l'œdème pulmonaire. Chez les patients à tension artérielle normale, ceci peut être obtenu avec des vasodilatateurs intra-veineux (type dérivés nitrés, mais dans le cas d'hypotension, la prescription de ces derniers n'est pas possible et il faut administrer des catécholamines, comme la dobutamine. Ces patients peuvent tirer également profit de l'utilisation d'un ballon de contre-pulsion intra-aortique, qui peut contribuer à une stabilisation, dans la phase préparatoire à une opération nécessaire de la valve.
Chez les enfants, le début de la mise en place d'un traitement dépend du degré de sévérité, et des résultats des contrôles échocardiographiques. Le but thérapeutique primaire est l'abaissement de la charge des muscles du ventricule gauche. Comme pour les adultes, des inhibiteurs de l'enzyme de conversion sont principalement utilisés ; en outre, des diurétiques et des extraits de digitale (digoxine, digitoxine) sont utilisés.
Traitement chirurgical
Historique
La première cure a été faite en 1951 et consistait en un resserrage de l'anneau mitral, sans ouverture du cœur[19]. La technique est améliorée à la fin des années 1950, avec suture directe de l'anneau sous les premières circulations extra-corporelles[20]. Le premier remplacement valvulaire a été publié en 1961[21].
Indication
Une opération de la valve est indiquée quand il est démontré que les troubles causés par l'insuffisance mitrale ne peuvent être éliminés par voie médicamenteuse, et tant qu'il n'y a pas d'altération trop sévère de la fonction systolique (tant que la fraction d'éjection est supérieure à 30 %).
Chez les patients asymptomatiques avec insuffisance mitrale sévère, l'opération est conseillée lorsque des signes de surcharge du cœur sont présents. Ceci est le cas dans le cas de fonction de pompage réduite (fraction d'éjection inférieure à 60 %), ou une dilatation notable du ventricule gauche (diamètre interne en fin de systole supérieur à 45 mm), ou encore après constatation d'une hypertension artérielle pulmonaire (pression artérielle pulmonaire systolique supérieure à 50 mmHg (67 mbar) au repos ou à 60 mmHg (80 mbar) à l'effort). Pour une opération de reconstruction de la valve mitrale, l'indication peut être prise avec des valeurs moins strictes, car il faut attendre une meilleure amélioration par l'opération.
En cas de doute, l'hémodynamique d'effort, c'est-à-dire le changement des valeurs de pression et de fonction de pompe du cœur sous l'effet de l'effort physique, peut aider à poser l’indication initiale d'opération.
Une prise en charge chirurgicale systématique des formes importantes, même asymptomatique, semble cependant entraîner un meilleur pronostic à long terme[22].
Types de réparation
Le traitement chirurgical peut consister soit en une reconstruction valvulaire (plastie mitrale), soit par remplacement de la valve mitrale par une prothèse (valve artificielle) : valve mécanique ou bioprothèse valvulaire. Dans les deux cas, il nécessite l'ouverture du cœur, et donc, l'arrêt transitoire de ce dernier et la mise en place d'une circulation extra-corporelle. Dans tous les cas l'abord est faite par une sternotomie médiane.
Fondamentalement, la reconstruction est préférable, plus physiologique et avec des résultats à long terme bien supérieur sans l'inconvénient de la nécessité d'un traitement anticoagulant (pour le cas d'une prothèse mécanique). Mais elle peut être impossible, dans le cas de feuillets fortement rétrécis, calcifiés, voire détruits, si bien que dans ce cas, seule une prothèse peut être envisagée. Les chances d'une reconstruction de valve peuvent être estimées à l'avance au moyen de l'échocardiographie, et il est peu fréquent que la nécessité de poser une prothèse apparaisse seulement au cours de l'opération.
Dans le cas d'une insuffisance mitrale fonctionnelle peut-être proposée une annuloplastie consistant à rétrécir l'anneau mitral avec un galbe synthétique[23], sans gain démontré cependant, en termes de mortalité[24].
Les patients avec une prothèse de valve mitrale mécanique ont besoin d'un traitement anticoagulant à long terme.
Un troisième type de traitement est une approche percutanée, sans nécessité de circulation extracorporelle, consistant en un rapprochement des feuillets mitraux par un système d'agrafes. Cette technique laisse une fuite résiduelle plus importante que lors d'une chirurgie classique mais comporte moins d'accidents que cette dernière[25]. Elle peut être proposée à certains patients fragiles pour lesquels le risque opératoire est jugé trop important.
Particularités chez les enfants
En raison de la progression souvent plus rapide de l’insuffisance mitrale chez les enfants, une opération chirurgicale est plus souvent nécessaire. Par comparaison avec celle pour les adultes, elle pose des problèmes supplémentaires :
la mise en place d'une prothèse chez des enfants avant que le cœur n'atteigne sa taille définitive au moment de la puberté va nécessiter une ou plusieurs opérations successives, afin d'ajuster la dimension de la prothèse à celle du cœur. Ceci n'est pas possible sans limitations.
La nécessité absolue d'administrer une médication anticoagulante en présence d'une prothèse présente pour les enfants avant la puberté des difficultés importantes en ce qui concerne les complications de saignement. En particulier les petits enfants ont du mal à obéir aux règles de conduite nécessaires pour éviter ces saignements pendant le traitement à long terme par anticoagulants. Comme le traitement anticoagulant après pose d'une prothèse chez le jeune doit être poursuivi pendant de longues périodes, l'indication de pose d'une prothèse doit être pesée avec un soin particulier.
Cependant, pour des enfants dont l’insuffisance mitrale doit être opérée, il faut à long terme se résoudre à poser une prothèse. Le pronostic à court et moyen terme dans ce cas est néanmoins bon[10]. À long terme, il n'est que moyen, en raison de la survenue de multiples troubles de la conduction cardiaque et d'insuffisance ventriculaire gauche, qui nécessitent à leur tour un traitement, ce qui entraîne les taux de morbidité et de mortalité correspondants[26].
C'est pourquoi on essaiera – autant que possible – tout d'abord une reconstruction de la valve sans utilisation de prothèse[27],[28]. Il n'existe pas encore de critères sûrs et indubitables pour déterminer le moment de la pose d'une prothèse valvulaire chez l'enfant.
Traitement par voie endo-vasculaire
Il consiste à introduire une sonde dans le ventricule gauche (le plus souvent par l'artère fémorale), munie d'une « agrafeuse » et de joindre les deux feuillets de la valve mitrale par un clip (« Mitraclip »), diminuant ainsi la taille de la fuite. Cette intervention ne nécessite pas d'ouverture cardiaque et de circulation extra-corporelle et peut-être théoriquement proposé à des patients plus fragiles, dits à « hauts risques chirurgicaux ». La méthode est inspirée de l'intervention d'Alfieri, technique chirurgicale combinant la mise en place d'une suture mitrale et d'une annuloplastie permettant de réduire la taille de l'anneau mitral[29]. Le traitement par voie endo-vasculaire ne comporte pas d'annuloplastie.
Il n'a été testé que chez des patients jugés « non opérables ». les résultats sont imparfaits avec la persistance d'une fuite mitrale conséquente dans un peu moins de la moitié des cas. Il existe cependant une amélioration des symptômes et une diminution de la taille du ventricule gauche (par rapport à un traitement uniquement médicamenteux)[30].
Pronostic
En raison de l’évolution très différente de l’insuffisance mitrale chez les patients, le pronostic est très variable. Les patients souffrant d'une légère insuffisance mitrale, sans autre maladie cardiaque, ont une espérance de vie normale.
Les patients pour lesquels l'indication d'une opération a été posée ont eu un taux de survie à 8 ans de 89 %. Les statistiques des années 1980 à 1989 montrent que le pronostic dépend fortement de la fonction de pompe du ventricule gauche(fraction d'éjection) avant l'opération : les taux de survie à dix ans en fonction de la fraction d'éjection (FE) s'établissent ainsi :
| FE | Survie à 10 ans |
|---|---|
| FE > 60 % | 89 % |
| 60 % > FE > 50 % | 53 % |
| 50 % < FE | 32 % |
Le niveau de survie est estimé à dix ans avec une FE normale avant l'opération ne diffère pas de celui de leurs contemporains sans opération cardiaque, tandis que ce taux s'effondre quand cette FE diminue[31].
Les cas de mort subite sont rares chez les patients avec insuffisance mitrale : ils ont lieu chez des patients avec rupture des cordages avec une fréquence de 0,8 % par an, tandis pour ceux ayant simultanément une fibrillation auriculaire, elle s'élève à 4,8 % par an.
Chez les animaux
L'insuffisance mitrale chez les chiens et les chats compte parmi les maladies cardiaques acquises les plus fréquentes. Chez les chiens, l'insuffisance mitrale organique à la suite d'une modification dégénérative de la structure de base du collagène du feuillet (endocardiose valvulaire) se situe même en tête des maladies cardiaques diagnostiquées, avec un pourcentage de 40 %. À côté, le tableau de la maladie apparaît régulièrement comme conséquence d'une cardiomyopathie chez les chiens et les chats et peut déclencher des complications sévères comme la fibrillation auriculaire chez le chien et la thrombose veineuse profonde chez le chat.
Chiens


Ce sont avant tout les représentants des plus petites races de chiens qui sont sujets aux maladies dégénératives chroniques de la valve mitrale. Parmi les races souvent concernées, citons entre autres le cavalier King Charles Spaniel, le caniche, le chihuahua, le pékinois, le fox-terrier et le cocker spaniel anglais. La prévalence de la maladie au sein d'une population de chiens tourne autour de 10 % chez les animaux de 5 à 8 ans, et augmente avec l’âge, si bien qu'à 13 ans, 30 à 35 % des animaux sont touchés[32]. Pour la fréquence de survenue comme conséquence de cardiomyopathie, il n'y a pas de données, mais l'insuffisance mitrale est très souvent constatée comme conséquence de l'extension pathologique de l'anneau auquel la valve est suspendue. Dans de rares cas, ce sont des infections bactériennes de la valve mitrale qui provoquent l’insuffisance.
Les signes les plus fréquents d'une capacité cardiaque diminuée sont : la diminution des performances, la toux, les troubles nocturnes et la dyspnée. À l'auscultation, on[Qui ?] peut entendre dans la plupart des cas des bruits cardiaques holosystoliques d'intensité constante, de force des plus variables (degrés 1 à 6). Le bruit maximum de la valve mitrale (punctum maximum) est chez le chien dans le 5e espace intercostal, au niveau de la pointe du cœur. À la radio, un cœur dilaté peut être constaté. L'atrium gauche peut alors revêtir la forme d'un triangle (« triangle mitral ») décalé en direction caudo-dorsale. L'angle usuel entre les bronches et la colonne vertébrale peut disparaître en un trajet parallèle, et même l'atrium peut comprimer les bronches et l'irritation mécanique augmente alors les symptômes de toux. Dans les cas avancés, un œdème pulmonaire est diagnostiqué. L'électrocardiogramme est en général peu spécifique, il y a en partie des suggestions d'atrium dilaté (onde P allongée, au-delà de 0,04 s) ou d'un ventricule dilaté (complexe QRS plus long que 0,06 s). En outre, il peut y avoir des extrasystoles auriculaires ou ventriculaires, parfois une fibrillation auriculaire. Ce symptôme est fréquent chez les chiens avec une insuffisance mitrale fonctionnelle due à une cardiomyopathie dilatative. À l'échocardiographie Doppler, il est facile de reconnaître une insuffisance mitrale. Les autres conséquences qui surviennent sont : un élargissement du ventricule en raison de la surcharge en volume, souvent une hypercontractibilité en raison de mécanismes de compensation, et une oreillette substantiellement agrandie.
Selon le degré de sévérité de la maladie, elle évolue selon divers schémas. Après des années sans symptômes ou avec de faibles symptômes, le chien peut voir sa maladie se renforcer en l'espace de quelques mois. Ceci se caractérise par la classification NYHA ou ISACHC. Le traitement médicamenteux commence d'habitude avec la survenue des premiers symptômes.
Pour des maladies sévères de la valve mitrale, le sang peut refluer à haute pression et surmener la paroi de l’atrium dans la région où le jet la frappe, au point d'aboutir à sa rupture. En outre, le tableau clinique peut en être à ce point détérioré que les cordages qui retiennent la valve pendant la systole peuvent céder, et qu'un accident arrive à la valve.
Le traitement actuellement usuel de l'insuffisance mitrale repose, selon le degré de sévérité, sur l'utilisation de Pimobendan (de), d'inhibiteurs de l'enzyme de conversion et de diurétiques[33]. Contrairement à ce qui se fait pour l'homme, le traitement chirurgical des maladies valvulaires dégénératives n'a pu s'implanter, en raison – outre le coût financier et technique – d'un fort taux de mortalité lié à l'opération constaté pour les animaux ainsi traités.
Autres espèces
Chez les chats, les insuffisances mitrales sont significativement plus rares que chez le chien. Elles sont le plus souvent fonctionnelles, et conséquences de cardiomyopathies. Un cas particulier relativement fréquent est l'insuffisance liée à une sténose aortique par épaississement du muscle cardiaque dans la région d'éjection du ventricule gauche. Rarement surviennent aussi chez les chats des maladies organiques de la valve mitrale à la suite d'une fibrose de l’endocarde.
Comme autre espèce animale, citons les chevaux qui sont régulièrement frappés d'insuffisance mitrale. Environ 45 % des chevaux ayant un souffle cardiaque ont une insuffisance mitrale, dont la cause paraît souvent être une endocardiose, analogue à celle des chiens. Il est estimé que 3 à 4 % de chevaux sont atteints d'insuffisance mitrale[34].
Chez le lapin, la survenue du tableau clinique a également été signalée.
Notes et références
- (en) C. Ayabakan et al., « The Doppler echocardiographic assessment of valvular regurgitation in normal children », Turk J Pediatr, vol. 45, , p. 102-107. (PMID 12921295)
- (en) K. C. Bahadur et al., « Prevalence of rheumatic and congenital heart disease in schoolchildren of Kathmandu valley in Nepal », Indian Heart J, vol. 55, no 6, , p. 615-618. (PMID 14989511)
- (en) J. D. Thomson et al., « Left sided valvar regurgitation in normal children and adolescents », Heart, vol. 83, no 2, , p. 185-187. (PMID 10648494)
- (en) A. Brand et al., « The prevalence of valvular regurgitation in children with structurally normal hearts: a color Doppler echocardiographic study », Am Heart J, vol. 123, no 1, , p. 177-180. (PMID 1729823)
- (en) J. P. Singh et al., « Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study) », Am J Cardiol, vol. 83, , p. 897-902. (PMID 10190406)
- (en) F. Bursi et al., « Mitral regurgitation after myocardial infarction: a review », Am J Med, vol. 119, , p. 103-112. (PMID 16443408)
- (en) G. Cioffi et coll., « Functional mitral regurgitation predicts 1-year mortality in elderly patients with systolic chronic heart failure. », Eur J Heart Fail, vol. 7, , p. 1112-1117 (PMID 15919238)
- (en) K. Yoshida et coll., « Color Doppler evaluation of valvular regurgitation in normal subjects. », Circulation., vol. 78, no 4, , p. 840-847 (PMID 3262454)
- (de) T. Buck et R. Erbel, « Fortschritte in der Diagnostik und Therapie der Mitralklappeninsuffizienz », Herz,
- (en) G. D. Webb et al., « Congenital Heart Disease », dans D. P. Zipes et al., Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine, Philadelphia, W.B. Saunders Company, (ISBN 1-41-600014-3)
- (en) C. D. van Karnebeek et al., « Natural history of cardiovascular manifestations in Marfan syndrome », Arch Dis Child, vol. 84, no 2, , p. 129-137. (PMID 11159287)
- (en) C. F. Wippermann et coll., « Mitral and aortic regurgitation in 84 patients with mucopolysaccharidoses. », Eur J Pediatr., vol. 154, no 2, , p. 98-101 (PMID 7720756)
- (en) J. Allen et coll., « Mitral regurgitation after anthracycline treatment for childhood malignancy. », Heart., vol. 85, no 4, , p. 430-432 (PMID 11250971)
- (en) M. B. Lund et coll., « Increased risk of heart valve regurgitation after mediastinal radiation for Hodgkin's disease: an echocardiographic study. », Heart., vol. 75, no 6, , p. 591-595 (PMID 8697163)
- (de) T. Buck et coll., « Aktuelle Empfehlungen zur echokardiographischen Schweregradbeurteilung der Mitralklappeninsuffizienz. », Herz, vol. 31, , p. 30-37
- (en) G. Grossmann et coll., « Value of the proximal flow convergence method for quantification of the regurgitant volume in mitral regurgitation. », Z Kardiol, Springer, vol. 93, , p. 944-953 (DOI 10.1007/s00392-004-0151-8, résumé)
- Nishimura RA, Otto CM, Bonow RO et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: Executive summary: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, J Am Coll Cardiol, 2014;63:2438-2488
- (en) W. Wilson et coll., « Prevention of Infective Endocarditis. Guidelines From the American Heart Association. A Guideline From the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group », Circulation, (PMID 17446442, lire en ligne)
- Bailey CP, O'Neill THE, Glover RP, Jamison WL, Redondo-Ramirez HP, Surgical repair of mitral insufficiency (preliminary report), Dis Chest, 1951;19:125-137
- Lillehei CW, Gott VL, Dewall RA, The surgical treatment of stenotic or regurgitant lesions of the mitral and aortic valves by direct vision utilizing a pump-oxygenator, J Thorac Surg, 1958;35:154-191
- Starr A, Edwards ML, Mitral replacement: clinical experience with a ball-valve prosthesis, Ann Surg, 1961;154:726-740
- Kang DH, Park SJ, Sun BJ et al. Early surgery versus conventional treatment for asymptomatic severe mitral regurgitation: a propensity analysis, J Am Coll Cardiol, 2014;63:2398–2407
- Asgar AW, Mack MJ, Stone GW, Secondary mitral regurgitation in heart failure: Pathophysiology, prognosis, and therapeutic considerations, J Am Coll Cardiol, 2015;65:1231-1248
- Wu AH, Aaronson KD, Bolling SF et al. Impact of mitral valve annuloplasty on mortality risk in patients with mitral regurgitation and left ventricular systolic dysfunction, J Am Coll Cardiol, 2005;45:381–387
- Feldman T, Foster E, Glower DD et al. Percutaneous repair or surgery for mitral regurgitation, N Engl J Med, 2011;364:1395–1406
- (en) I. Adatia et coll., « Clinical course and hemodynamic observations after supraannular mitral valve replacement in infants and children. », J Am Coll Cardiol, vol. 29, , p. 1089–1094 (PMID 9120164)
- (en) S. Chavaud et coll., « Reconstruction surgery in congenital mitral valve insufficiency (Carpentier's techniques): long term results. », J Thorac Cardiovasc Surgery, vol. 115, , p. 84–92 (PMID 9451050)
- (en) A. S. Aharon et coll., « Early and late results of mitral valve repair in children. », J Thorac Cardiovasc Surgery, no 107, , p. 1262–1270 (PMID 8176970)
- Alfieri O, Maisano F, De Bonis M et al. The double-orifice technique in mitral valve repair: a simple solution for complex problems, J Thorac Cardiovasc Surg, 2001;122:674–681
- EVEREST II Investigators, Whitlow PL, Feldman T, Pedersen WR et al. Acute and 12-month results with catheter-based mitral valve leaflet repair the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study, J Am Coll Cardiol, 2012;59:130–139
- (en) M. Enriquez-Sarano et coll., « Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. », Circulation, vol. 90, , p. 830-837 (PMID 8044955)
- (en) J. W. Buchanan, « Prevalence of Cardiovascular Disorders », dans R. F. Fox, D. Sisson, N. S. Moïse, Textbook of Canine and Feline Cardiology: Principles and Clinical Practice., Philadelphia, Saunders, (ISBN 0-7216-4044-3)
- (en) IMPROVE Study Group, « Acute and short-term hemodynamic, echocardiographic and clinical effects of enalapril maleate in dogs with naturally acquired heart failure:results of the Invasive Multicenter Prospective Veterinary Evaluation of Enalapril study. », J Vet Intern Med, vol. 9, , p. 234 (PMID 8523320)
- (de) Antje Michl, Klinische und weiterführende kardiologische Untersuchungen bei Warmblutpferden mit Herzklappeninsuffizienzen : Thèse en médecine vétérinaire, Hanovre, Institut vétérinaire de Hanovre, (lire en ligne)
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Mitralklappeninsuffizienz » (voir la liste des auteurs).
- Portail de la médecine