Inhibiteur de PARP
Un inhibiteur de PARP est un composé chimique agissant comme inhibiteur enzymatique d'une poly(ADP-ribose) polymérase (PARP). De telles molécules forment une classe de médicaments anticancéreux ciblant les cancers caractérisés par une surexpression des enzymes de type PARP, notamment la PARP-1. Les inhibiteurs de PARP s'avèrent améliorer le taux de survie des patientes atteintes de cancer de l'ovaire récidivant sensible aux chimiothérapies à base de platine, comme l'atteste essentiellement l'addition d'olaparib aux traitements conventionnels[1]. Outre leur utilisation comme anticancéreux, les inhibiteurs de PARP sont envisagés comme traitements potentiels contre les atteintes graves à forte létalité telles que l'accident vasculaire cérébral et l'infarctus du myocarde, voire les maladies neurodégénératives à évolution lente[2].
Mode d'action
Les protéines BRCA1, BRCA2 et PALB2[3] jouent un rôle important dans la réparation des lésions doubles brins de l'ADN par recombinaison homologue (HRR), un mode de réparation fiable dont le taux d'erreurs est faible. Lorsqu'une mutation intervient sur l'un de ces gènes, elle peut altérer le mécanisme de réparation de l'ADN, ce qui peut à son tour entraîner l'apparition d'un cancer du sein. Lorsque trop de lésions à l'ADN s'accumulent, l'altération d'un tel gène peut entraîner la mort des cellules.
La PARP-1 est une enzyme importante dans la réparation des lésions simples brins de l'ADN. Lorsque de telles lésions s'accumulent sans être réparées jusqu'à la réplication de l'ADN, qui précède la division cellulaire, cette dernière peut conduire à la formation de lésions doubles brins[4]. Les inhibiteurs de la PARP-1 provoquent ainsi l'accumulation de lésions doubles brins, qui sont réparées normalement de façon fiables par les cellules saines, lesquelles de copies saines à la fois des gènes BRCA1, BRCA2 et PALB2, tandis que ces lésions ne sont pas réparées par les cellules cancéreuses, dont l'un de ces gènes est altéré, ce qui conduit à la mort de ces cellules.
Certaines cellules cancéreuses dépourvues de protéines PTEN de contrôle tumoral peuvent être plus sensibles aux inhibiteurs de PARP en raison de l'inhibition de la protéine RAD51, constituant critique de la recombinaison homologue, bien que d'autres données laissent penser que PTEN n'agit pas sur RAD51[5], de sorte que les tumeurs déficientes en PTEN, telles que certains cancers de la prostate agressifs, peuvent être plus sensibles aux inhibiteurs de PARP.
Exemples de molécules
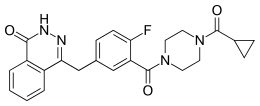
Plusieurs molécules sont commercialisées, tels que l'olaparib, le rucaparib, le niraparib. D'autres sont en cours de test, comme l'iniparib, le talazoparib, le veliparib.
Notes et références
- (en) Alison J. Wiggans, Gemma K. S. Cass, Andrew Bryant, Theresa A. Lawrie et Jo Morrison, « Poly(ADP-ribose) polymerase (PARP) inhibitors for the treatment of ovarian cancer », The Cochrane Database of Systematic Reviews, no 5, , CD007929 (PMID 25991068, DOI 10.1002/14651858.CD007929.pub3, lire en ligne)
- (en) Grazia Graziani et Csaba Szabó, « Clinical perspectives of PARP inhibitors », Pharmacological Research, vol. 52, no 1, , p. 109-118 (PMID 15911339, DOI 10.1016/j.phrs.2005.02.013, lire en ligne)
- (en) Rémi Buisson, Anne-Marie Dion-Côté, Yan Coulombe, Hélène Launay, Hong Cai, Alicja Z. Stasiak, Andrzej Stasiak, Bing Xia et Jean-Yves Masson, « Cooperation of breast cancer proteins PALB2 and piccolo BRCA2 in stimulating homologous recombination », Nature Structural & Molecular Biology, vol. 17, no 10, , p. 1247-1254 (PMID 20871615, PMCID 4094107, DOI 10.1038/nsmb.1915, lire en ligne)
- (en) Peter McGlynn et Robert G. Lloyd, « Recombinational repair and restart of damaged replication forks », Nature Reviews Molecular Cell Biology, vol. 3, no 11, , p. 859-870 (PMID 12415303, DOI 10.1038/nrm951, lire en ligne)
- (en) Arun Gupta, Qin Yang, Raj K. Pandita, Clayton R. Hunt, Tao Xiang, Sandeep Misri, Sicong Zeng, Julia Pagan, Jessie Jeffery, Janusz Puc, Rakesh Kumar, Zhihui Feng, Simon N. Powell, Audesh Bhat, Tomoko Yaguchi, Renu Wadhwa, Sunil C. Kaul, Ramon Parsons, Kum Kum Khanna et Tej K. Pandita, « Cell cycle checkpoint defects contribute to genomic instability in PTEN deficient cells independent of DNA DSB repair », Cell Cycle, vol. 8, no 14, , p. 2198-2210 (PMID 19502790, DOI 10.4161/cc.8.14.8947, lire en ligne)
- Portail de la biochimie
- Portail de la pharmacie