Diisopropylfluorophosphate
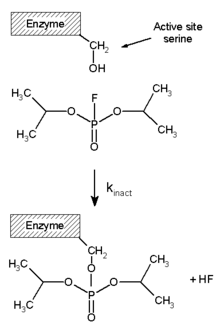
Le diisopropylfluorophosphate (DFP, DIFP), ou fluorophosphate de diisopropyle, est un composé chimique de formule (H3C)2HC–O–P(=O)F–O–CH(CH3)2. Il se présente sous la forme d'un liquide incolore huileux faiblement volatil et qui se décompose au contact de l'eau. C'est une neurotoxine qui agit en inhibant l'acétylcholinestérase par une « réaction suicide » dans le site actif de cette enzyme, ce qui bloque la dégradation de l'acétylcholine, un neurotransmetteur. Il s'ensuit une dépolarisation persistante des synapses par l'acétylcholine qui n'est plus dégradée dans les cellules exposées au DIFP, ce qui conduit à des paralysies et à la mort lorsque les muscles respiratoires sont atteints.
| Diisopropylfluorophosphate | |||
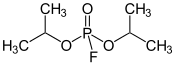  Structure du diisopropylfluorophosphate |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | bis(propan-2-yl)fluorophosphate | ||
| Synonymes |
fluorophosphate de diisopropyle, fluostigmine |
||
| No CAS | |||
| No ECHA | 100.000.225 | ||
| No EC | 200-247-6 | ||
| Code ATC | S01 | ||
| PubChem | 5936 | ||
| ChEBI | 17941 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore huileux[1] | ||
| Propriétés chimiques | |||
| Formule brute | C6H14FO3P [Isomères] |
||
| Masse molaire[2] | 184,1457 ± 0,0067 g/mol C 39,13 %, H 7,66 %, F 10,32 %, O 26,07 %, P 16,82 %, |
||
| Propriétés physiques | |||
| T° fusion | −82 °C[1] | ||
| T° ébullition | 186 °C[1] | ||
| Masse volumique | 1,055 g·cm-3[1] à 20 °C | ||
| Pression de vapeur saturante | 28 Pa[1] à 20 °C | ||
| Précautions | |||
| SGH[1] | |||
 Danger |
|||
| Transport[1] | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le DIFP est aussi un inhibiteur très efficace des protéases à serine, dont le mécanisme catalytique est très similaire à celui de l'acétylcholinestérase, caractérisé par la présence d'une sérine réactive. Il est parfois utilisé comme tel en biochimie, pour éviter la protéolyse lors des purifications de protéines.
Notes et références
- Entrée de « Diisopropyl fluorophosphate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 avril 2014 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la chimie
