Griséofulvine
La griséofulvine est un antifongique utilisé comme médicament et administré uniquement par voie orale chez l'homme et chez l'animal pour traiter les dermatophytoses étendues sur la peau et les phanères (ongles, poils, cheveux)[3]. Elle est synthétisée par certaines souches de Penicillium griseofulvum, une moisissure à partir de laquelle elle a été isolée en 1939[4].
| Griséofulvine | |
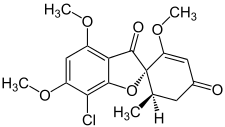 Structure de la griséofulvine |
|
| Identification | |
|---|---|
| Nom UICPA | (2S,6’R)-7-chloro-2’,4,6-triméthoxy-6’-méthyl-3H,4’H-spiro[1-benzofuran-2,1’-cyclohex[2]ène]-3,4’-dione |
| Synonymes |
amudane |
| No CAS | |
| No ECHA | 100.004.335 |
| No EC | 204-767-4 |
| No RTECS | WG9800000 |
| Code ATC | D01 D01 |
| DrugBank | DB00400 |
| PubChem | 441140 |
| ChEBI | 27779 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C17H17ClO6 [Isomères] |
| Masse molaire[1] | 352,766 ± 0,019 g/mol C 57,88 %, H 4,86 %, Cl 10,05 %, O 27,21 %, |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Ce médicament agit en se liant à la kératine pour former un complexe qui remplace progressivement la kératine seule. Les dermatophytes, qui se nourrissent de kératine, absorbent ce complexe, permettant à la griséofulvine de se lier à la tubuline de leur cellule, ce qui altère la formation des microtubules et bloque la mitose.
À forte dose, la griséofulvine peut être cancérogène et affecter la fertilité du patient. Les effets secondaires les plus courants sont des troubles du sommeil, des étourdissements, des céphalées ainsi que, parfois, des rhumatismes.
La griséofulvine pourrait également présenter un effet anti-prolifératif sur certaines cellules cancéreuses et inhiber la croissance tumorale chez des souris athymiques. In vitro, l'apoptose induite pour les cellules cancéreuses[5] n'a pas été observée pour les cellules saines[6],[7],[8].
Elle fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[9].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Tripathi, Textbook of Pharmacology, Jaypee Brothers, 761–762 p. (ISBN 81-8448-085-7)
- (en) Leon Goldman, Jan Schwarz, Robert H. Preston, Amanda Beyer et James Loutzenhiser, « Current status of griseofulvin: Report on one hundred seventy-five cases », Journal of the American Medical Association, vol. 172, no 6, , p. 532-538 (DOI 10.1001/jama.1960.03020060022006, lire en ligne)
- (en) Yih-Huei Uen, Der-Zen Liu, Meng-Shih Weng, Yuan-Soon Ho et Shyr-Yi Lin, « NF-κB pathway is involved in griseofulvin-induced G2/M arrest and apoptosis in HL-60 cells », Journal of Cellular Biochemistry, vol. 101, no 5, , p. 1165-1175 (PMID 17226769, DOI 10.1002/jcb.21240, lire en ligne)
- (en) Blanka Rebacz, Thomas O. Larsen, Mads H. Clausen, Mads H. Rønnest, Harald Löffler, Anthony D. Ho et Alwin Krämer, « Identification of Griseofulvin as an Inhibitor of Centrosomal Clustering in a Phenotype-Based Screen », Cancer Research, vol. 67, no 13, , p. 6342-6350 (PMID 17616693, DOI 10.1158/0008-5472.CAN-07-0663, lire en ligne)
- (en) Dulal Panda, K. Rathinasamy, Manas K. Santra et Leslie Wilson, « Kinetic suppression of microtubule dynamic instability by griseofulvin: Implications for its possible use in the treatment of cancer », Proceedings of the National Academy of Sciences of the United States of America, vol. 102, no 28, , p. 9878-9883 (PMID 15985553, PMCID 1174985, DOI 10.1073/pnas.0501821102, lire en ligne)
- (en) Parminder Singh, Krishnan Rathinasamy, Renu Mohan et Dulal Panda, « Microtubule assembly dynamics: An attractive target for anticancer drugs », IUBMB Life, vol. 60, no 6, , p. 368-375 (PMID 18384115, DOI 10.1002/iub.42, lire en ligne)
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Portail de la chimie
- Portail de la pharmacie
- Portail de la mycologie