Acide salicylique
L'acide salicylique ou acide 2-hydroxybenzoïque est un composé organique aromatique, l'un des trois isomères de l'acide hydroxybenzoïque, constitué d'un noyau benzénique substitué par un groupe carboxyle (acide benzoïque) et un groupe hydroxyle (phénol) en position ortho. C'est un solide cristallin incolore qu'on trouve naturellement dans certains végétaux, dont le saule (d'où il tire son nom), utilisé comme médicament et comme précurseur de l'acide acétylsalicylique, l'aspirine.
| Acide salicylique | |
 | |
| Identification | |
|---|---|
| Nom UICPA | Acide 2-hydroxybenzoïque |
| Synonymes |
Acide ortho-hydroxybenzoïque |
| No CAS | |
| No ECHA | 100.000.648 |
| No EC | 200-712-3 |
| Code ATC | D01, D11, N02, S01 |
| PubChem | |
| FEMA | 3985 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline incolore ou cristaux en forme d'aiguilles[1] |
| Propriétés chimiques | |
| Formule brute | C7H6O3 [Isomères] |
| Masse molaire[2] | 138,1207 ± 0,0069 g/mol C 60,87 %, H 4,38 %, O 34,75 %, |
| pKa | pKa1 = 2,98 à 20 °C (acide carboxylique); pKa2 = 13,6 (phénol)[3] |
| Propriétés physiques | |
| T° fusion | 159 °C[1], Point de sublimation : 76 °C[1] |
| T° ébullition | 211 °C à 20 Torr[3] |
| Solubilité | 1,2 g·kg-1 (eau, 0 °C), 1,4 g·kg-1 (eau, 10 °C), |
| Masse volumique | 1,443 g·cm-3 (20 °C/4 °C)[4] |
| T° d'auto-inflammation | 540 °C[1] |
| Point d’éclair | 157 °C (coupelle fermée)[4] |
| Pression de vapeur saturante | 0,0 Pa (20 °C), 0,1 Pa (40 °C), |
| Thermochimie | |
| Cp | |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21/a [6] |
| Paramètres de maille | a = 11,520 Å b = 11,210 Å |
| Volume | 635,30 Å3 [6] |
| Propriétés optiques | |
| Indice de réfraction | 1,565 [3] |
| Précautions | |
| SIMDUT[7] | |
 D2A, |
|
| NFPA 704 | |
| Directive 67/548/EEC | |
 Xn Phrases R : 22, 41, Phrases S : 22, 24, 26, 39, |
|
| Écotoxicologie | |
| LogP | 2,26 [3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
L'acide salicylique est naturellement synthétisé par certains végétaux (comme la reine-des-prés ou le saule), on le retrouve notamment dans des fruits, sous forme estérifiée de salicylate de méthyle. Il peut agir comme un signal hormonal pouvant déclencher, dans certains cas, une thermogenèse végétale[8].
Propriétés
Ingéré en grandes quantités, c'est un produit toxique, mais en de moindres quantités il est utilisé comme conservateur alimentaire et antiseptique.
Les propriétés médicales de l'acide salicylique sont connues depuis longtemps, surtout pour son action contre la fièvre. On l'extrayait principalement du saule, salix en latin dont il tire son nom. Dans la lutte contre la fièvre, il est désormais supplanté par d'autres médicaments plus efficaces comme l'aspirine (qui en est un dérivé), ou le paracétamol.
Il n'est désormais plus utilisé pour son action apaisante (analgésique) et on le retrouve dans de nombreux produits en dermatologie en complément d'un autre principe actif. Il est par exemple utilisé dans le traitement de l'acné, des verrues ou de l'hyperhidrose.
Synthèse et propriétés chimiques
Le groupement acide carboxylique (-COOH) peut réagir avec un alcool en donnant de nombreux esters. Le groupe hydroxyle peut réagir avec l'acide acétique pour former de l'acide acétylsalicylique, ou aspirine.
Industriellement, l'acide salicylique est synthétisé par la réaction de Kolbe :
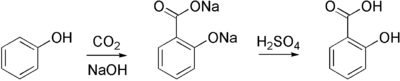
L'acide salicylique forme avec l'ion salicylate un couple acide/base de formule C6H4OHCOOH / C6H4OHCOO-.
Toxicité
Vapeurs irritantes pour les muqueuses oculaires et respiratoires. Produit inflammable
Divers
L'acide salicylique fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[9].
Notes et références
- ACIDE SALICYLIQUE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Salicylic acid », sur Hazardous Substances Data Bank (consulté le 17 février 2010)
- (en) Mary R. Thomas, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Salicylic acid and related compounds, vol. 21, John Wiley & Sons.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- « Salicylic acid », sur www.reciprocalnet.org (consulté le 12 décembre 2009)
- « Acide salicylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Giberneau M, Brabé D, Des fleurs « à sang chaud », Pour la Science, Septembre 2007, p 50-56
- WHO Model List of Essential Medicines, 18th list, avril 2013
Voir aussi
- Acide thiosalicylique
- Portail de la médecine
- Portail de la chimie
- Portail de la pharmacie
